A blueprint for tumor infiltrating B cells across human cancers
引言:肿瘤浸润性 B 细胞已成为癌症免疫中的重要因素,并作为对免疫治疗反应的预测指标。这些 B 细胞展示了多种功能,主要通过其分化成浆细胞来产生抗体,但在不同癌症类型中的空间和时间分布各不相同。解析不同癌症类型中 B 细胞的丰度和分化状态,对于提高免疫治疗反应具有重要意义。
理由:为了编制全面的泛癌症 B 细胞图谱,我们对各种癌症类型患者的配对肿瘤、淋巴结转移、邻近正常组织以及外周血进行了单细胞 RNA 测序(scRNA-seq),并整合了大量已发表的 scRNA-seq 数据集。在校正批次效应后,这一图谱包含来自 269 名患者的 20 种癌症类型的 scRNA-seq 数据。我们结合了单个 B 细胞的 B 细胞受体(BCR)测序与基因表达谱,以表征 B 细胞与抗体分泌细胞(ASCs)之间的动态转换。我们整合了来自不同癌症的 B 细胞的单细胞染色质可及性景观,以解析在微调 B 细胞发育中起作用的表观遗传调控网络。我们在成熟与未成熟的第三方淋巴结构(TLSs)中定位了 B 细胞,并研究了指导 B 细胞产生特定反应的潜在调节因子。
B 细胞是适应性免疫系统的重要组成部分,在体液免疫反应和抗体生成中发挥核心作用。在肿瘤微环境(TME)中,肿瘤浸润 B 细胞(TIBs)表现出显著的功能异质性,涵盖从初级 B 细胞、记忆 B 细胞(Bm)、生发中心(GC)B 细胞到抗体分泌细胞(ASCs,包括浆母细胞和浆细胞),主要基于它们的免疫表型。然而,当前的 B 细胞研究范式大多是假设驱动的,可能无法无偏见地捕捉肿瘤环境中 B 细胞状态的全谱。最近的报告指出,B 细胞在产生针对肿瘤相关抗原的抗体、促进吞噬作用以及向 CD8+ T 细胞呈递抗原方面具有抗肿瘤能力,表明 B 细胞可用于下一代免疫疗法。空间上,这些细胞在第三方淋巴结构(TLS)中与 T 细胞密集相互作用,这与多种癌症中生存率提高和热肿瘤环境相关。然而,TIBs 也显示出通过释放细胞因子、形成免疫复合体和参与免疫检查点的肿瘤促进属性。这些观察结果强调了 B 细胞的阴阳作用,并突显了需要对人类癌症中 B 细胞进行全面的数据驱动分析的必要性。
历史上,长期以来认为 ASCs 源自 GC 反应。在这种情况下,B 细胞遇到抗原,经历体细胞高频突变、类转换重组(CSR)和克隆扩增,最终分化成长寿命的浆细胞并产生高亲和力抗体。另外,最近发现的外滤泡(EF)分化途径揭示了短寿命的 ASCs,产生低亲和力和多反应性抗体。EF 相关 B 细胞在老龄化小鼠、自身免疫疾病和慢性感染模型中被记录为年龄相关 B 细胞(ABCs)、双阴性 B 细胞(BDN)或非典型记忆(AtM)B 细胞,其特征为 CD21-CD11c+,并表达 T-box 转录因子(T-bet)。我们和其他独立研究组也报告了如 Toll 样受体 7/9(TLR7/9)、干扰素 γ(IFNg)、白细胞介素 -21(IL-21)和 CD40 等信号在自身免疫疾病中驱动 EF 相关 B 细胞状态发展的作用。这些数据提出了一个关键问题:B 细胞的命运由什么组成,以及如何在癌症生态系统中精确调控。因此,系统地解码癌症中 B 细胞的发展层级可能会揭示肿瘤特异性模式以及克隆谱系。
在这项研究中,我们编制了涵盖 20 种不同人类癌症的 TIBs 图谱。我们系统地表征了 15 种 B 细胞亚群,并识别了之前未被认识的 AtM B 细胞以及 TME 中 EF 途径的存在。我们的数据揭示了两种不同的 ASC 分化途径—GC 和 EF 路径—显示出癌症类型偏好。我们特别描述了与常规 GC B 细胞相比的 AtM B 细胞的独特表型、功能、TLS 定位和临床意义。特别是,肿瘤浸润的 AtM B 细胞,EF 来源 ASCs 的祖细胞,表现出耗竭和旁观者表型,并独立于 GC 发展。我们将这些发现与特定的转录因子和表观遗传调控相关联,并展示了代谢微环境的影响,其中谷氨酰胺在调节 AtM B 细胞分化和采纳免疫调节功能中起作用。我们的研究提供了前所未有的大规模 B 细胞转录组数据,作为研究 TIBs 并可能指导有效的 B 细胞导向癌症免疫治疗策略的宝贵资源。
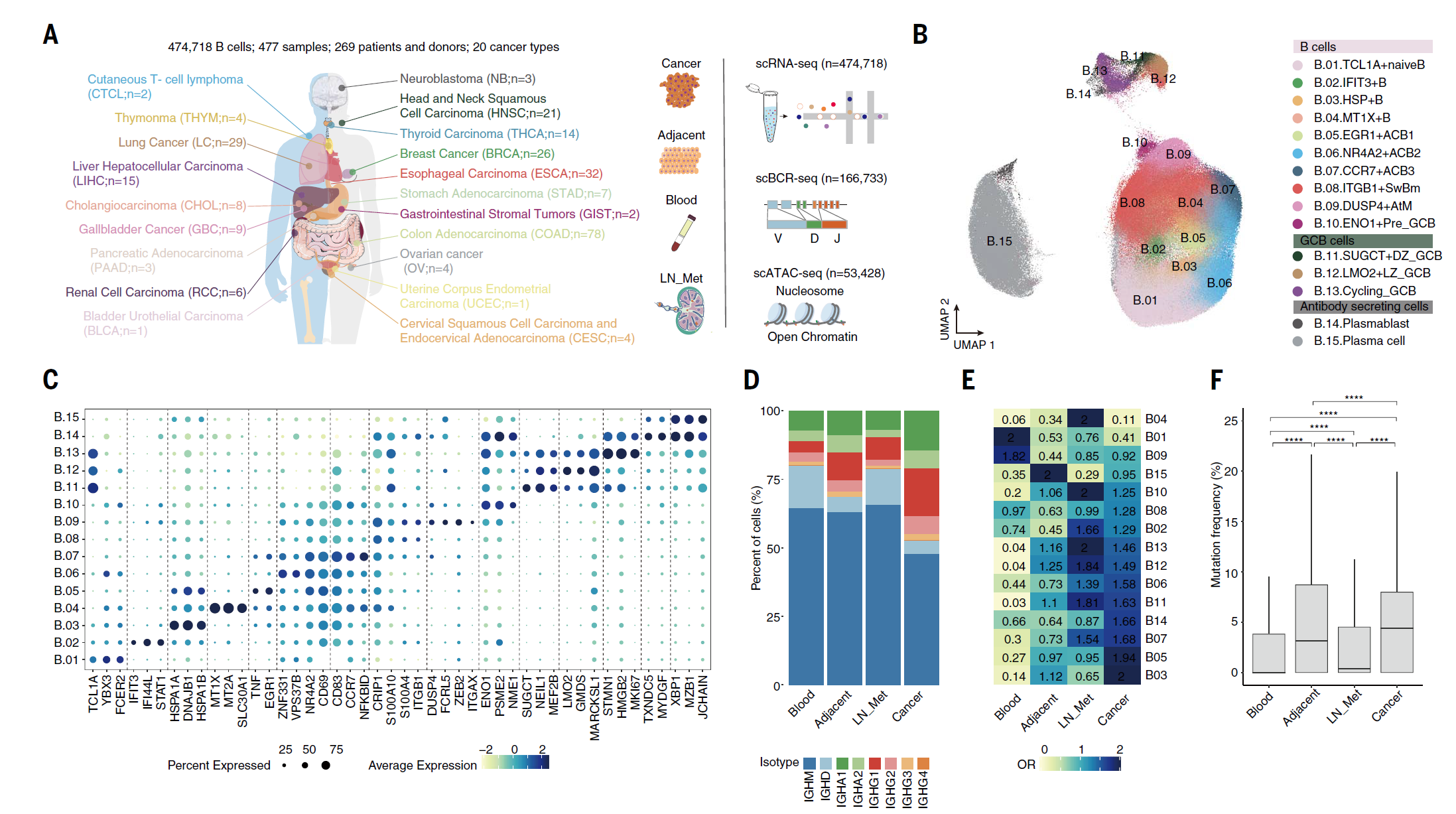
图 1. 跨不同人类癌症的 B 细胞单细胞分析。 (A) 泛癌症单细胞转录组、B 细胞受体(BCR)复合体以及 B 细胞染色质可及性的示意图。 (B) 15 种 B 细胞亚群的均匀流形逼近和投影(UMAP)可视化。 (C) B 细胞亚群中标志基因表达的点图。颜色代表标志基因的最大归一化平均表达,大小表示表达这些基因的细胞百分比。 (D) 堆叠条形图显示相应组织中总 B 细胞的同种型分布。 (E) 热图显示各组织中 B 细胞亚群分布的比率(ORs)。OR 值表示在相应组织中的偏好分布。 (F) 不同组织中总 B 细胞的免疫球蛋白 H(IgH)链上超突变频率的箱形图。数据显示中位数及四分位数范围(IQR),须线表示最小和最大测量值。 ****P < 0.0001。P 值由双侧 Wilcoxon 检验确定。
结果¶
跨人类癌症的单个 B 细胞转录组蓝图¶
B 细胞浸润在不同的人类癌症类型中高度变异。为了理解 B 细胞的总体浸润模式,我们基于六种现有去卷积算法的共识,评估了癌症基因组图谱(TCGA)泛癌症数据集(包括 8863 个肿瘤样本,涵盖 31 种癌症类型)中 B 细胞浸润的丰度(图 S1A)。我们选取了具有高和中等肿瘤内 B 细胞得分的癌症类型进行进一步采样。从 15 种人类癌症类型的 66 名患者的 153 个样本中分选出 CD19+ B 细胞,包括匹配的肿瘤、淋巴结转移(LN_Mets)、邻近正常组织和外周血,随后进行了配对的单细胞 RNA 测序(scRNA-seq)和单细胞 B 细胞受体测序(scBCR-seq)(图 1A 和图 S1B)。我们还整合了包含 TIBs 的多种已发表数据集,使用 Harmony 算法(25)校正批次效应,并最终在 20 种癌症类型的 269 名捐献者的 477 个样本中建立了单细胞转录组图谱。经过严格的质量控制,我们获得了总共 474,718 个单 B 细胞转录组,其中 69.24% 是在本研究中新生成的(图 S1C 和表 S1)。对于 scBCR-seq,共产生了 166,733 个细胞,来自 150,949 个克隆型,涵盖 15 种癌症类型的 61 名捐献者,每个克隆型至少携带一对生产性重链和轻链,其中 12.76% 为克隆型(≥ 两个 B 细胞含有相同的 BCR 对),对应 21,268 个扩展克隆型。总体而言,我们的单细胞图谱为 B 细胞研究创建了一个泛癌症蓝图(可在 http://pancancer.cn/B/ 获取)。
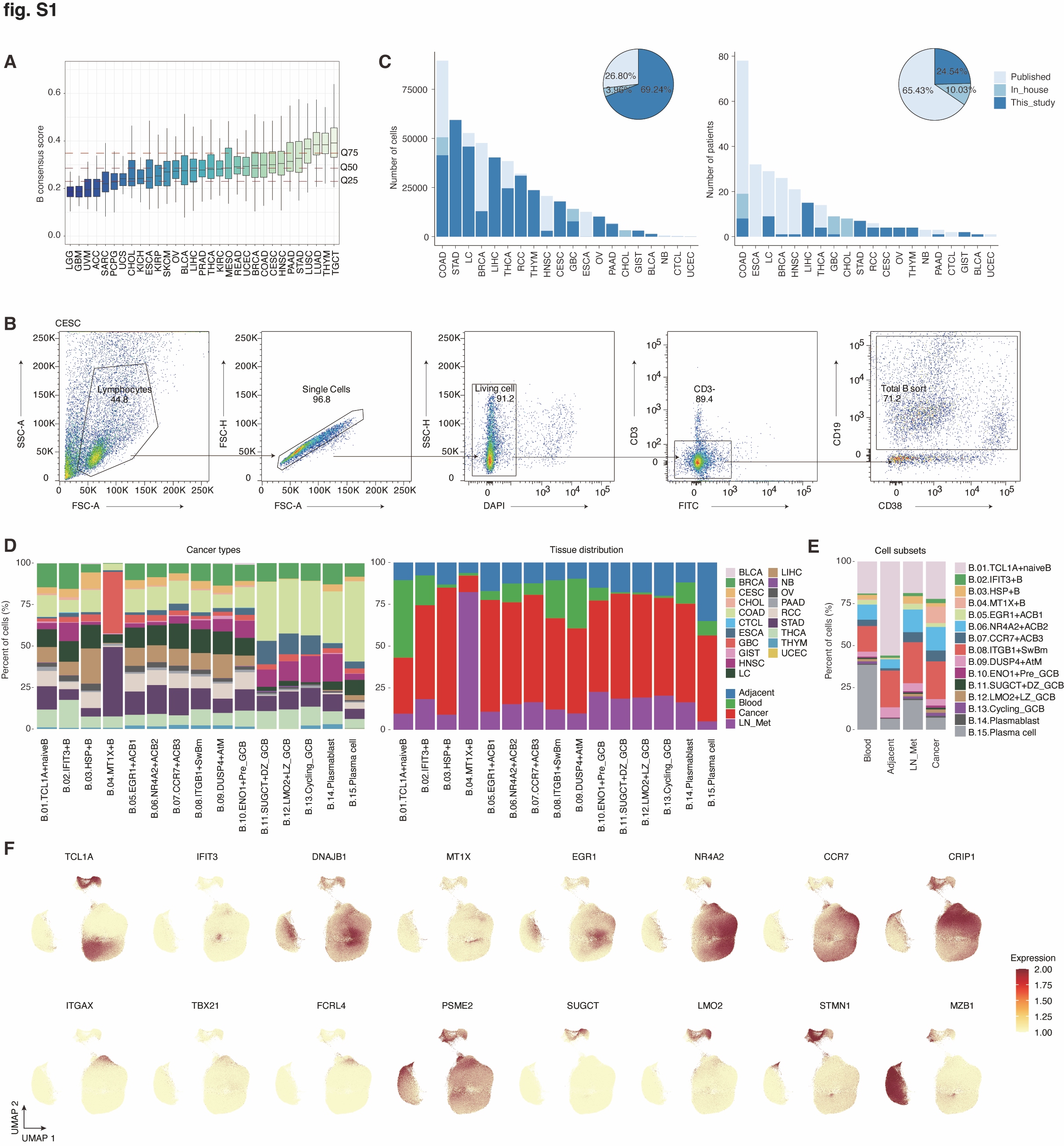
图 S1. 患者队列和 B 细胞亚群信息。 (A) 癌症基因组图谱(TCGA)泛癌种肿瘤样本的 B 细胞一致性浸润水平。 (B) 代表性流式图显示在一个宫颈鳞状细胞癌(CESC)样本中(B 细胞浸润水平为中等)的分选策略。 (C) 泛癌 B 细胞研究包括的患者和细胞数量。详细的样本信息在表 S1 中提供。 (D) 条形图显示癌症类型(左侧)和 B 细胞亚群的组织分布(右侧)。 (E) 条形图显示主要组织群中 15 种 B 细胞亚群的相对细胞比例。 (F) UMAP 图显示 B 细胞亚群的典型标记基因的表达。
B 细胞的转录多样性¶
无监督聚类分析鉴定出 15 个独特的 B 细胞亚群,这些亚群在各种癌症类型中均可重复观察到,并表现出明显的组织和癌症类型偏好(图 1B;图 S1, D 和 E;表 S2)。其中,典型的 B 细胞亚群代表了不同的 B 细胞成熟阶段,包括一个初级 B 细胞(TCL1A、FCER2 和 IGHD)、三个活化 B 细胞(ACBs;CD69 和 CD83)、一个记忆 B 细胞(Bm;CRIP2 和 ITGB1)、三个生发中心 B 细胞(LMO2+ 轻带、CXCR4+ 暗带和 MKI67+ 周期性),以及两个抗体分泌细胞(包括 TXNDC5+ 浆母细胞和 MZB1+ 浆细胞)(图 1C 和图 S1F)。
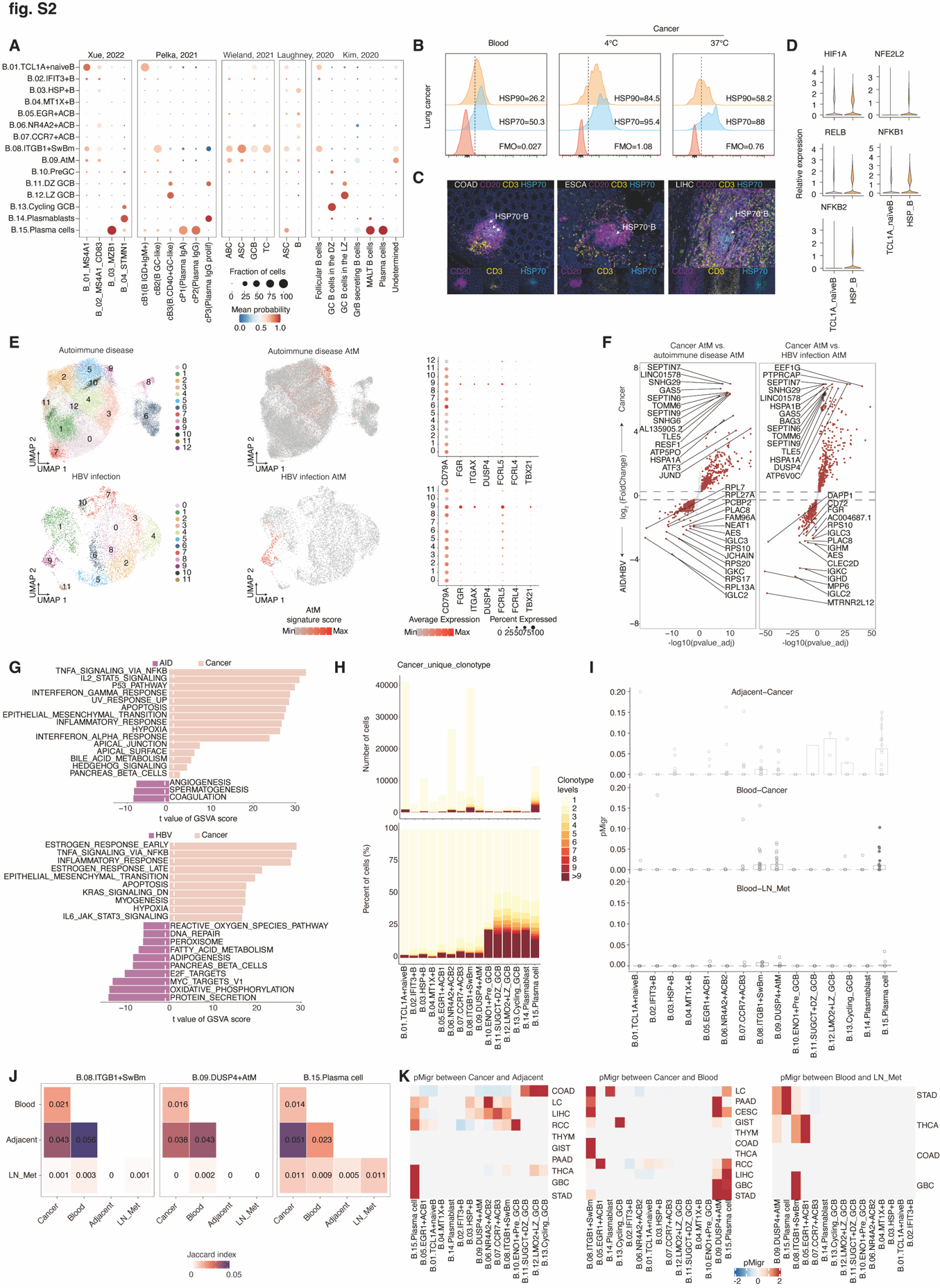
图 S2. B 细胞亚群的转录和 BCR 特征 (A) 我们研究中的 B 细胞亚群和注释(行)与五项先前研究中的注释(列)进行比较,这些研究分别是 Xue 等人(26),Pelka 等人(27),Wieland 等人(28),Laughney 等人(30)和 Kim 等人(29)。比较是根据使用我们的数据作为参考的 CellTypist(135)训练的逻辑回归模型进行的。颜色标尺代表预测特定细胞类型的平均概率,点的大小代表被预测为特定细胞类型的细胞百分比。 (B) 肺癌(LC)患者配对的血液和肿瘤浸润 B 细胞中 HSP70 和 HSP90 表达的代表性流式图。这些数据展示了不同解离方法的影响。 (C) 多重免疫组化(IHC)染色的代表性图像显示结直肠腺癌(COAD)、食管癌(ESCA)和肝细胞癌(LIHC)中 HSP70+ 受压 B 细胞。白色箭头表示 HSP70+ 受压 B 细胞。 (D) 小提琴图显示在初级和受压 B 细胞间低氧相关基因表达的差异。 (E) 左侧面板:UMAP 图显示自身免疫疾病数据集(顶部)的 12 个 B 细胞簇和 HBV 感染数据集(底部)的 11 个 B 细胞簇。中间面板:自身免疫疾病数据集(顶部)和 HBV 感染数据集(底部)中 AtM B 细胞的特征得分。右侧面板:自身免疫疾病数据集(顶部)和 HBV 感染数据集(底部)中 AtM B 细胞特征基因表达的点图。颜色代表标记基因的最大标准化平均表达,大小代表表达这些基因的细胞百分比。簇 9 富含 AtM B 细胞特征。 (F) 火山图显示肿瘤与自身免疫疾病(左侧)或 HBV 感染(右侧)衍生的 AtM B 细胞之间差异表达的基因。每个红点表示具有 Benjamini-Hochberg 调整后 P 值<0.05 的单个基因,使用双侧 t 检验。标记了 Top15 基因。 (G) 通过 GSVA 分析,肿瘤与自身免疫疾病(顶部)或 HBV 感染(底部)衍生的 AtM B 细胞之间富集的差异通路。使用双侧未配对 limma-moderated t 检验。 (H) 条形图堆叠显示 15 个 B 细胞亚群中癌症特异性扩展克隆的频率(顶部)和密度(底部)。 (I) 盒形图显示癌症与邻近正常组织、癌症与血液或淋巴结转移与血液之间的双向迁移指数(pMigr)的分布。每个点代表一个捐赠者。 (J) 三角热图显示 Bm、AtM 和浆细胞在四种组织类型中扩展的 BCR 克隆类型的重叠。数据为每个患者组内汇总。数字表示每对组织类型共享的扩展 BCR 克隆类型的标准化 Jaccard 指数。 (K) 热图显示癌症与邻近正常组织、癌症与血液或淋巴结转移与血液之间的 pMigr 得分,按癌症类型分层。颜色代表按行缩放的 pMigr 值的 z 分数。
我们接下来鉴定了四个以前大多未被描述的亚群(26-30)(图 S2A)。第一个是干扰素刺激基因阳性的初级 B 细胞亚群(B_02),它高表达 IFIT3、IFI44L 和 ISG15,与受伤相关,并在粘膜愈合期间扩展(31)。第二个亚群是应激 B 细胞(B_03),在肿瘤中占主导地位,高表达热休克蛋白,经 37°C 胶原酶和 4°C 机械分离以及多重免疫组化(mIHC)验证(图 S2,B 和 C)。与应激 T 细胞相比(32),应激 B 细胞也位于 TLS 中心,高表达与缺氧相关的基因,如 HIF1A、NFE2L2、RELB、NFKB1 和 NFKB2(图 S2D)。第三个亚群是前生发中心 B 细胞(B_10),与邻近正常组织和血液相比,在淋巴结转移和肿瘤中高度富集,表达 PSME2、NME1 和 ENO1。前生发中心 B 细胞在转录上类似于初级 B 细胞、生发中心 B 细胞和浆母细胞,表明它们的过渡阶段(图 1C)。
我们鉴定的第四个亚群是此前未知的非典型记忆 B 细胞亚群(B_09),表达 DUSP4、ITGAX(CD11c)、FCRL5、ZEB2 和 FGR。此前,这种亚群被记录为年龄相关 B 细胞、CD27−IgD− 双阴性 B 细胞、FCRL4+ B 细胞或在老龄化小鼠、自身免疫疾病、扁桃体和慢性感染中报告的耗竭 Bm 细胞(16, 19, 23, 24),现在显示它们在 TME 中广泛存在(图 1C)。我们收集并分离了自身免疫疾病和乙型肝炎病毒(HBV)感染数据集中已发表的 scRNA-seq AtM B 细胞(表 S1),并进行了差异表达基因分析,显示肿瘤浸润的 AtM B 细胞高表达与应激相关的基因(FOSB 和 HSPA1A)、干扰素诱导的基因(IFITM1 和 IFI30)和激活相关的基因(CD83、NR4A1 和 CD69),而与初级相关的基因(TXNIP 和 IGHD)和代谢相关的基因(MT-ATP6 和 NDUFB1)在自身免疫疾病和 HBV 感染中富集(图 S2,E 和 F 及表 S2)。同样,肿瘤中的 AtM B 细胞在炎症反应和缺氧途径中富集,而自身免疫疾病和 HBV 感染中则主要是血管生成和代谢途径(图 S2G)。这些数据强调,在 TME 中的 AtM B 细胞在功能上可能有所不同,尽管它们在表型上与自身免疫疾病和病毒感染中的细胞一致。
综合分析组织分布、转录和复合体特征突出了来自不同组织源的潜在肿瘤反应性 B 细胞。TIBs 含有比非肿瘤组织的 B 细胞更多的 IGHG 和 IGHA,而血液中的 B 细胞富含 IGHD 和 IGHM,表明 TIBs 经历了抗原体验并进行了类转换重组(CSR)(图 1D)。通过比率(OR)分析(33),HSP+ B 细胞、EGR1+ACBs 和浆母细胞在肿瘤中有强烈偏好;MT1X+ B 细胞、周期性 GC B 细胞、前生发中心 B 细胞、GCLZ、GCDZ 和 IFIT3+ B 细胞在淋巴结转移中显著富集;TCL1A+ 初级 B 细胞和 DUSP4+ AtM B 细胞在血液中最高;而 MZB1+ 浆细胞在邻近正常组织中占主导(图 1E)。再次,与其他组织中的相比,TIBs 的 IGH 突变显著增多,GC B 细胞和两个 ASC 亚群显示出肿瘤特异的克隆扩张,表明它们具有强烈的抗原驱动的抗体亲和力(图 1F 和图 S2H)。此外,ITGB1+ Bm 和 DUSP4+ AtM B 细胞在肿瘤、淋巴结转移和血液中的富集程度相当,略高于邻近正常组织,暗示了跨组织迁移潜力。实际上,STARTRAC 迁移指数(pMigr)(34),用于量化组织间迁移的可能性,以及 Jaccard 指数(35),显示了不同组织间共享 BCR 克隆的数量,表明 ITGB1+ Bm 和 AtM B 细胞在血液与淋巴结转移或肿瘤之间有适度的流动性,在大约一半的癌症中观察到(图 S2,I 至 K)。
肿瘤浸润的抗体分泌细胞(ASCs)的异质性¶
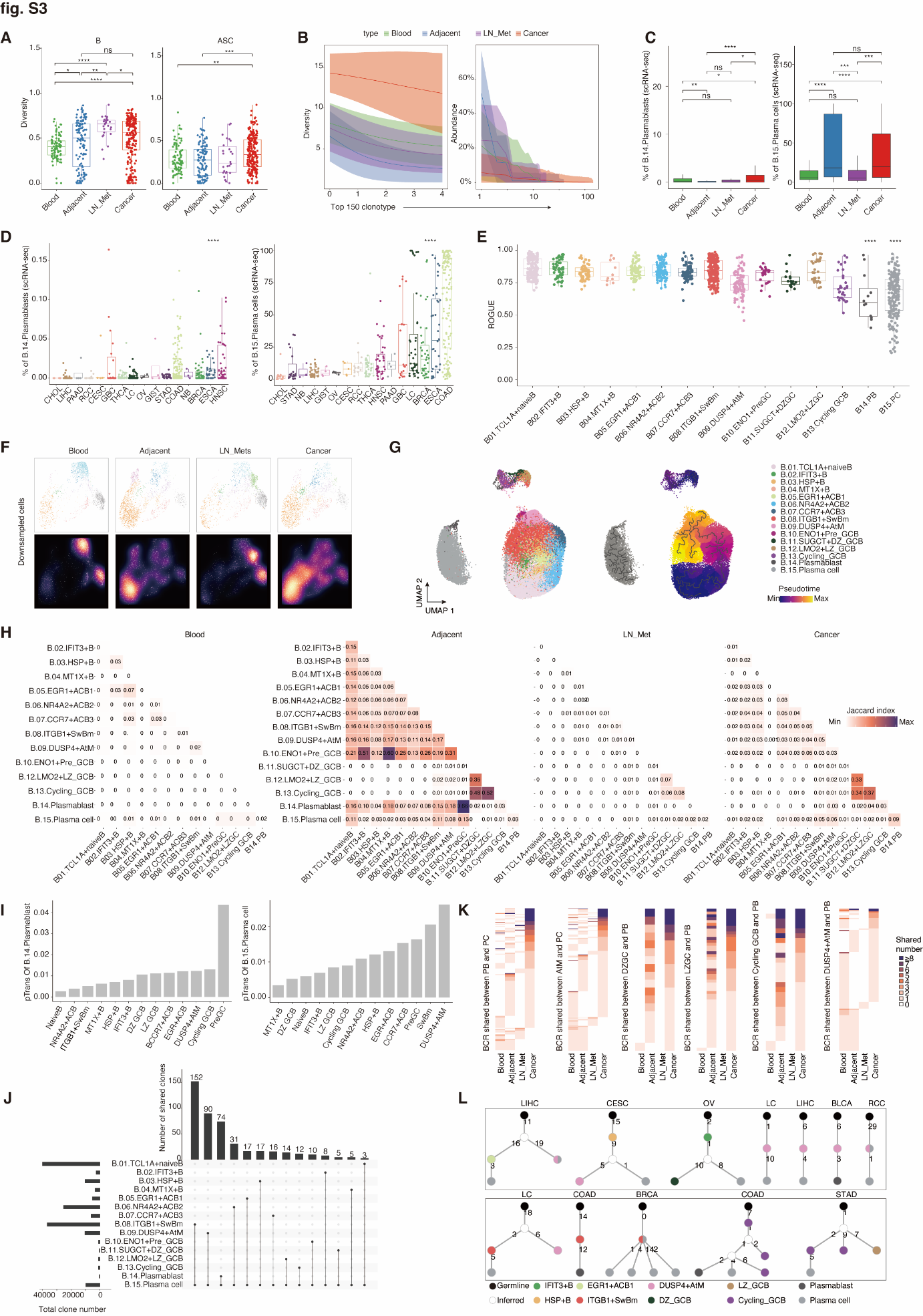
图 S3. 肿瘤浸润的浆细胞显示出增加的异质性和独特的发展路径。 (A) 盒形图显示主要组织群中 B 细胞和 ASC 组成的多样性分布,通过 Shannon 多样性指数测量。 (B) B 细胞受体(BCR)克隆型多样性(左)和血液、邻近正常组织、淋巴结转移(LN_Met)和癌症之间的克隆大小分布(右)。分析了前 150 个 BCR 克隆型。中心线表示线性拟合,阴影区域表示通过 1000 次自助法得到的 95%置信区间。 (C) 盒形图显示血液、邻近正常、淋巴结转移和癌症中 PB 和 MZB1+rASC 的频率。 (D) 盒形图显示不同癌症类型中肿瘤内 PB(左)和 MZB1+PC(右)的频率。 (E) 盒形图比较两个浆细胞亚群与其余亚群的转录细胞纯度,通过 ROGUE 指数测量。每个点代表一个样本。 (F) UMAP 视图显示四个主要组织群中浆细胞亚群(顶部)和细胞密度(底部)。对四个组织群进行了降采样。高相对细胞密度显示为明亮的岩浆色。 (G) Monocle3 分析描绘了 B 细胞的发展轨迹(黑色骨架线)(左)。细胞根据 Monocle3 伪时间着色(右)。 (H) 三角热图显示四种组织类型中所有 B 细胞亚群间扩展的 BCR 克隆型的重叠。数据从每个组内的每个患者聚合。数字表示每对亚群共享的扩展 BCR 克隆型的标准化 Jaccard 指数。 (I) 条形图显示 PB 或 MZB1+rASC 与其他 B 细胞亚群之间的双向过渡指数(pTrans)。 (J) UpSet 图描绘 B 细胞与 ASCs 共享的扩展克隆数量。条形图显示浆细胞和指示的 B 细胞之间共享的克隆数量。每个 B 细胞亚群的总克隆数量由左侧的条形显示。 (K) 热图显示 ASC 与非 ASC 亚群之间的克隆型共享。行代表克隆型,列代表不同的组织类型。通过共享细胞数量着色。 (L) 共享克隆型的系统发育谱系树,包括 EF 途径中 ASC 细胞与 AtM 或其他 B 细胞之间的关系,包括 IFIT3+B、EGR1+ACB1 和 HSP+B(顶部),以及 ASC 细胞与 Bm 或 GCB 细胞在 GC 途径中的关系(底部)。体细胞突变的获得由分支上的数字表示,表示突变数量和分枝。假定的未突变的共同祖先由白圈显示。数据显示中位数及四分位范围,须表示最小和最大测量值(A, C, D 和 E)。 *P<0.05; P<0.01; *P<0.001; ****P<0.0001;ns 表示无显著性。 P 值通过双侧 Wilcoxon 检验(A, C, E)和双向 ANOVA(D)计算。
ASCs 是终末分化的 B 细胞,通过产生抗体执行效应功能(36)。与将 ASCs 归类为同质亚群的现有数据相比(14, 28, 37, 38),我们的高分辨率图谱显示,肿瘤浸润的 ASCs 在组织分布、癌症类型偏好、BCR 复合体和转录组特征上表现出多面性的多样性。首先,根据 Shannon 均等性指数(39),ASCs 的比例显示出很大的变化,其中肿瘤浸润的 ASCs 比邻近正常组织和血液中的 ASCs 显示出更高的多样性(P < 0.01),而非 ASCs 在淋巴结转移(LN_Mets)中的多样性最高(图 S3A)。其次,我们观察到 BCR 克隆型的多样性增加以及扩展 BCR 克隆型数量的增加。然而,在肿瘤中观察到较低的克隆频率,表明与其他组织相比,肿瘤中的克隆大小更为同质,其中少数扩展克隆主导了复合体(图 S3B)。第三,癌症类型对 ASCs 的频率产生了强烈的影响(图 S1D)。在两个 ASC 亚群中,肿瘤浸润的 MZB1+ 浆细胞的中位频率为 TIBs 的 12.52%,在结肠腺癌(COAD)中高达 70.18%,而在胆管癌(CHOL)和胃腺癌(STAD)中几乎无法检测到(1.85% 和 3.32%)[方差分析(ANOVA),P < 2e−16](图 S3,C 和 D)。肿瘤浸润的 TXNDC5+ 浆母细胞的中位频率为 0.13%,但在不同癌症类型中仍有变化(P = 1.1e−5)。最后,ROGUE 分析(40),用于量化识别的细胞类型的转录组纯度,进一步确认在 15 种 B 细胞亚群中,2 个 ASC 亚群展示了最高的基因表达异质性(图 S3E)。对 ASC 部分的亚群分析(移除 TXNDC5+ 浆母细胞)揭示了 10 个具有特定基因标记和组织分布的不同浆细胞亚群(图 2,A 和 B;图 S3F;表 S2)。其中,PC04.HSPA1A、PC05.NEAT1 和 PC08.IFI6 在肿瘤中占主导,PC09.RGS13 和 PC10.SPINK2 在邻近正常组织中积累,PC02.RGS13 在 LN_Mets 中普遍存在。同时,PC01.NME2 和 PC07.CD83 在 LN_Mets 和血液中富集相当,PC03.DUSP5 在 LN_Mets 和肿瘤中分布均匀,PC06.SLC3A2 在肿瘤和邻近正常组织中分布类似(图 2C)。这些发现有助于解释 PCs 在患者预后中的争议性角色(5, 41, 42),这可能归因于不同 PC 亚群和癌症类型的可变性。总体来说,这些数据表明癌症起源对 ASCs 的频率有重大影响,并暗示 ASCs 可能有不同的 B 细胞起源。
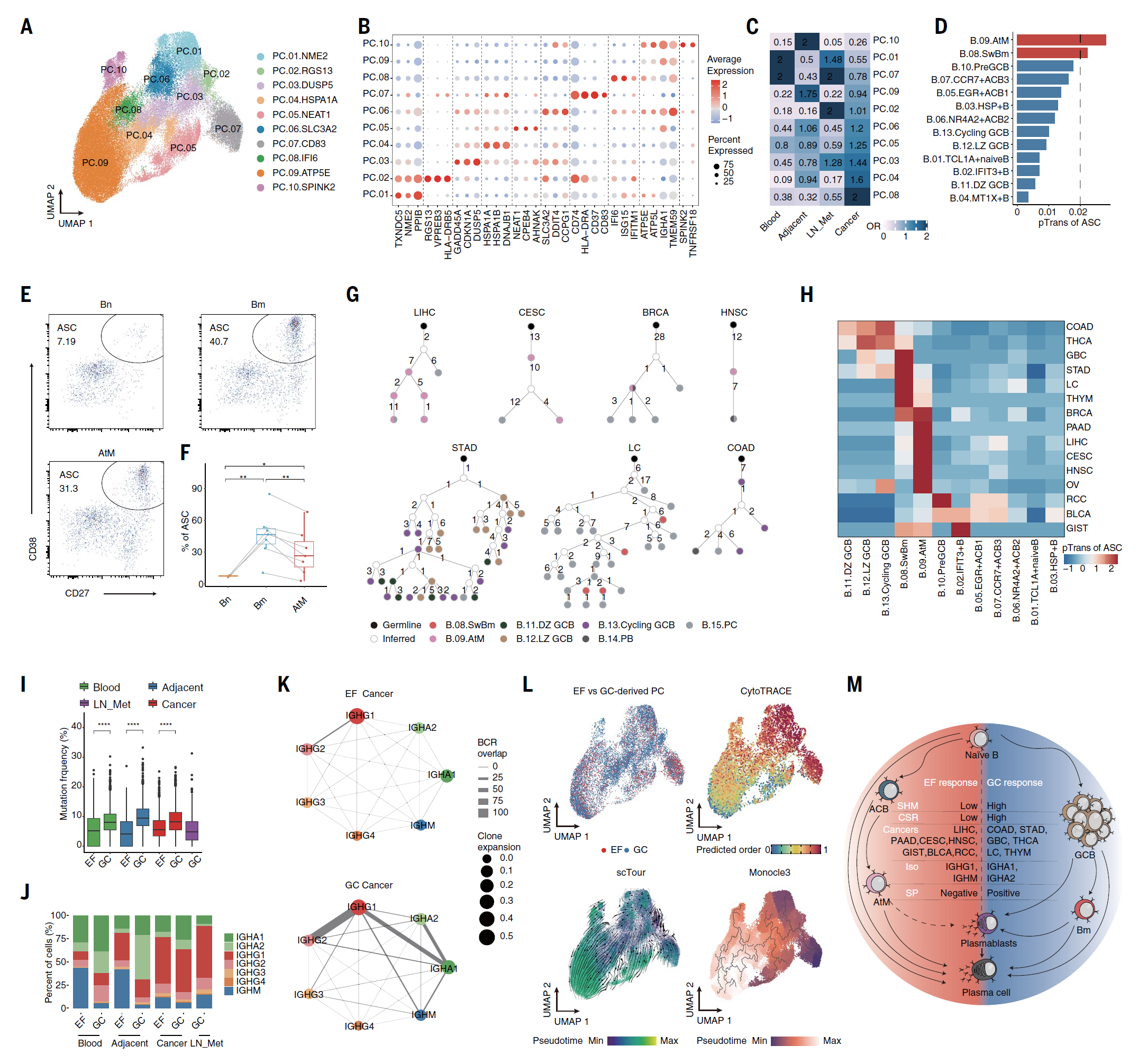
图 2. 人类癌症中浆细胞的两种发展路径。 (A) 10 种浆细胞亚群的 UMAP 可视化。 (B) 已识别浆细胞亚群的标志基因的点图。颜色代表表达标志基因的细胞的最大归一化平均表达量,大小代表表达这些基因的细胞百分比。 (C) 热图显示各组织中浆细胞亚群分布的比率(ORs)。OR 值表示在相应组织中的偏好分布。 (D) 配对转换指数(pTrans)显示非 ASCs 与 ASCs 之间的 BCR 重叠。高度连接到 ASCs 的前两个亚群被突出显示。 (E 和 F) 通过 FACS 分离肝细胞癌(LIHC)患者肿瘤浸润的初级(Bn)、记忆(Bm)和非典型记忆(AtM)B 细胞,并在体外用 R848、IL-2、IL-10 和 IL-21 刺激 11 天(捐赠者数量=3 至 7)。代表性流式细胞图(E)和通过 FACS 检测的 CD19+ B 细胞中 ASCs 的频率(F)。数据显示中位数及四分位数范围,须线表示最小和最大测量值。 (G)(顶部)ASC 细胞与 AtM B 细胞之间共享的克隆型的系统发育谱系树,(底部)ASCs 与 Bm 或 GC B 细胞之间的。树枝上的数字表示突变数和分支数,假设的未突变的共同祖先由白色圆圈表示。 (H) 热图显示 ASCs 与其他 B 细胞亚群之间的 pTrans 值,按不同癌症类型分类。颜色代表按行缩放的 z 分数 pTrans 值。 (I) 箱形图显示不同组织中 EF 和 GC 来源 ASCs 的体细胞超突变(SHM)频率。数据显示中位数及四分位数范围,须线表示最小和最大测量值。 (J) 堆叠柱状图显示不同组织中 EF 和 GC 来源 ASCs 的 IGH 同位型频率。 (K) 癌症中 EF 来源(上)和 GC 来源(下)ASCs 的类转换重组(CSR)频率。线条粗细表示两种 Ig 同位型之间共享克隆型的数量,点的大小表示每种同位型的克隆扩展。 (L) UMAP 图显示识别 EF 和 GC 来源 ASCs(左上角)、通过 CytoTRACE 确定发展顺序(右上角)、通过 scTour 推断的分化状态(左下角)、以及通过 Monocle3 推断的分化状态(右下角)。 (M) 草图显示 EF 与 GC 反应的分化路径。中间表格总结了 TME 中 EF 和 GC 的特征。 对于 (F) 和 (I), *P < 0.05, **P < 0.01, ****P < 0.0001。P 值由双侧 Wilcoxon 检验确定。
肿瘤劫持了生发中心和外滤泡路径¶
尽管生发中心(GC)和外滤泡(EF)反应源自 B 细胞的途径在自身免疫疾病和慢性感染中常见(21, 43, 44),但肿瘤生态系统影响不同 B 细胞进化轨迹的潜力尚未得到充分探索。因此,我们利用基因表达推断 ASCs 分化的轨迹,并观察到 ASCs 主要源自 GC B 细胞(图 S3G),这与以前的研究一致(2, 45)。然而,鉴于通过无监督聚类基于 PC 标记基因的高表达显著区分 ASC 亚群与其他亚群,传统的基于转录组的轨迹分析可能无法准确反映真实的分化状态。为了解决这个问题,我们使用 BCR 克隆共享策略和无监督聚类,通过 STARTRAC [通过 RNA 测序和 T 细胞受体(TCR)跟踪的单 T 细胞分析] 配对转换指数(pTrans)、Jaccard 指数(35)和体细胞超突变(SHM)鉴定 ASCs 的祖先,因为 BCR 复合体是追踪 ASCs 谱系的可靠分子标签。我们发现 AtM 和 Bm 细胞是与 ASCs 有克隆共享的两种主要 B 细胞,表明 ASCs 可能源自肿瘤微环境中的典型 GC 和替代 EF 途径(图 2D 和图 S3,H 和 I)。为了验证这一点,从肝细胞癌(LIHC)患者中分选出肿瘤浸润的初级 B、Bm 和 AtM B 细胞,并使用体外 B 细胞分化方法进行刺激。事实上,AtM B 细胞比初级 B 细胞(P = 0.035)更有效地分化为 ASCs,但比 Bm 细胞(P = 0.0027)分化能力弱(图 2,E 和 F)。除了 AtM 和 Bm 细胞外,我们还识别了与浆母细胞共享 BCR 的前 GC、循环 GC 和 GCLZ B 细胞,以及与浆细胞共享 BCR 的 IFIT3+ B、HSP+ B 和 EGR1+ACBs,这些通过共享克隆的系统发育谱系树得到验证(图 2G 和图 S3,J 到 L)。
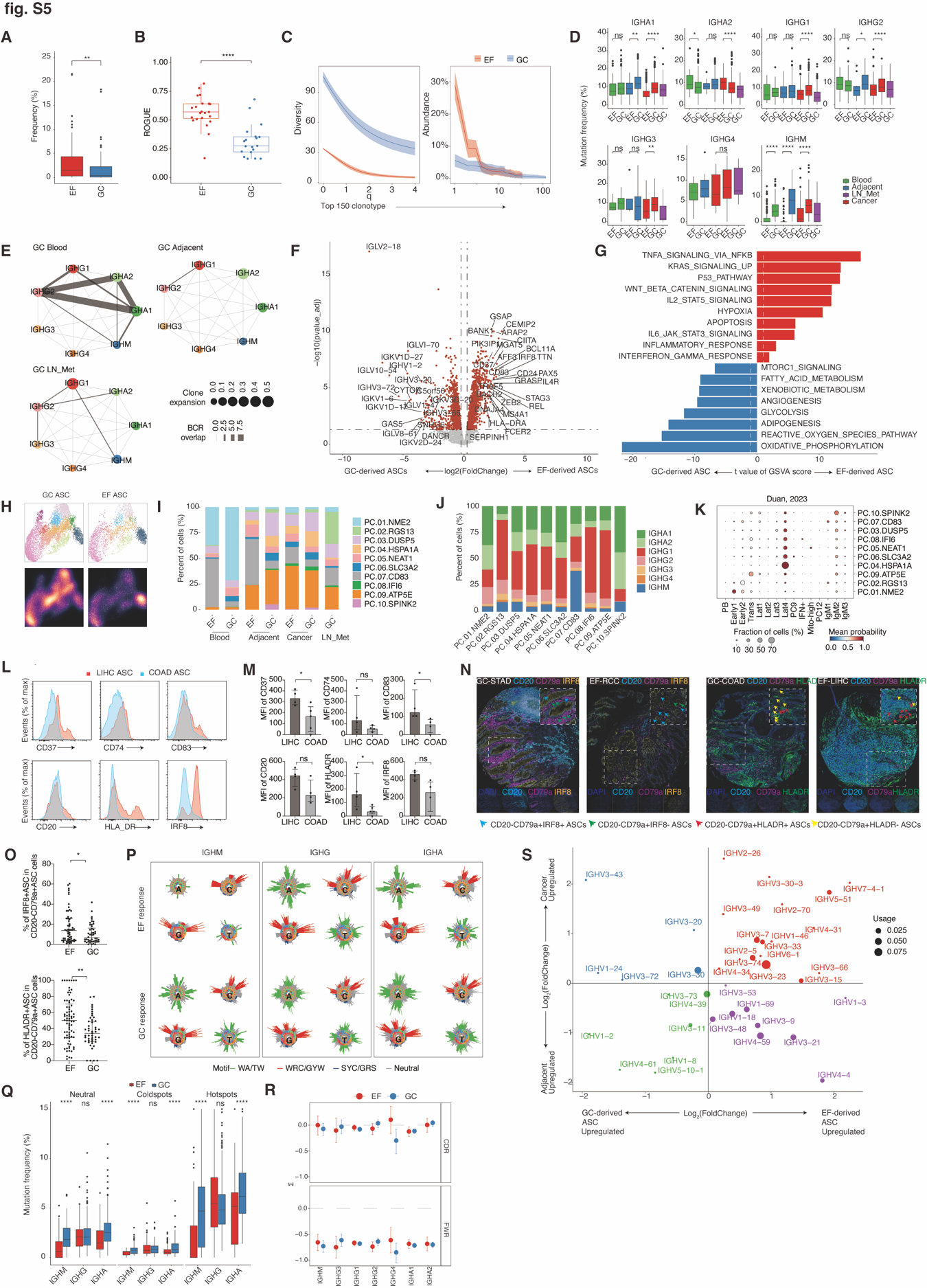
图 S5. EF 来源和 GC 来源的 ASCs 在转录和 BCR 特征上的差异。 (A) 盒形图显示肿瘤浸润的 EF 来源和 GC 来源的 ASCs 的频率。 (B) 盒形图显示通过 ROGUE 指数测量的 EF 来源和 GC 来源 ASCs 的纯度。每个点代表一个样本。 (C) BCR 克隆型多样性(左)(q=0,q=1 和 q=2,相当于物种丰富度、香农熵和辛普森指数)和 EF 来源和 GC 来源 ASCs 的克隆大小分布(右)。显示前 150 个 BCR 克隆型。中心线表示线性拟合,阴影区域表示通过 1000 次自助法得到的 95%置信区间。 (D) 盒形图显示不同组织中 EF 来源和 GC 来源 ASCs 的同种型频率。 (E) 血液、邻近正常组织和 LN_mets 中 GC 来源 ASCs 的类换位重组频率。EF 来源的 ASCs 在这些组织中缺乏 CSR。线的厚度表示两种 Ig 同种型之间共享的克隆型数量,点的大小代表每种同种型的克隆扩张。 (F) 火山图显示 EF 和 GC 来源的 ASCs 之间差异表达的基因。每个红点表示一个单独的基因,其调整后的 P 值<0.05 且|log2(倍数变化)|>0.25,双侧 t 检验。 (G) GSVA 分析显示 EF 来源和 GC 来源的 ASCs 之间富集的差异通路。使用双侧未配对 limma-moderated t 检验。 (H) UMAP 视图显示 EF 和 GC 途径之间的浆细胞亚群(顶部)和细胞密度(底部)。高相对细胞密度显示为明亮的岩浆色。 (I) 条形图显示 EF 和 GC 主导癌症中不同组织的 PC 亚群频率。 (J) 堆积柱形图显示 10 个浆细胞亚群中 IGH 同种型的频率。 (K) 我们研究中的浆细胞亚群和注释(行)与骨髓浆细胞的注释(列)(48)进行比较。比较是根据使用我们的数据作为参考的 CellTypist(135)训练的逻辑回归模型进行的。颜色标尺代表预测特定细胞类型的平均概率,点的大小代表被预测为特定细胞类型的细胞百分比。 (L 和 M) 代表性直方图(L)和 MFI(M)显示 LIHC(n=4)和 COAD(n=4)浸润的 ASC 中 EF 来源 ASCs 特异性基因,包括 CD37、CD74、CD83、CD20、HLADR 和 IRF8,通过 FACS 检测。 (N) 代表性多重免疫组化(IHC)染色显示 IRF8+ASCs 和 HLADR+ASCs 在 EF(RCC 和 LIHC)和 GC 主导(STAD 和 COAD)癌症组织中。青色、绿色、红色和黄色箭头分别代表 IRF8+ASCs、IRF8-ASCs、HLADR+ASCs 和 HLADR-ASCs。 (O) 多重 IHC 揭示的 EF(n=49)和 GC 主导(n=23)癌症中 CD20-CD79a+ASCs 中 IRF8+ASCs 和 HLADR+ASCs 的频率。 (P) EF 和 GC 来源 ASCs 之间 BCR SHM 靶向模型。两行顶部的“刺猬”图表展示了 EF 来源 ASCs 的靶向热点和冷点序列基序,底部两行展示了 GC 来源 ASCs 的。WRC/GYW(红色)、SYC/GRS(蓝色)、WA/TW(绿色)和中性(灰色)突变的频率可视化。WRC/GYW 和 WA/TW 是突变热点,SYC/GRS 是突变冷点。图表中央的 ATCG 核苷酸代表特定的突变碱基。图上棒的长度对应于给定 5-mer 中给定碱基被突变的可能性。 (Q) 盒形图显示不同 SHM 包括中性、热点和冷点突变频率,来自 EF 和 GC 来源 ASCs 的不同同种型。 (R) BASELINE 选择分析在 EF 和 GC 来源 ASCs 中 CDR 和 FWR 选择,按同种型分组。条形表示组中的 95%置信区间。 (S) EF 与 GC 来源 ASCs 和癌症与邻近正常组织浸润 ASCs 之间的 IGHV 家族使用偏好推断。使用 log2(倍数变化)值绘制图表,每个点按 IGHV 使用量大小和颜色编码表示组特异性。红色、蓝色、绿色和紫色分别代表癌症浸润的 EF 来源 ASCs、癌症浸润的 GC 来源 ASCs、邻近浸润的 GC 来源 ASCs 和邻近浸润的 EF 来源 ASCs 富含 IGHV 基因。数据显示中位数及四分位范围(M 和 O),须表示最小和最大测量值(A、B 和 D)。*P<0.05;P<0.01;*P<0.001;****P<0.0001;ns 表示无显著性。
我们接下来评估了两种路径的普遍性,并将与典型 Bm(GC 来源 ASCs 的 66%)、循环 GC(13%)、GCLZ(12%)和 GCDZ(7%)共享 BCR 的 ASCs 分类为 GC 来源的 ASCs,而那些与其他 B 细胞亚群重叠的 ASCs,包括 AtM(EF 来源 ASCs 的 47%)、ACB(29%)、IFIT3+ B(8%)、HSP+ B(6%)、前 GC(5%)和 MT1X+ B(3%)细胞,被归类为细胞层面的 EF 来源 ASCs(图 S4A)。随后,我们使用标签转移获得更多基于已分类 ASCs 的基因表达轮廓的 EF 和 GC 来源 ASCs,然后验证了标签转移的准确性(图 S4B)。有了定义的 EF 来源和 GC 来源的 ASCs,我们进一步计算了 EF 指数,并结合 SHM 将患者分类为 EF 占主导或 GC 占主导的两个不同组,此分类进一步通过 pTrans 得分得到验证和精细化(图 S4,C 至 E)。尽管存在明显的患者和癌症类型偏好,但两条路径都可以在单个患者和癌症中观察到,表明 GC 和 EF 反应是 ASC 分化的普遍路径(图 2H)。结肠腺癌(COAD)和甲状腺癌(THCA)使用 GCDZ、GCLZ 和循环 GC B 细胞,而胆囊癌(GBC)、胃腺癌(STAD)、肺癌(LC)和胸腺瘤(THYM)倾向于使用 Bm 细胞作为 GC 途径。相反,AtM B 细胞占主导的 EF 路径在肝细胞癌(LIHC)、胰腺腺癌(PAAD)、宫颈鳞状细胞癌及宫颈腺癌(CESC)和头颈部鳞状细胞癌(HNSC)中富集,而前 GC、ACB 和 IFIT3+ 占主导的 EF 路径在肾细胞癌(RCC)、膀胱尿路上皮癌(BLCA)和胃肠道间质瘤(GIST)中丰富(图 2H 和图 S4F)。在卵巢癌(OV)和乳腺癌(BRCA)中,AtM B 细胞的 pTrans 得分与循环 GC 和 Bm 细胞相当,表明这些癌症中两条路径的同等存在(图 S4G)。除了亚群之间的 BCR 共享外,GC 和 EF 途径的发育潜力也可以通过非 ASC 亚群在 ASCs 中的表达特征得到验证(图 S4H)。例如,PC01.NME2 表达前 GC 特征基因,包括 PSME2 和 ENO1,并且这些前 GC B 细胞在 BLCA 和 RCC 中与 TXNDC5+ 浆母细胞和 MZB1+ 浆细胞共享 BCR。类似地,PC04.HSPA1A 表达 HSPA1A 和 HSPA1B,HSP+ B 细胞倾向于与 BLCA 中的 MZB1+ 浆细胞共享 BCR,表明通向 ASCs 的异质分化路径。总体来说,这些数据表明,两种进化路径(GC 和 EF)被不同的癌症生态系统劫持。
我们进一步探讨了这两种进化路径的 BCR 复合体和匹配的转录特征。EF 来源 ASCs 在肿瘤中的中位频率为 1.52%(四分位数范围 0.35 至 4.37%),显著高于 GC 来源 ASCs 的 0.45%(四分位数范围 0.13 至 2.29%)(图 S5A)。相比之下,EF 来源 ASCs 的基因表达和 BCR 克隆型多样性降低(图 S5,B 和 C)。这些细胞特征为寡克隆扩展,前五个克隆型占总复合体的 11.51%,而 GC 来源 ASCs 为 3.20%。实际上,GC 来源 ASCs 表现出高多样性和相对均匀的克隆大小(图 S5C)。与先前在自身免疫疾病中的发现一致(43, 46),肿瘤中的 EF 来源 ASCs 的体细胞超突变(SHM)显著低于 GC 来源的 ASCs(图 2I 和图 S5D)。同位型分析表明,EF 来源 ASCs 含有高干扰素诱导的免疫球蛋白 G(IgG)同位型和相对于 IGHG1 的类转换重组(CSR),在肿瘤中以及高 IGHM 富集,而在邻近正常组织和血液中没有发生 CSR(图 2J)。相比之下,GC 来源 ASCs 在肿瘤、邻近正常组织和血液中显示出显著更高的扩展和 CSR 相对于 IGHA1 和 IGHA2,这与肿瘤抗原特异性识别和抗肿瘤免疫相关(47)(图 2K 和图 S5E)。
这些差异可能源于 EF 和 GC 来源 ASCs 之间的内在区别,EF 来源 ASCs 高表达 IRF8、CD83 和 HLA-DR,表现出较早的免疫反应表型(48)并富集在缺氧和炎症反应途径中。相反,GC 来源 ASCs 表现出更高的免疫球蛋白基因表达,并表现出更成熟的浆细胞表型——这与它们在免疫反应后期阶段出现一致——并富集在多个代谢途径中,包括糖酵解、氧化磷酸化和脂肪酸代谢,突出显示了 CSR 和 GC 反应期间广泛的能量和生物合成需求(图 S5,F 和 G,以及表 S2)。为了比较 EF 和 GC 来源 ASCs 的早期和晚期分化阶段,我们使用了三种方法推断分化状态,包括 cytoTRACE(49)、scTour(50)和 Monocle3(51),并显示 EF 来源 ASCs 处于早期阶段,与 GC 来源 ASCs 的末端分化相比,表明 EF 反应早期和 GC 反应延迟(52)(图 2L 和图 S5H)。这些结果进一步得到验证,因为 EF 来源 ASCs 富集了 PC07.CD83,高表达 HLA-DR 和 FOXP1,已显示抑制生发中心(GC)形成和抑制人类浆细胞分化(53, 54)(图 S5I)。此外,PC07.CD83 中 IGHM 同位型的富集进一步与骨髓中早期免疫球蛋白 M(IgM)ASCs 的特征一致(48)(图 S5,J 和 K)。
GC 来源 ASCs 富集了 PC03.DUSP5、PC04.HSPA1A 和 PC10.SPINK2。LIHC 浸润 ASCs 显著高表达 EF 来源 ASC 标记物,如 CD20、HLA-DR、CD37、CD74、CD83 和 IRF8,与 COAD 中的表达相比(图 S5,L 和 M)。这些结果还通过使用组织微阵列(TMA)对 IRF8 和 HLA-DR 进行 mIHC 染色进行了验证,该微阵列包括 EF 占主导的癌症(BLCA, CESC, GIST, LIHC, PAAD, RCC; n = 49)和 GC 占主导的癌症(COAD, STAD, 和 LC; n = 23)(图 S5N)。EF 占主导癌症中 IRF8+ ASCs 的频率(中位数在 EF = 13.67%,中位数在 GC = 6.58%;P=0.0315)和 HLA-DR+ ASCs 的频率(中位数在 EF = 50%,中位数在 GC = 34.09%;P = 0.0066)在 CD79+CD20− ASCs 中显著高于 GC 占主导癌症(图 S5O)。总的来说,这些结果进一步支持了 EF 来源 ASCs 的早期反应与 GC 来源 ASCs 的延迟反应的观念。
GC 来源的 ASCs 在激活诱导的胞苷脱氨酶(AID)WRC/GYW 和 WA/TW 热点区域的突变频率高于 EF 来源的 ASCs(图 S5,P 和 Q)。具体来说,GC 来源 ASCs 在 AID 热点区域的突变频率为 IGHA 的 6.05%(4.37 至 8.44%)和 IGHM 的 4.61%(1.05 至 7.07%)。这些频率显著高于 EF 来源的 ASCs,后者为 IGHA 的 4.65%(2.63 至 6.95%)(P = 2.5e−12)和 IGHM 的 0%(0 至 2.93%)(P < 2.2e−16)。GC 来源的 ASCs 显示出对 IGHA2 和 IGHG2 的互补性决定区(CDR)中替换突变的正选择,进一步支持它们增加的类转换重组(CSR)(图 S5R)。相比之下,与 GC 来源的 ASCs 相比,EF 来源的 ASCs 中 IGHG4 增加,这与最近一份报告一致,该报告显示 IgG4 相关的自身免疫病中 EF 反应增强(57)。同样,比较肿瘤中 EF 和 GC 来源 ASCs 的 IGHV 基因使用情况显示,GC 来源的 ASCs 过度表达 IGHV1-8 和 IGHV1-24(图 S5S),其中 IGHV1-8 的偏好与更高的 SHM 率相关(58),表明它们具有强烈的抗原特异性亲和力。EF 来源的 ASCs 上调了一组 IGHV 基因(IGHV3-15、IGHV3-23、IGHV3-33、IGHV3-49、IGHV4-34 和 IGHV4-59),这些基因的增加使用已与 COVID-19、病毒感染和自身免疫病相关(43, 46, 59, 60),暗示一个多反应性 BCR 复合体。总的来说,我们的数据表明,不同的癌症生态系统劫持了两条进化路径(EF 和 GC),揭示了 EF 和 GC 来源 ASCs 之间在 BCR 复合体和转录特征上的差异,突出显示它们在抗肿瘤反应中的独特作用(图 2M)。
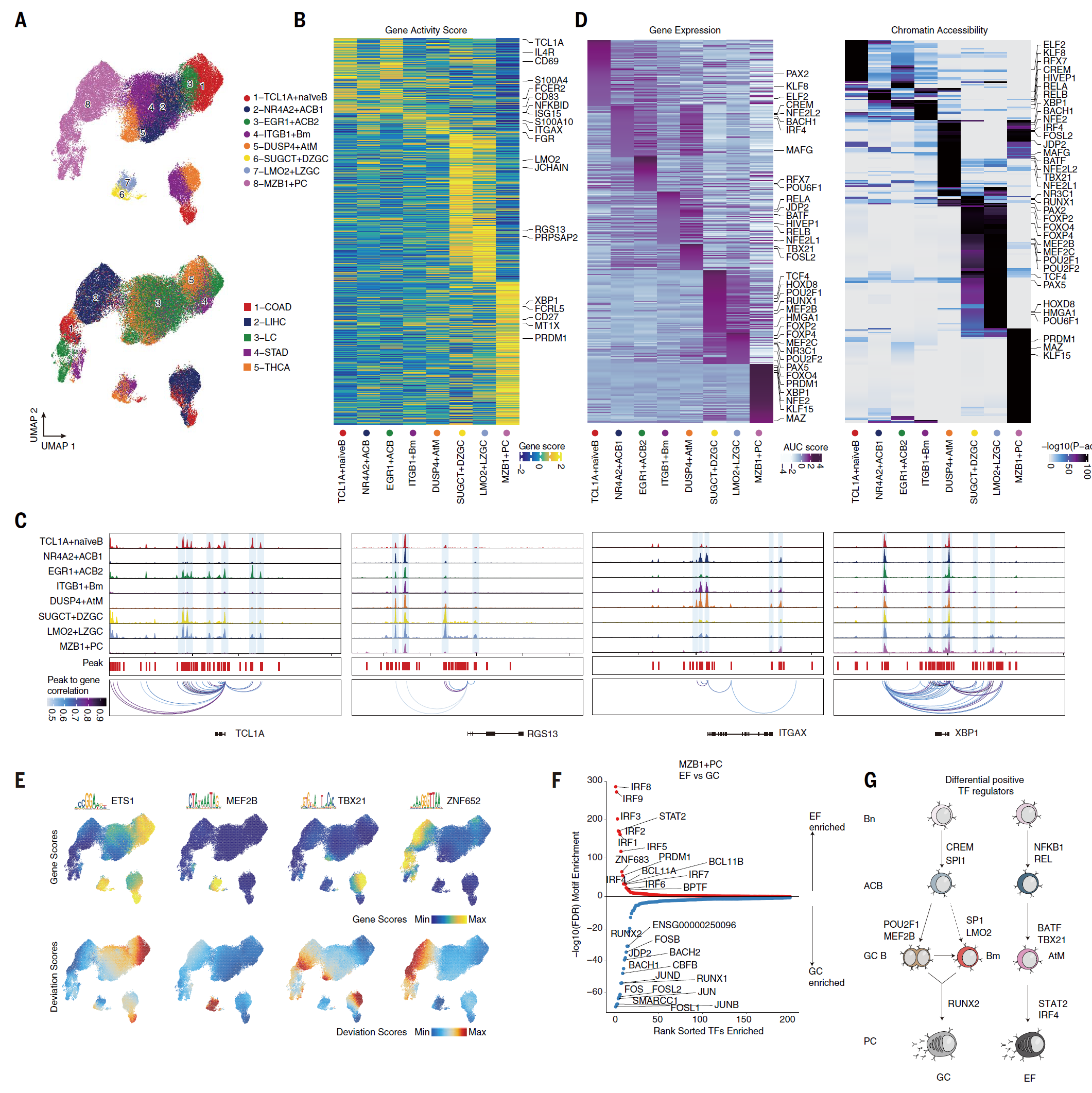
图 3. 人类癌症中 EF 和 GC 反应的单细胞表观基因组特征。 (A) scATAC-seq 标注的 B 细胞亚群(顶部)和癌症类型(底部)的 UMAP 可视化。 (B) 基于 scATAC-seq 的所有亚群标记基因的基因活性评分热图。颜色代表 z 分数缩放的基因表达。 (C) 在 B 细胞亚群中指示的特征基因位点的基因组可访问性轨迹。 (D) SCENIC 分析的 TF 活性热图(左侧)和在标注的 B 细胞亚群的特定开放染色质区域的 TF 基序富集(右侧)。 (E) RNA 表达(顶部)和 B 细胞亚群特定 TF 的基序偏差评分(底部)的 UMAP 可视化。 (F) EF 主导和 GC 主导癌症来源的 MZB1+ 浆细胞之间的差异表达 TF 偏差评分计算 [对数 2 倍变化 (FC)>0.5,Benjamini-Hochberg 调整后 P 值<0.05,双侧 Wilcoxon 检验]。TF 偏差评分按调整后 P 值排名,(红色) EF 主导相对于 (蓝色) GC 主导癌症来源的 MZB1+ 浆细胞。 (G) 不同假定调节 TF 驱动 B 细胞分化从初级 B 细胞到浆细胞的示意图,左侧为 GC 主导癌症,右侧为 EF 主导癌症。
调控元件通过表观遗传学授权外滤泡和生发中心的平衡¶
转录调控是决定和维持 B 细胞身份的基础(61-64),但肿瘤特异性的调控网络和对 TIBs 身份有贡献的分子驱动因素尚未明确定义。为了解决这一挑战,我们应用了配对的单细胞 RNA 测序(scRNA-seq)和单细胞转座酶可访问染色质测序(scATAC-seq),来表征 TIBs 的表观基因组,并为来自五种癌症类型的九名患者的 53,428 个 TIBs 获得了染色质可访问性图谱,包括 GC 途径主导的癌症(COAD、THCA、LC 和 STAD)和 EF 途径主导的癌症(LIHC),中位数为 11,853 个独特对齐片段,约 67.87% 的 Tn5 插入位于 ATAC-seq 峰中(图 3A 和图 S6, A 至 C)。通过整合 scATAC-seq 和 scRNA-seq 数据,我们观察到八个类似的 B 细胞亚群,涵盖初级、两个 ACB、Bm、AtM、GC(DZ 和 LZ)和 PC 亚群(图 3A 和表 S3)。因此,亚群身份和亚群特异性标记在 scRNA-seq 和 scATAC-seq 中都有强烈一致性(图 3B 和图 S6D)。开放染色质可访问性确认了 B 细胞亚群的特征基因,如 TCL1A、RGS13、ITGAX 和 XBP1,进一步确认了它们的细胞身份(图 3C 和图 S6E)。
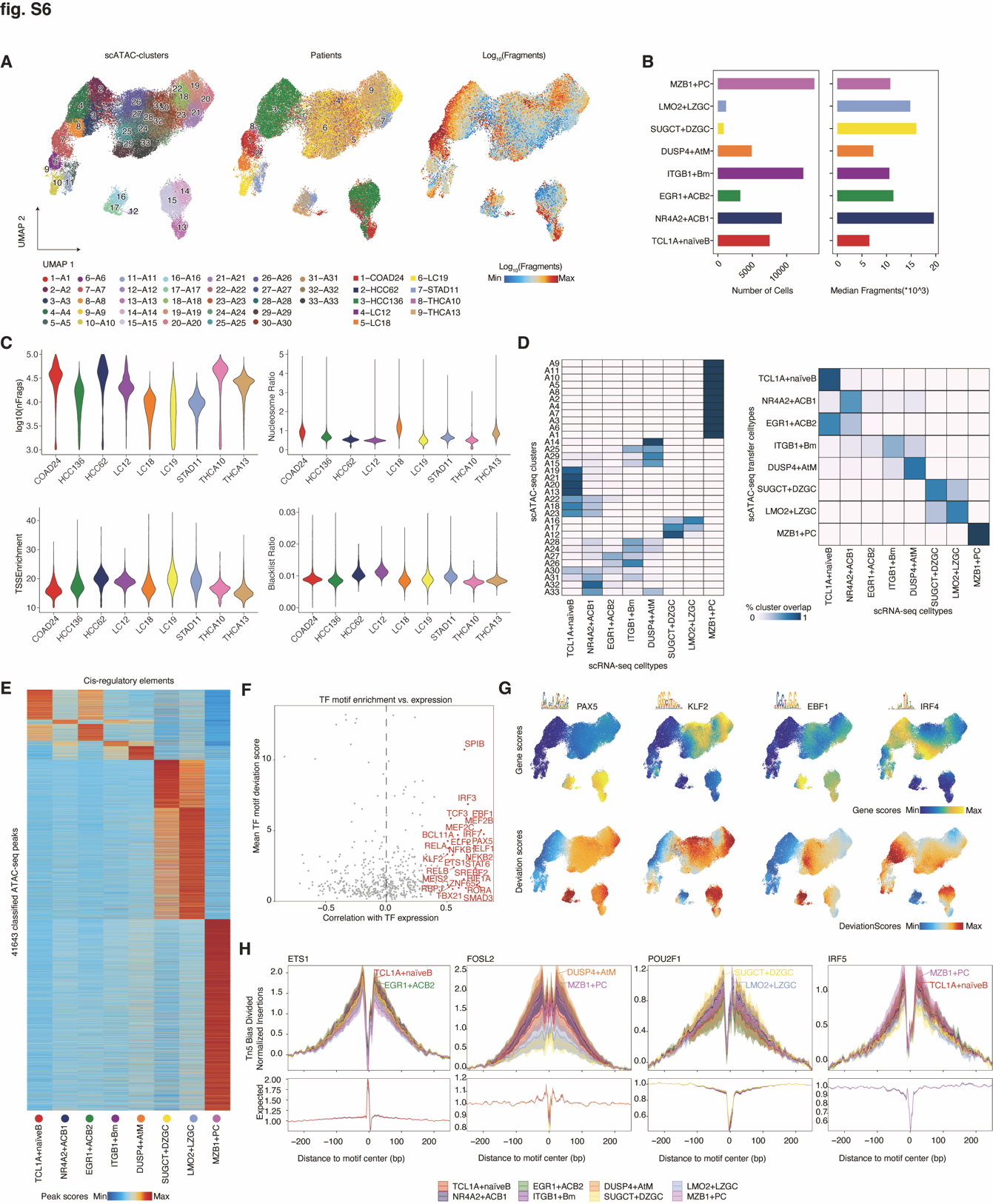
图 S6. 单细胞 ATAC 测序(scATAC-seq)数据质量控制与整合。 (A) UMAP 图显示无监督 scATAC-seq 聚类(左侧)、患者(中间)和每个单细胞独特核片段数量的对数(log10)(右侧)。 (B) 条形图显示 scATAC-seq B 细胞亚群的数量(左侧)和独特核片段的中位数(右侧)。 (C) 按患者的 scATAC-seq 数据集的质量控制指标,包括每个细胞条形码的片段数量、转录起始位点富集评分、核小体与非核小体片段大小的比率,以及基因组黑名单区域中片段的比率。 (D) 热图揭示无监督 scATAC-seq 聚类(左侧)或转移 scATAC-seq 亚群身份(右侧)与 scRNA-seq 细胞类型的重叠。颜色代表 scRNA-seq 聚类或亚群与 scRNA-seq 亚群之间的重叠率。 (E) scATAC-seq B 细胞亚群中 41,643 个顺式调控元件的热图。颜色代表按行缩放的峰值评分的 z 分数。 (F) 转录因子(TF)表达评分(x 轴)与平均 TF 基序偏差评分(y 轴)的相关性,用于预测 B 细胞亚群中的正向 TF 调节因子。相关性大于 0.5 的以红色表示。 (G) 选定的 B 细胞谱系 TF 的 RNA 表达(顶部)和基序偏差评分(底部)。 (H) 在不同 B 细胞亚群中对选定的特定细胞类型 TF 进行足迹分析。
为了定义参与修改不同 B 细胞亚群染色质可访问性的转录因子(TFs),我们识别了染色质可访问活性与其基因表达显著正相关的 TFs。这种分析产生了一整套富集的 TFs,包括已知的 B 细胞系 TFs,如 PAX5、EBF1 和 SPIB(65)(图 S6, F 和 G)。通过结合 TFs 的足迹和特征(66),我们识别出 B 细胞亚群间共享和独特的调控模式(图 3D)。例如,类似细胞状态之间的共享模式的调节 TF 活动,如初级、ACB 和 Bm 中活跃的 BCL11A、ELF2、SPIB 和 STAT6,或在 GCDZ 和 GCLZ B 细胞中的 CTCFL、EBF1、HMGA1 和 POU2F1(图 3D)。相反,广泛的 TFs 在特定 B 细胞亚群中特别富集(例如,ETS1 在初级 B 细胞中;TBX21 和 FOSL2 在 AtM 中;POU2F1、MEF2B 和 BCL6 在 GC B 细胞中;IRF2/3/4/5/6/7/8、PRDM1 和 ZNF652 在 PCs 中)(图 3, D 和 E, 和图 S6H)。总体而言,我们的数据不仅无偏见地揭示了已知和未知的 TFs 在控制 B 细胞身份中的作用,还提供了跨癌症中主要 B 细胞亚群基因调控网络的全面资源。
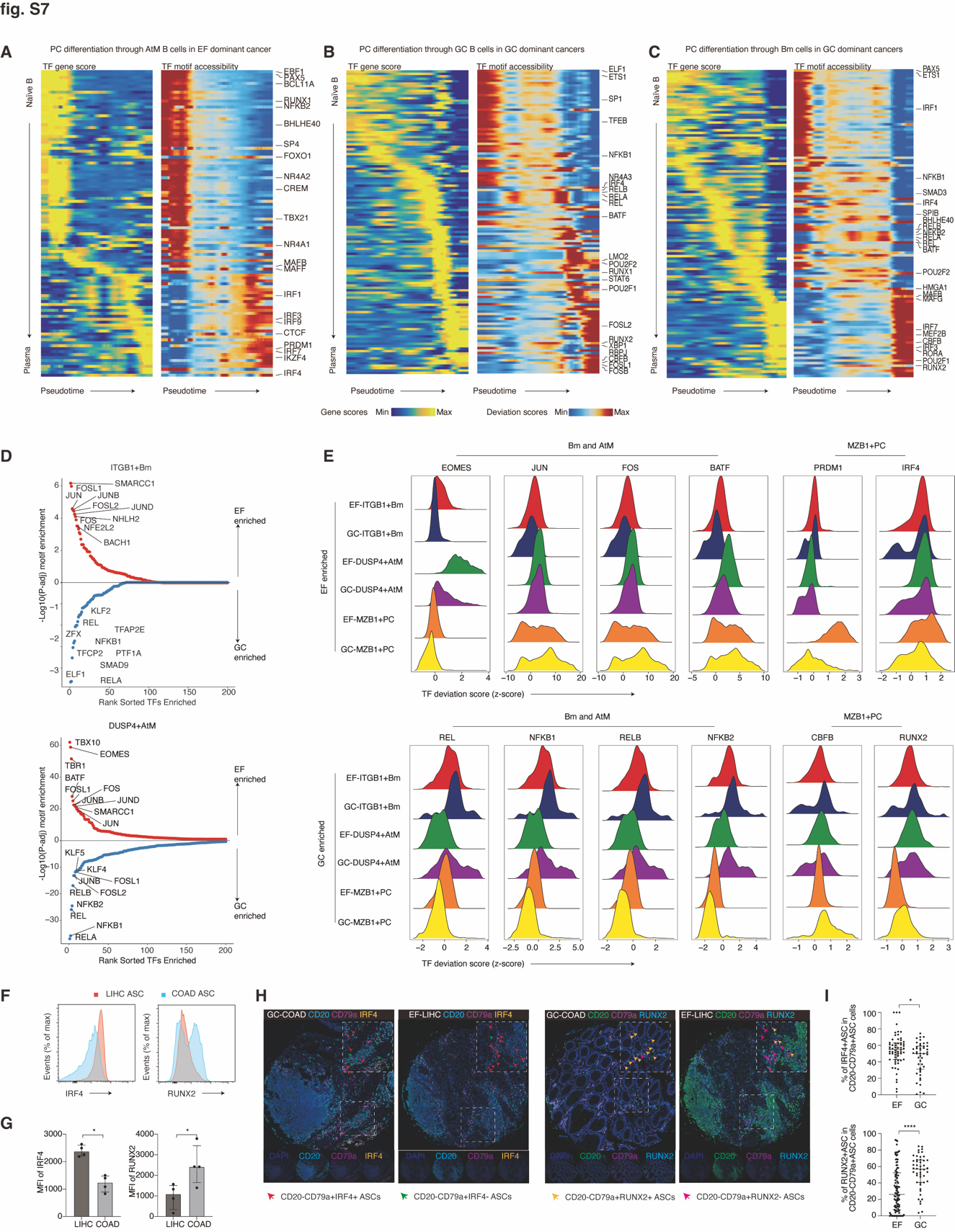
图 S7. EF 和 GC 源浆细胞谱系轨迹。(A-C) 幼稚 B 细胞通过 AtM (A)、GC B (B) 和 Bm 细胞 (C) 分化成浆细胞的伪时间热图排序,分别显示基因评分 (左) 和转录因子 motif 可及性 (右)。(D) 计算了 EF 和 GC 来源的癌症衍生 Bm 和 AtM B 细胞之间差异表达的转录因子 (log2 FC > 0.5,Benjamini-Hochberg 校正的 P 值 < 0.05,双侧 Wilcoxon 秩和检验)。EF 来源的癌症 (红色) 和 GC 来源的癌症 (蓝色) 衍生的 Bm (顶部) 和 AtM B 细胞 (底部) 中按 P 值调整的富集排名。(E) 山脊图显示了 EF 和 GC 来源的癌症中不同 B 细胞亚群中指示的阳性转录因子调节因子的偏差评分。(F 和 G) 代表性 FACS 检测的 LIHC (n = 4) 和 COAD (n = 4) 浸润性 ASCs 中 IRF4 和 RUNX2 的柱状图 (F) 和 MFI (G)。数据显示 IQR 的中位数 (G)。(H) IRF4+ ASCs 和 RUNX2+ ASCs 在 EF (LIHC) 和 GC 来源 (COAD) 癌组织中的 CD20、CD79a、IRF4 和 RUNX2 的代表性多重 IHC 染色。红色、绿色、黄色和粉色分别代表 IRF4+ ASCs、IRF4- ASCs、RUNX2+ ASCs 和 RUNX2- ASCs。(I) 多重 IHC 显示的 EF (n = 49) 和 GC 来源 (n = 23) 癌症之间 CD20-CD79a+ ASCs 中 IRF4+ ASCs 和 RUNX2+ ASCs 的频率。数据显示 IQR 的中位数,P < 0.05;_***,P < 0.0001;P 值通过双侧 Wilcoxon 检验计算 (G 和 I)。
仔细检查 Bm、AtM 和 PCs 时,我们发现它们主要由特定 EF 和 GC 癌症类型的细胞组成,促使我们调查 Bm、AtM 和 PCs 的染色质景观中潜在的癌症实体特异性差异(图 3A)。因此,我们研究了来自 EF 和 GC 主导癌症的 B 细胞系谱系轨迹(图 S7, A 至 C)。我们识别了正向 TF 调节器的顺序活动,包括 PAX5、BCL11A、POU2F2、EBF1、REL、TBX21、PRDM1、IRF4、RORA、RUNX2 和 XBP1,它们促进 B 细胞系的特化、维持、CSR 和分化(62, 64, 65, 67)。这些活动在 EF 和 GC 主导癌症中沿着 B 细胞分化呈现变化。随后,我们评估了 TF 偏差分数以确定 EF 和 GC 主导癌症之间差异性正向 TF 调节器。EF 主导癌症中的 Bm 和 AtM 富含 AP-1 因子,包括 FOS 和 JUN,这些因子涉及 BCR 信号传导途径,并标志 B 细胞激活和分化(68)(图 S7, D 和 E)。相比之下,GC 主导癌症中的 Bm 和 AtM 富含核因子 κB(NF-κB)亚单位,包括 REL、RELA 和 RELB,这与它们在 GC B 细胞维持和稳态中的报道功能一致(69)。与 GC 主导癌症中的 PCs 显示高 RUNX1-3 偏差分数相比,EF 主导癌症中的 PCs 显示高活性的调节快速诱导干扰素 -β(IFN-β)和炎症性 TME 的 TFs,包括 IRF1/3/4/5/8 和 STAT2(70)(图 3F)。为了验证这一点,我们确认了 IRF4 和 RUNX2 在肿瘤浸润 ASCs 中比其他 B 细胞富集,并且 IRF4 在与 LIHC 相关的 ASCs 中比与 COAD 相关的 ASCs 表达上调,而 RUNX2 显示相反趋势(图 S7, F 和 G)。这些结果通过 mIHC 染色 IRF4 和 RUNX2 在 ASCs 的组织微阵列中得到证实,包括 EF 主导(n=49)和 GC 主导癌症(n=23)(图 S7H)。在 CD79a+CD20− ASCs 中,EF 主导癌症中 IRF4+ 的频率(中位数在 EF = 55.09%,中位数在 GC = 50%;P = 0.0416)显著高于 GC 主导癌症,而 RUNX2+ ASCs 的频率显示相反趋势(中位数在 EF = 26.11%,中位数在 GC = 56.89%;P < 0.0001)(图 S7I)。总的来说,这些数据突出了一个动态的表观遗传调控网络的功能,在癌症生态系统中精细调节 B 细胞的分化和选择,并强调了系谱 TFs 在管理 EF 和 GC 途径之间平衡的基本作用(图 3G)。
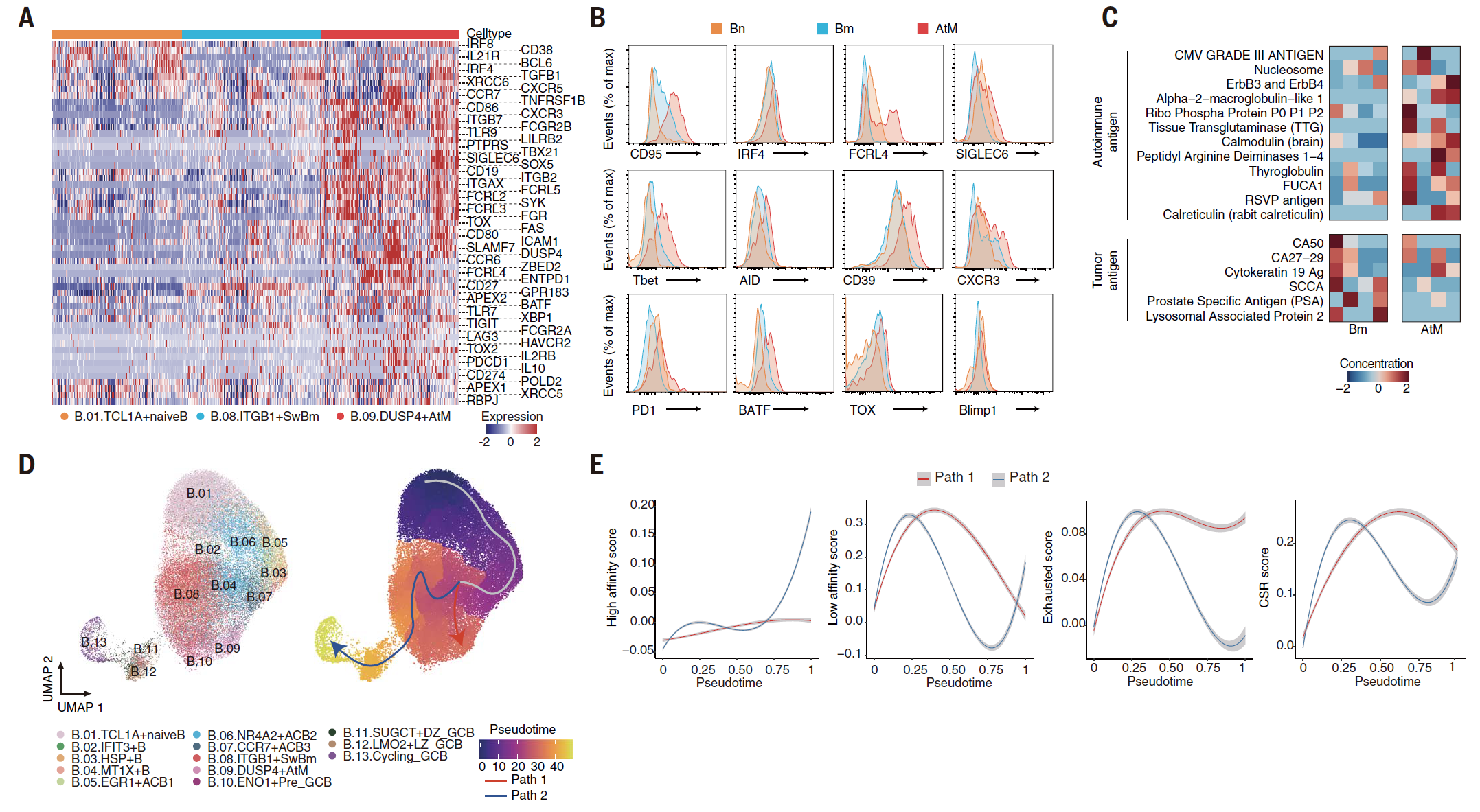
图 4. 人类癌症中 AtM B 细胞的 GC 独立发展。 (A) 热图显示初级、Bm 和 AtM B 细胞中代表性基因的相对表达。颜色标尺代表按行缩放的 z 分数基因表达值,每一列代表一个病人。 (B) 通过 FACS 检测的来自肝细胞癌(LIHC)患者的肿瘤浸润初级、Bm 和 AtM B 细胞的代表性标记物(n = 3)。 (C) 热图显示了在体外刺激 11 天后,来自 LIHC 患者的肿瘤浸润初级、Bm 和 AtM B 细胞的上清液中检测到的自身抗原和肿瘤相关抗原特异性 IgA(n = 4)。 (D) (左)Monocle3 轨迹分析描绘了非 ASC 的发展轨迹,显示(右)两条主要的发散轨迹(从灰色骨架线:红色,路径 1;蓝色,路径 2)。(右下)细胞按其对应的伪时间进行颜色编码。 (E) 二维图显示了沿着推断的伪时间,路径 1(红色)和路径 2(蓝色)的细胞中高亲和力、低亲和力、耗竭和 CSR 特征的动态表达得分。中心线表示线性拟合,阴影线表示 95% 置信区间。
外滤泡非典型记忆 B 细胞(AtM B 细胞)表现出耗竭表型,独立于生发中心发展¶
认识到作为肿瘤微环境(TME)中 EF 途径的主要祖先的 AtM B 细胞的关键作用,我们全面检查了它们的表型和功能。与非肿瘤环境中先前定义的标志性标记物相比(21, 22, 24),肿瘤浸润的 AtMB 细胞也显示出 CD27、CD38、IRF8 和 SDC1 的表达降低,与 Bm 细胞相比,PRDM1、IRF4 和 XBP1 的表达增加,Bm 细胞是 GC 来源 ASCs 的经典祖先(1)。已知 XBP1 抑制 B 细胞增殖并促进向 ASCs 的分化(71),支持 AtM 向 ASCs 分化的潜力(图 4A)。AtM B 细胞表现出耗竭和驻留记忆表型,不同于 Bm 的效应表型。简而言之,AtM B 细胞上调了免疫检查点(PDCD1、CD274、CTLA4、ENTPD1、LAG3 和 HAVCR2)、与耗竭相关的转录因子(TOX、TOX2、ZBED2、BATF、RBPJ 和 VDR)(33, 72),以及涉及免疫球蛋白和免疫复合物结合的 Fc 受体家族(FCRL2/3/4/5 和 CD32A/B)(图 4A)。其中,FCRL4 与可能抑制 BCR 信号的组织驻留记忆细胞相关。CD32B 作为低亲和力抑制性受体,抑制抗体依赖的细胞毒性(ADCC)、抗体依赖的细胞吞噬(ADCP)和 B 细胞激活(73)。与过度激活 TCR 信号的耗竭 T 细胞类似,AtM B 细胞也高表达 BCR 信号基因(SYK)、免疫调节和激活基因(TLR7/9、CD80、CD86 和 CD72)。这些独特的表型通过流式细胞术进一步得到证实(图 4B 和图 S8A)。这些数据综合展示了外滤泡 AtM B 细胞的独特免疫表型和分子特征。
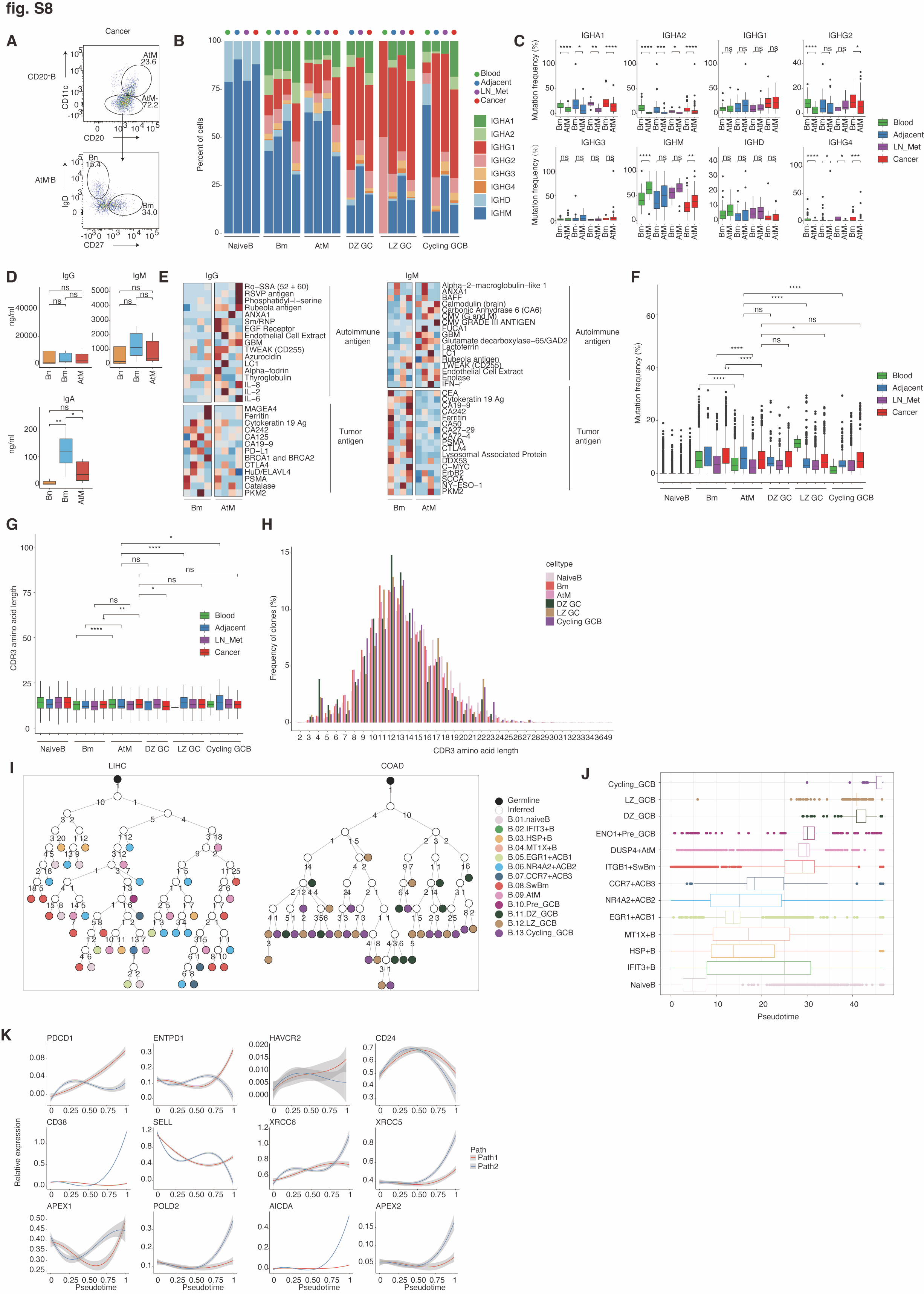
图 S8. AtM 细胞与 Bm 或 GC B 细胞之间的表型和 BCR 库的差异。(A) 代表性的流式图,显示来自 LIHC 患者 (n = 3) 的 CD20+ B 细胞中肿瘤浸润的幼稚 B 细胞、Bm 细胞和 AtM 细胞。(B) 堆叠条形图显示了来自不同组织的幼稚 B 细胞、Bm 细胞、AtM 细胞、GC_D 区、GC_L 区和循环 GC B 细胞的类型分布。(C) 箱型图显示了不同组织中 Bm 细胞和 AtM 细胞之间类型频率的差异。(D) 从 LIHC 患者中分离出肿瘤浸润的幼稚 B 细胞、Bm 细胞和 AtM 细胞,并用 R848、IL2、IL10 和 IL21 刺激 11 天。收集上清液,通过 ELISA 测定 IgG、IgA 和 IgM 的浓度 (n = 4)。(E) 热图显示了 LIHC 患者肿瘤浸润的幼稚 B 细胞、Bm 细胞和 AtM 细胞的上清液中自身抗原和肿瘤相关抗原特异性 IgG 和 IgM 的检测,如 (D) 所述,体外刺激 11 天后 (n = 4)。(F 和 G) 不同组织中幼稚 B 细胞、Bm 细胞、AtM 细胞、GC_D 区、GC_L 区和循环 GC B 细胞的 IgH 链 (F) 体细胞超突变频率和 CDR3 氨基酸长度 (G) 的箱型图。(H) 来自肿瘤浸润的幼稚 B 细胞、Bm 细胞、AtM 细胞、GC_D 区、GC_L 区和循环 GC 细胞的框内序列的 CDR3 长度 (以氨基酸计) 通过 scBCR-seq 数据集进行量化。(I) 代表 LIHC 和 COAD 中 AtM (左) 和 GC B 细胞 (右) 最大克隆的系统发育谱系树。分支上的数字显示体细胞突变的获得,表示突变和分支的数量。推定的未突变共同祖先用白色圆圈表示。(J) 箱型图显示了从幼稚 B 细胞到 AtM 或 GC B 细胞的非 ASC 亚群中推断的伪时间的分布。箱型图代表每个子集伪时间值的中间值、第 25 个百分位数和第 75 个百分位数。(K) 二维图显示了 B 细胞发育过程中沿着伪时间耗竭和 CSR 相关标记的动态表达。中心线表示线性拟合,阴影线表示 95% 置信区间。数据显示 IQR 的中位数 (E 和 H),须线表示最小值和最大测量值 (C、D、F、G 和 J)。*, P < 0.05; , P < 0.01; *, P < 0.001; ****, P < 0.0001; ns,不显著。P 值通过双侧 Wilcoxon 检验计算 (C、D、F 和 G)。
为了进一步探索外滤泡 AtM B 细胞的免疫复合体,同位型分析表明,与 Bm 细胞相比,肿瘤浸润的 AtM B 细胞转换较少,含有更高的 IGHD 和 IGHM(P < 0.01),而 IGHA1、IGHA2 和 IGHG2 在 Bm 中较为普遍(P < 0.01)(图 S8, B 和 C)。此外,在体外激活和分化 11 天后收集的肝细胞癌(LIHC)患者肿瘤 AtMB 细胞的上清液中,IgG、IgA 和 IgM 的含量低于 Bm(图 S8D)。再次,通过抗原微阵列测试这些上清液抗体的反应性显示,从 AtM B 细胞衍生的 ASCs 产生了更高水平的自身抗体,而从 Bm 衍生的 ASCs 产生了更高水平的与肿瘤相关抗原反应的抗体(图 4C),涵盖了 IgG、IgA 和 IgM 所有三种类型(图 S8E)。与这些发现一致,我们观察到 Bm 中 SHM 较高,而 AtM B 细胞中 SHM 水平较低或中等(图 S8F)。总的来说,我们的数据显示,耗竭的 AtM B 细胞表现出受损的抗体产生能力、旁观者激活和弱肿瘤反应性。
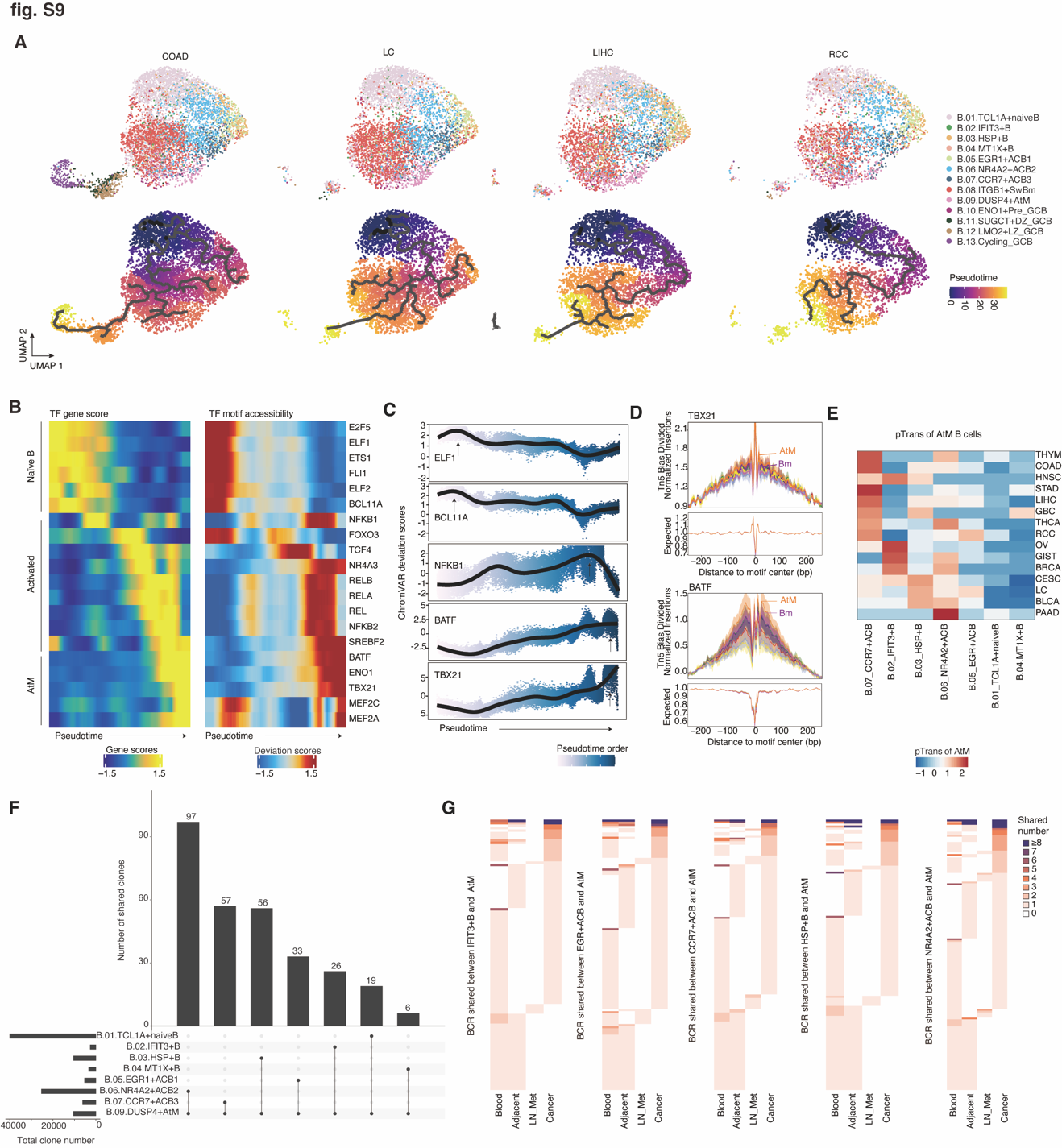
Fig.S9. AtM B 细胞的发育轨迹。(A) 分别在 COAD、LC、LIHC 和 RCC 中的非 ASC 细胞分化的 Monocle3 轨迹分析。细胞的颜色与其对应的伪时间相对应。(B) 使用 scATAC-seq 数据集,对来自幼稚 B 细胞经活化 B 细胞分化的 AtM B 细胞分化过程中的基因评分 (左) 和转录因子 motif 可及性 (右) 的伪时间热图排序。(C) 沿 AtM B 细胞分化轨迹转录因子偏差评分的动态变化。每个点代表 AtM B 细胞分化伪时间排序的 scATAC-seq 谱文件中偏差评分。线代表伪时间上的平滑拟合和指示的 TF 偏差评分。(D) 不同 B 细胞亚群中 TBX21 和 BATF 的转录因子足印。Tn5 插入偏差轨道显示在下方。(E) 热图显示了不同癌症类型的 AtM B 细胞和其他 B 细胞亚群之间的 pTrans。彩色表示按行缩放的 pTrans 值的 z 分数。(F) UpSet 图描绘了 B 细胞与 AtM B 细胞共享的扩增克隆数量。条形图显示了 AtM 和指示的 B 细胞之间共享的克隆数量。每个 B 细胞亚群的总克隆数由左侧的条形图显示。(G) 热图显示了 AtM B 细胞和非 AtM 亚群之间的克隆型共享。行代表克隆型,列代表不同的组织类型。按共享细胞数量着色。
另一个关键问题是 AtMB 细胞是否能进入 GC 或源自真正的 GC B 细胞(19, 74-76)。为了解决这一问题,我们共同分析了 BCR 复合体、发育轨迹、表观基因组调控和基因表达特征。我们观察到 AtM 和三个 GC B 细胞之间的 IGHV 使用、CDR3 氨基酸长度和 SHM 相当。这些数据支持 AtM 和 GC B 克隆通常是独立的而不是可互换的观点(图 S8, G 和 H)。因此,我们为 AtM 和 GC B 细胞最扩展的克隆重建了系谱树,显示克隆谱系主要源自 AtM 或 GC B 细胞(图 S8I)。伪时间轨迹分析确认了 AtM 和 GC B 细胞在两个独立分支上完全分离,以初级 B 细胞开始,终端分支为 AtM(路径 1)加循环 GC B 细胞(路径 2)(图 4D)。沿着轨迹,高亲和力特征得分和 CD24、CD38 和 SELL 逐渐在路径 2 中上调,而低亲和力和与耗竭相关的特征得分相关基因(即 PDCD1、ENTPD1 和 HAVCR2)相应地在路径 1 中上调,再现了 B 细胞从初级状态通过激活状态最终到 AtM 状态的发展(图 4E 和图 S8, J 和 K)。在这个过程中,耗竭的程度逐渐加剧。这一发展轨迹在不同癌症类型中均一致观察到(图 S9A),并通过 scATAC-seq 数据得到确认(图 S9B)。我们进一步识别了 AtM 的动态表达、染色质活性和足迹。与 Bm 和 GC B 细胞相比,AtM B 细胞表现出参与 CSR 和耗竭表型的 TFs 的高活性,并增强了特异同位型 IgG+ Bm 的免疫功能(33, 67, 77, 78),包括 TBX21 和 BATF(图 S9, C 和 D),表明独特的调控程序(图 3D)。CSR 相关的特征得分和基因(APEX1, APEX2, XRCC5, XRCC6, POLD2 和 AICDA)沿轨迹逐渐上调,表明 AtM B 细胞可能在不经历 GC 反应的情况下经历 CSR(图 4E 和图 S8K)。同样,AtM 在 EF 主导的癌症中与 IFIT3+ B 共享 BCR,包括 HNSC、OV、GIST、BRCA 和 CESC,表明由干扰素诱导的初级 B 细胞可能定向分化为 AtM 而不进入 GC(图 S9, E 至 G)。总的来说,这些发现表明 AtM 和 GC B 细胞经历了分别导致 EF 和 GC 来源 ASCs 的独立发展过程。
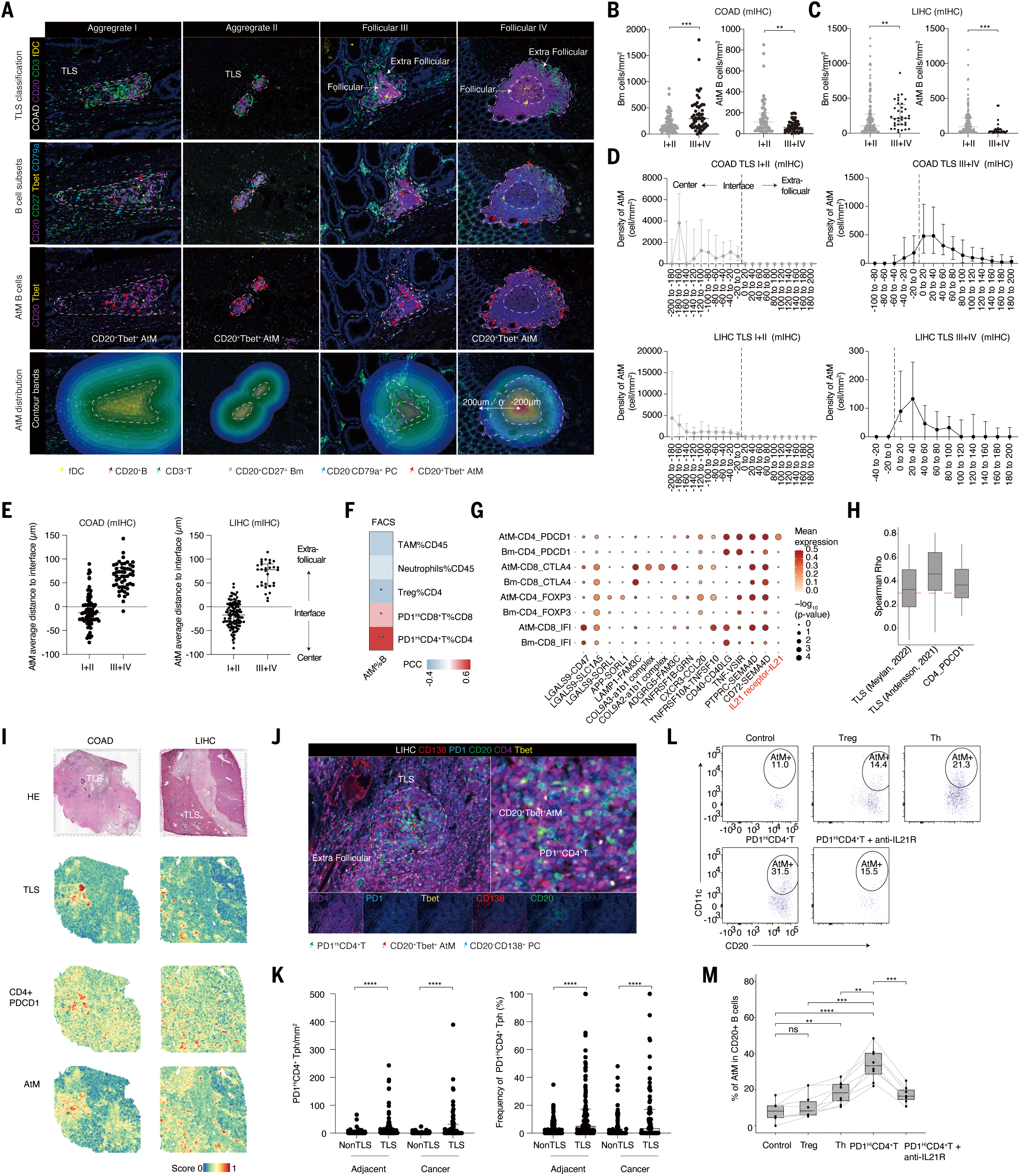
图 5. AtM B 细胞在不成熟的 TLS 中聚集,并通过 IL-21–IL-21R 轴由 Tph 细胞诱导。 (A) 结直肠腺癌(COAD)病例中,用于 TLS 成熟度的代表性多重免疫组化(mIHC)染色,显示 CD20, CD3, 和 fDC [CD21(长异构体),CD23, 和 CD35](第一行),B 细胞亚群的 CD20, CD27, T-bet, 和 CD79a(第二行),AtM B 细胞(第三行),以及 TLS 的浸润带(第四行)。黄色、绿色、紫色、棕色、红色和青色箭头分别代表 fDC、CD3+ T 细胞、CD20+ B 细胞、CD20+CD27+ Bm、CD20+T-bet+ AtM B 细胞和 CD20-CD79a+ ASCs。 (B 和 C) 通过 mIHC 揭示的结直肠腺癌(COAD)[(B), n = 6] 和肝细胞癌(LIHC)[(C), n = 17] 中不成熟和成熟 TLS 之间 Bm 和 AtM B 细胞的密度。 (D) 在结直肠腺癌(COAD)(顶部,n = 6)和肝细胞癌(LIHC)(底部,n = 17)中不成熟和成熟 TLS 中 AtM B 细胞的密度序列带。虚线指示界面线。线图代表中位数与四分位范围(IQR)。 (E) 在结直肠腺癌(COAD)(左侧,n = 6)和肝细胞癌(LIHC)组织(右侧,n = 17)中,AtM 到不成熟和成熟 TLS 界面的中位距离。虚线指示界面线。 (F) 通过流式细胞术确定肝细胞癌(LIHC)患者中肿瘤浸润的主要免疫亚群与 AtM B 细胞的相关性(n = 46)。PCC, 皮尔逊相关系数。 (G) AtM B 细胞和 T 细胞之间上调的配体 - 受体交流。y 轴代表亚群,x 轴代表配体和受体名称。圆圈大小代表对数标准化 P 值,颜色深度代表配体和受体的平均表达。 (H 和 I) 空间共定位相关性(H)和代表性图像(I)显示 AtM B 细胞特征与 TLS 或 PD1HiCD4+ Tph 在 81 个空间转录组学数据集中的关系,这些数据集来自九种癌症类型。相关性通过 Spearman rho 计算。数据来源和获取信息总结在表 S4 中。 (J) 代表性的多重免疫组化(mIHC)染色显示肝细胞癌(LIHC)肿瘤组织中 PD1HiCD4+ Tph 和 AtM B 细胞的共定位。绿色、黄色、红色和青色箭头分别代表 PD1HiCD4+ Tph、CD20+T-bet+ AtM B 细胞和 CD20-CD138+ PCs。 (K) (左侧)AtM B 细胞周围 20 毫米半径内 PD1HiCD4+ Tph 细胞的浸润密度和(右侧)频率,分别在肿瘤和邻近区域的 TLS 和非 TLS 区域中,来自肝细胞癌(LIHC)TMA(n = 180)。 (L 和 M) 肿瘤浸润的 Treg、Th 和 PD1HiCD4+ Tph 细胞被分选并与健康供者的外周全 B 或分选的初级 B 细胞以 1:5 的比例共培养,在有或无同种型和抗 IL-21R 的情况下培养 7 天。代表性流式图(L)和 AtM B 细胞的频率(M)通过 FACS 确定(n = 6 至 8)。数据在 (B) 至 (D),(E),和 (K) 中显示中位数与 IQR,在 (H) 和 (M) 中显示最小和最大测量值。**P < 0.01,***P < 0.001,****P < 0.0001;ns, 无显著性。P 值通过双侧未配对 Wilcoxon 检验确定 (B 和 C),双侧配对 Wilcoxon 检验确定 (K),以及双侧配对学生 t 检验确定 (M)。
外滤泡 B 细胞空间上位于不成熟的第三方淋巴结构(TLS)¶
TLS 通常由具有不同大小和细胞组成的 B 细胞形成。然而,TLS 与肿瘤浸润 B 细胞(TIBs),特别是 AtM B 细胞之间的空间结构和关系仍然不清楚。我们发现 AtM B 细胞高表达 TLS 特征性特征(7),并在泛癌症 TCGA 数据中得到确认,表明它们可能定位于 TLS 中(图 S10, A 和 B)。因此,我们对包含 EF 主导癌症 [肝细胞癌(LIHC)(n=358; n=180)和胰腺腺癌(PAAD)(n=48)] 以及 GC 主导癌症 [结直肠腺癌(COAD)(n=98)、胃腺癌(STAD)(n=52)、和肺癌(LC)(n=90)] 的组织微阵列(TMA)进行了多重免疫组化(mIHC)染色,以表征 TLS 和 AtM B 细胞(表 S1)。通过使用我们建立的 TLS 量化管道(8),我们将肿瘤组织划分为 TLS 和非 TLS 区域,并观察到 AtM B 细胞与 TLS 之间存在显著相关性,表明 AtM B 细胞在 TLS 形成中可能发挥作用(图 S10, C 和 D)。
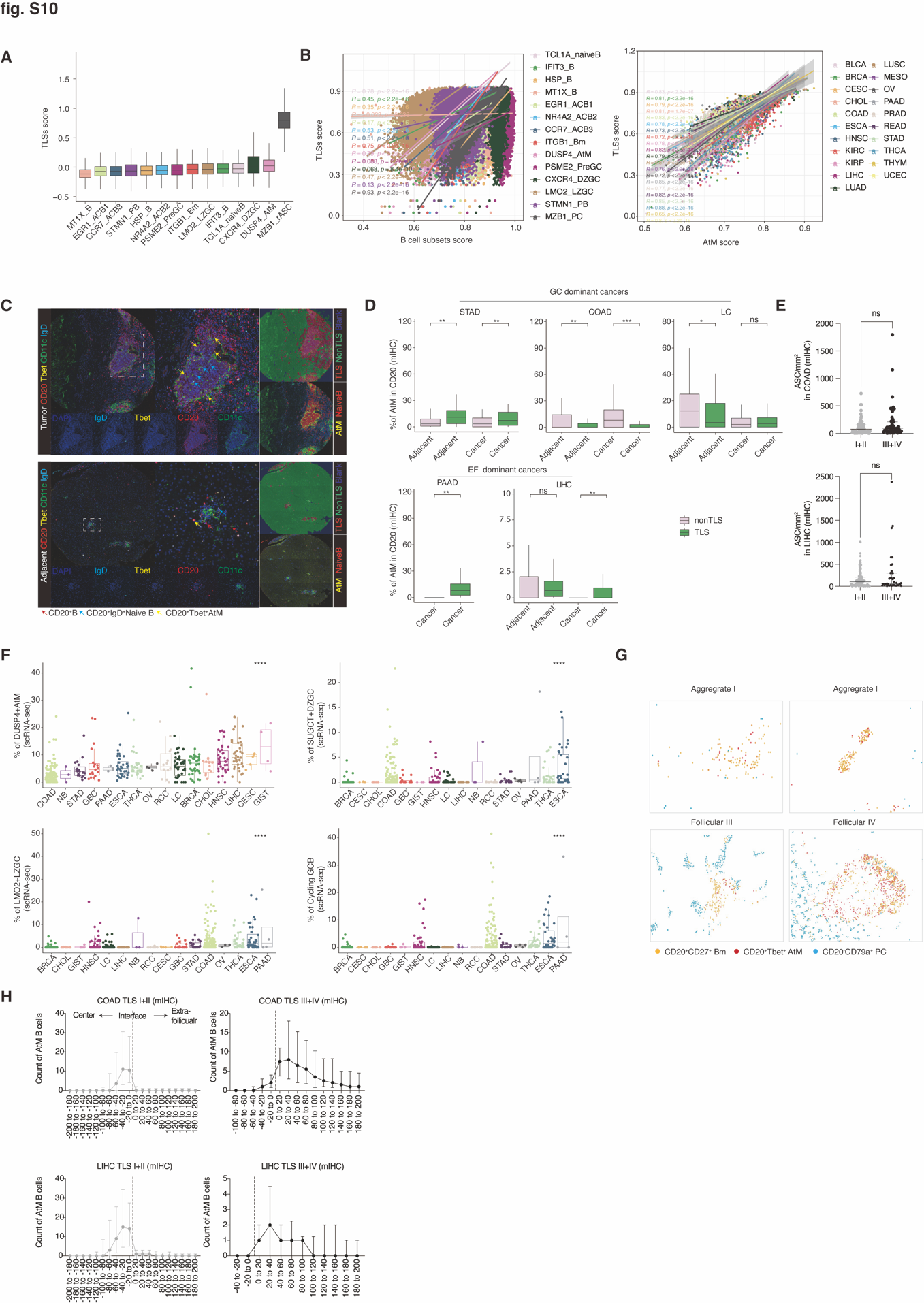
Fig.S10. AtM B 细胞与 TLS 呈正相关。(A) 框图显示了 B 细胞亚群的 TLS 评分,通过先前描述的 B 细胞亚群和 TLS 标志基因的平均表达进行计算 (7)。(B) TLS 标志基因 (7) 和 B 细胞亚群标志基因 (调整后的 P 值 < 0.05 和 log2 (fold change) > 0.5) 用于计算 ssGSEA 的标志评分。TLS 评分与 14 个 B 细胞亚群 (左) 或 AtM B 细胞 (右) 评分在不同 TCGA 癌症类型中的相关性通过 Spearman 相关系数计算 (n = 6256)。(C) LIHC 中不同 B 细胞亚群的 CD20、Tbet、IgD 和 CD11c 多重 IHC 染色代表。(红色、青色和黄色箭头分别代表 CD20+、幼稚和 AtM B 细胞。) 组织根据先前描述的方式分为 TLS 和非 TLS 区域 (8)。(D) 框图显示了 GC (STAD、COAD 和 LC) 和 EF 来源优势 (PAAD 和 LIHC) 癌症中 TLS 和非 TLS 区域的 AtM 频率。(E) 不同癌症类型揭示了 COAD (n = 6) 和 LIHC (n = 17) 中未成熟和成熟 TLS 之间 ASCs 的密度。(G) 不同成熟阶段 TLS 中 AtM、Bm 和 ASC 的表型图。红色、青色和黄色点分别代表 CD20 CD79a+ ASCs。(H) COAD (n = 6) 和 LIHC (n = 17) 中未成熟和成熟 TLS 系列条带内 AtM B 细胞的绝对数量。虚线表示界面线。折线图显示的是 IQR 的中位数。数据显示 IQR 的中位数 (E 和 H),须线表示最小值和最大测量值 (A、D 和 F)。*, P < 0.05; , P < 0.01; **, P < 0.0001; ns,不显著。P 值由双侧配对 Wilcoxon 检验 (D)、双侧非配对 Wilcoxon 检验 (E) 和双向方差分析 (F) 确定。
考虑到 TLS 成熟的临床意义(成熟的 TLS:III 和 IV 阶段的类 GC 结构,包含滤泡树突细胞(fDCs);不成熟的 TLS:I 和 II 阶段的淋巴聚集体)以及 TME 中类 GC 的 TLS 稀少性(8, 79-82),我们进一步筛选了来自 LIHC(n=17)和 COAD(n=6)的不同 TLS 阶段的整个组织切片。根据 T 和 B 细胞的数量以及 fDC 染色,将 TLS 分类为四个阶段(8)(图 5A)。AtM B 细胞在不成熟的 TLS 中显著富集,而 Bm 主要位于 COAD 和 LIHC 的成熟 TLS 中(图 5, B 和 C)。在不同 TLS 阶段之间没有观察到 ASC 密度的差异(图 S10E)。正如预期的那样,AtM B 细胞主要富集在 EF 主导的癌症中,如胃肠道间质瘤(GIST)、宫颈鳞状细胞癌和宫颈腺癌(CESC)、肝细胞癌(LIHC)和头颈部鳞状细胞癌(HNSC),而 GC B 细胞在 GC 主导的癌症中高度丰富,如结直肠腺癌(COAD)、甲状腺癌(THCA)和肺癌(LC)(图 S10F),表明 GC 主导癌症主要包含成熟的 TLS,而 EF 主导癌症中的 TLS 不成熟。如卵巢癌(OV)这样 EF 和 GC 路径同等存在的癌症,与其他癌症相比,AtM 和 GCLZ B 细胞的浸润中等。在空间上,我们计算了 AtM B 细胞在 TLS 或滤泡的内外边缘 200 毫米内的密度以及 AtM B 细胞到界面的距离。我们观察到 AtMB 细胞主要位于不成熟 TLS 的中心,这与早期 EF 反应和促进 TLS 形成一致(图 5, D 和 E 以及图 S10, G 和 H)。随着 TLS 的成熟,AtM B 细胞迁移到外围,而初级 B 细胞始终位于 TLS 的中心(图 S10C)。这些数据验证了 AtM B 细胞的 GC 独立发展,并表明 TLS 成熟阶段驱动 EF 和 GC 主导癌症中不同的 B 细胞分化。
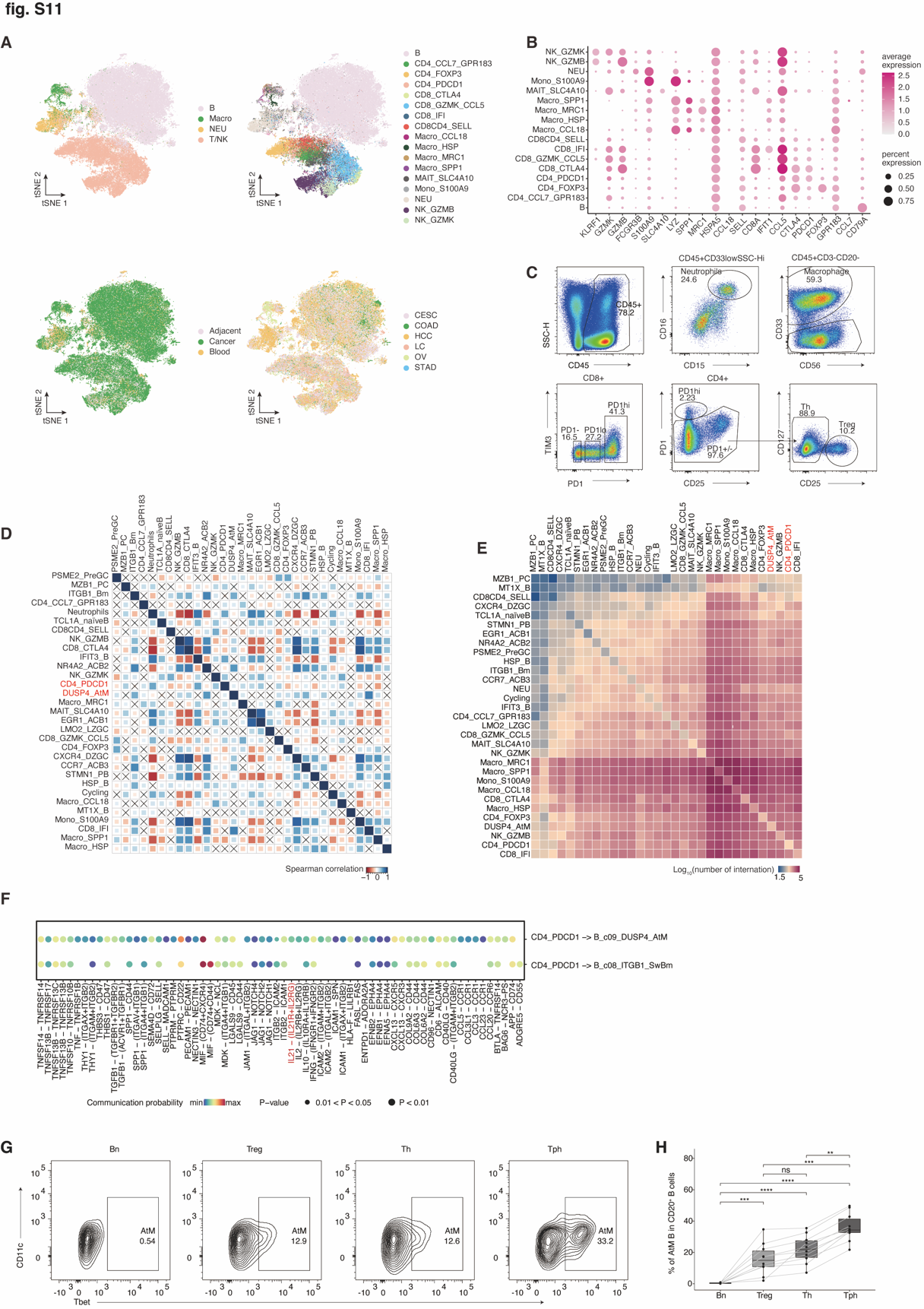
Fig.S11. PD1HiCD4+ Tph 细胞可通过 IL21-IL21R 诱导 AtM B 细胞分化。(A) UMAP 图分别显示了四种主要免疫细胞类型 (左上)、髓细胞、NK、CD4 和 CD8 T 细胞亚群 (右上)、组织类型 (左下) 和癌症类型 (右下)。(B) 免疫细胞亚群中标记基因表达的点图。颜色代表标记基因的最大归一化平均表达,大小代表表达这些基因的细胞百分比。(C) 代表性流式图显示了肿瘤浸润性中性粒细胞、巨噬细胞、Treg、PD1HiCD8 Tex 和 PD1HiCD4 Tph 細胞的划门策略。(D) 热图显示了 TCGA pan-cancer 数据集中肿瘤中 B 细胞亚群和其他免疫亚群之间的相关性 (n = 6256)。免疫细胞亚群的频率由 BayesPrism 模型估计 (85)。颜色代表 Spearman 相关系数。(E) 热图显示了 B 细胞和其他免疫亚群之间使用 scRNA-seq 数据的相互作用。颜色代表配体 - 受体相互作用的缩放强度。(F) 使用我们匹配的 CD45+ scRNA-seq 数据显示 CD4_PDCD1 和 Bm 或 AtM B 细胞之间的配体 - 受体 (L-R) 相互作用。(G 和 H) 对 LIHC 浸润的 Treg、Th 和 PD1HiCD4 Tph 细胞进行排序,并与健康供血者的 Bn 细胞以 1:2 的比例共培养 5 天,同时加入 CD3/CD28 珠。FACS 测定代表性流式图 (G) 和 AtM B 细胞频率 (H) (n = 10)。数据显示 IQR 的中位数,须线表示最小值和最大测量值 (H)。, P < 0.01; *, P < 0.001; ****, P < 0.0001; ns,不显着。P 值由双侧配对 Wilcoxon 检验确定。
这种 AtM B 细胞的特定位置通过上调 CCR7、CXCR3 和 EBI2(编码 GPR183)等归巢受体得到响应,这些受体可以将 AtM B 细胞驱动到 B 区 -T 区边界等待 T 细胞帮助(52, 83)。事实上,AtM B 细胞与 T 滤泡辅助细胞(Tfh)或 I 型 T 辅助细胞(Th1)之间的强相关性,后者在病毒感染中分泌 IFNg、IL-21 和 CD40L(76, 84),指向这些 T 细胞类型与 AtM B 细胞发展之间的潜在交流。流式细胞术和通过 BayesPrism(85)解卷积的泛癌症 TCGA 数据表明,AtM B 细胞与 PD1Hi 耗竭 T 细胞呈正相关(图 5F 和图 S11, A 至 D),尤其是表现出 PD1HiCXCL13+CXCR5- 表型的 PD1HiCD4+ T 细胞(称为外周辅助 T 细胞,Tph),这些细胞可以促进 TLS 形成和自身免疫病中 B 细胞的终末分化(86, 87)。配体 - 受体分析提供了额外证据支持 PD1HiCD4+ Tph 细胞与 AtM B 细胞之间的交流,特别是通过 IL-21R–IL-21 轴,与 Bm 细胞相比。这种相互作用暗示 PD1HiCD4+ Tph 细胞在促进 AtM B 细胞分化中可能发挥作用(图 5G 和图 S11E),这也通过另一个独立算法 CellChat(88)得到验证(图 S11F)。通过已发表的空间转录组学数据集(81 个数据集来自九种癌症类型,包括乳腺癌(BRCA)、宫颈鳞状细胞癌和宫颈腺癌(CESC)、结直肠腺癌(COAD)、肝细胞癌(LIHC)、低级别胶质瘤(LGG)、卵巢癌(OV)、前列腺腺癌(PRAD)、肾细胞癌(RCC)和皮肤黑色素瘤(SKCM))可视化 CD4+PD1Hi Tph 和 AtM B 细胞,揭示了它们在 TLS 中的正相关(图 5, H 和 I 及表 S4),这进一步得到了在 LIHC TMA(n=180)上进行的 mIHC 染色的支持,显示在 TLS 中与 AtM B 细胞紧密相邻的区域中,CD4+PD1Hi Tph 细胞密度和频率显著更高,无论是在肿瘤还是邻近组织的非 TLS 区域(图 5, J 和 K)。为了验证这一点,分选的 LIHC 浸润的 PD1HiCD4+ Tph、Th 和调节性 T(Treg)细胞与健康捐赠者的外周总 B 或分选的初级 B 细胞共培养(图 5L 和图 S11G)。结果显示,Tph 细胞比 Th 和 Treg 细胞更有效地诱导 AtM B 细胞分化,这通过 IL-21R 阻断显著减弱(图 5M 和图 S11H)。总的来说,这些数据表明,肿瘤浸润的 Tph 细胞显著促进了 AtM B 细胞的分化。
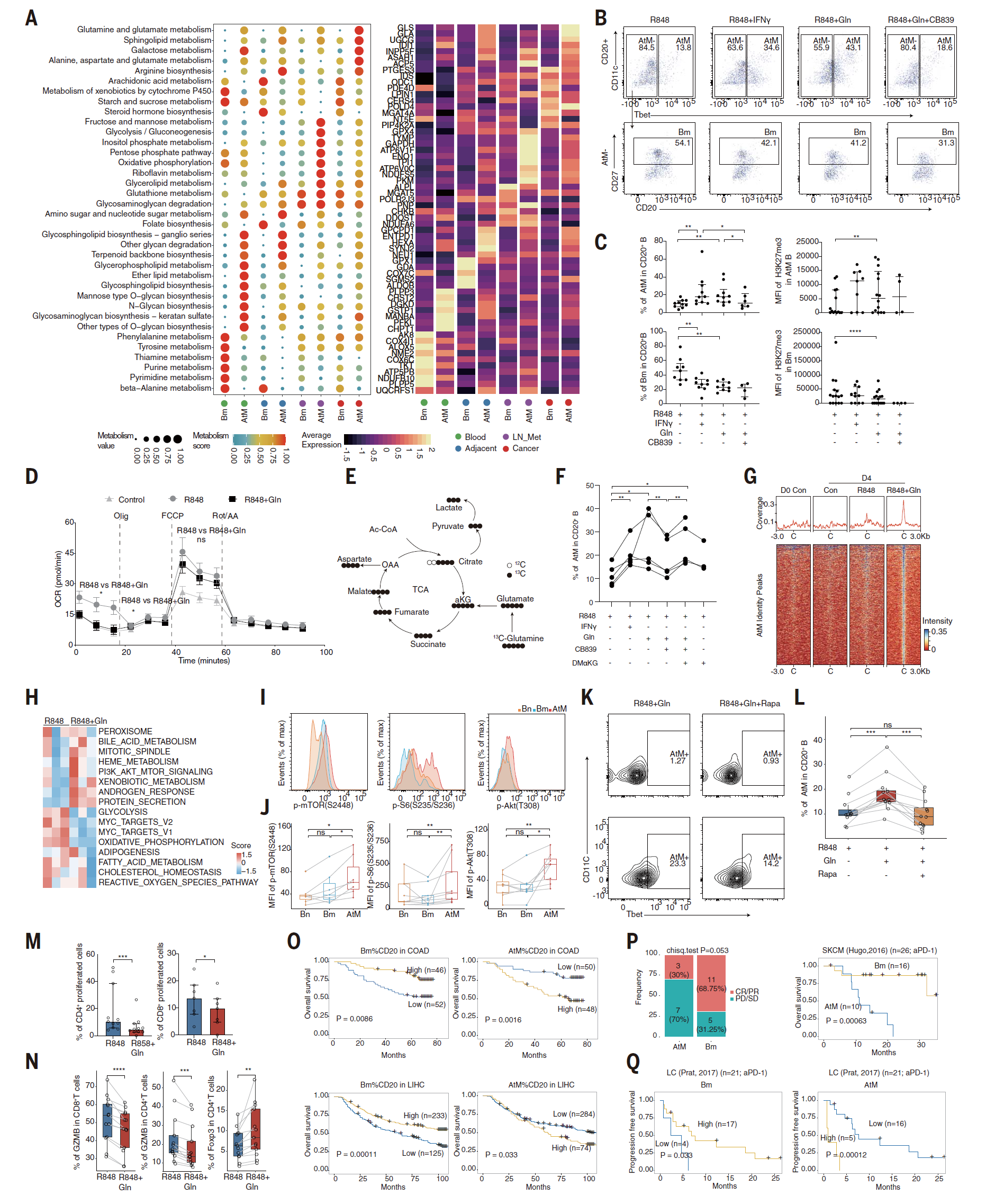
图 6. 谷氨酸促进 AtM B 细胞分化并获得免疫调节功能。 (A) Bm 和 AtM B 细胞的代谢途径中位得分(左)和不同组织的平均代谢基因表达的热图(右)。圆圈大小和颜色均代表缩放的代谢得分(左)。热图的颜色代表平均代谢基因表达(右)。 (B 和 C) 健康人血液 B 细胞被 R848 单独或与 IFNg 或谷氨酸或谷氨酸和 CB839 一起刺激 4 天。 (B) 通过 FACS 检测的 AtM(顶部)和 Bm(底部)细胞的代表性流式图。 (C) (左) CD20+ B 细胞中 Bm 和 AtM 的频率,(右)Bm 或 AtM B 细胞中三甲基化组蛋白 H3(K27)的频率,通过 FACS 检测(n = 6 至 10)。 (D) 在健康人血液 B 细胞中,使用磷酸盐缓冲液(PBS)(对照)或与 R848 以及有无谷氨酸刺激 24 小时后,再加入橄榄霉素、FCCP 和 Rot/AA(Rot/AA)(n = 4)检测的实时氧消耗率(OCR)。图示为均值 ± 标准差。 (E) 在健康人血液 B 细胞中,使用 R848 刺激 24 小时的 13C 标记谷氨酸的代谢追踪分析(n = 4)。通过质谱(MS)检测 R848 和谷氨酸刺激的 B 细胞中指示的标记代谢物。 (F) 健康人血液 B 细胞被 R848 单独或与 IFNg 或谷氨酸刺激;或谷氨酸和 CB839;或谷氨酸、CB839 和 DMaKG;或 DMaKG 刺激 4 天。通过 FACS 检测 CD20+ B 细胞中 AtM 的频率(n = 3 至 5)。 (G) 在 DPBS 或 R848 单独或 R848 和谷氨酸刺激 4 天的健康人血液 B 细胞中,显示染色质可及性热图(n = 3)。颜色代表我们的 scATAC-seq 数据集中识别的 AtM 身份峰的强度。 (H) 对 R848 单独或与 R848 存在下处理的谷氨酸的健康人血液 B 细胞的通路富集分析热图 4 天(n = 3)。颜色代表缩放的通路富集得分。 (I 和 J) 肿瘤浸润的初级、Bm 和 AtM B 细胞中与 mTOR 信号相关的磷酸化蛋白的代表性流式图 (I) 和箱形图 (J),来自肝细胞癌患者(n = 7 至 9)。 (K 和 L) 健康人血液 B 细胞被 R848 单独或与谷氨酸或谷氨酸和雷帕霉素刺激 4 天。 (K) 显示来自 FMO(荧光减一)(顶部)和实验组(底部)的代表性流式图,(L) 通过 FACS 确定 CD20+ B 细胞中 AtM 的频率(n = 12)。 (M) 健康人血液 B 细胞被 R848 单独或与谷氨酸刺激 4 天。刺激后的 B 细胞被收集并与 CFSE 标记的健康人血液 T 细胞以 2:1 的比例共培养,在 CD3/CD28 珠子存在下培养 3 天。通过流式细胞术确定增殖的 CD4+ 和 CD8+ T 细胞的频率(n = 12)。 (N) 健康人血液 B 细胞被 R848 单独或与谷氨酸刺激 4 天。刺激后的 B 细胞被收集并与健康人血液 T 细胞以 2:1 的比例共培养,在 CD3/CD28 珠子存在下培养 5 天。通过流式细胞术确定细胞毒性 CD4+ 和 CD8+ T 细胞的频率以及 CD4+ T 细胞中 Tregs 的频率(n = 13)。 (O) 根据结直肠腺癌(COAD)(n = 98,顶部)和肝细胞癌(LIHC)(n = 358,底部)患者 CD20+ B 细胞中 Bm 和 AtM B 细胞的频率的 Kaplan-Meier 总生存曲线。 (P) 根据 Bm 和 AtM B 细胞的特征得分,分层治疗的皮肤黑色素瘤(SKCM)患者(n = 26)的反应率(左)和总生存(右)的情况。CR,完全缓解;PR,部分缓解;PD,进展性疾病;SD,稳定疾病。 (Q) 根据 Bm 和 AtM B 细胞的特征得分分层的肺癌(LC)患者(n = 26)接受抗 PD1 治疗的无进展生存 Kaplan-Meier 曲线。数据显示中位数和 IQR 在 (C) 和 (M) 中;在 (J),(L) 和 (N) 中显示最小和最大测量值。*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001;ns, 无显著性。P 值由双侧 Wilcoxon 检验确定 (C),(D) 和 (F);Mann-Whitney 检验确定 (D) 和 (N);双侧配对学生 t 检验确定 (L) 至 (N);双侧对数秩检验确定 (O)(右侧),(P) 和 (Q),以及 χ² 检验确定 (P)(左侧)。
谷氨酸代谢建立外滤泡 AtM B 细胞的表观遗传身份¶
我们接下来研究了在肿瘤微环境(TME)中机械性地推动对 EF 与 GC 路径的主要反应的因素。对 B 细胞进行的通路分析揭示了人类癌症类型间代谢途径的显著差异,暗示潜在的 B 细胞身份代谢调控(图 S12A)。我们使用 scMetabolism(89)计算了 Bm 和 AtM B 细胞的代谢途径得分,并对代谢相关基因进行了无监督聚类(图 6A)。在肿瘤浸润的 AtM B 细胞中,谷氨酸、谷氨酰胺和鞘磷脂代谢被上调,而花生四烯酸代谢在 Bm 细胞中显著上调。这些途径的核心基因,如谷氨酰胺酶(GLS)、GLA 和 PTGES3,显示了类似的趋势(图 S12B)。这些结果在不同类型的癌症中观察到,没有癌症类型偏好(图 S12C)。
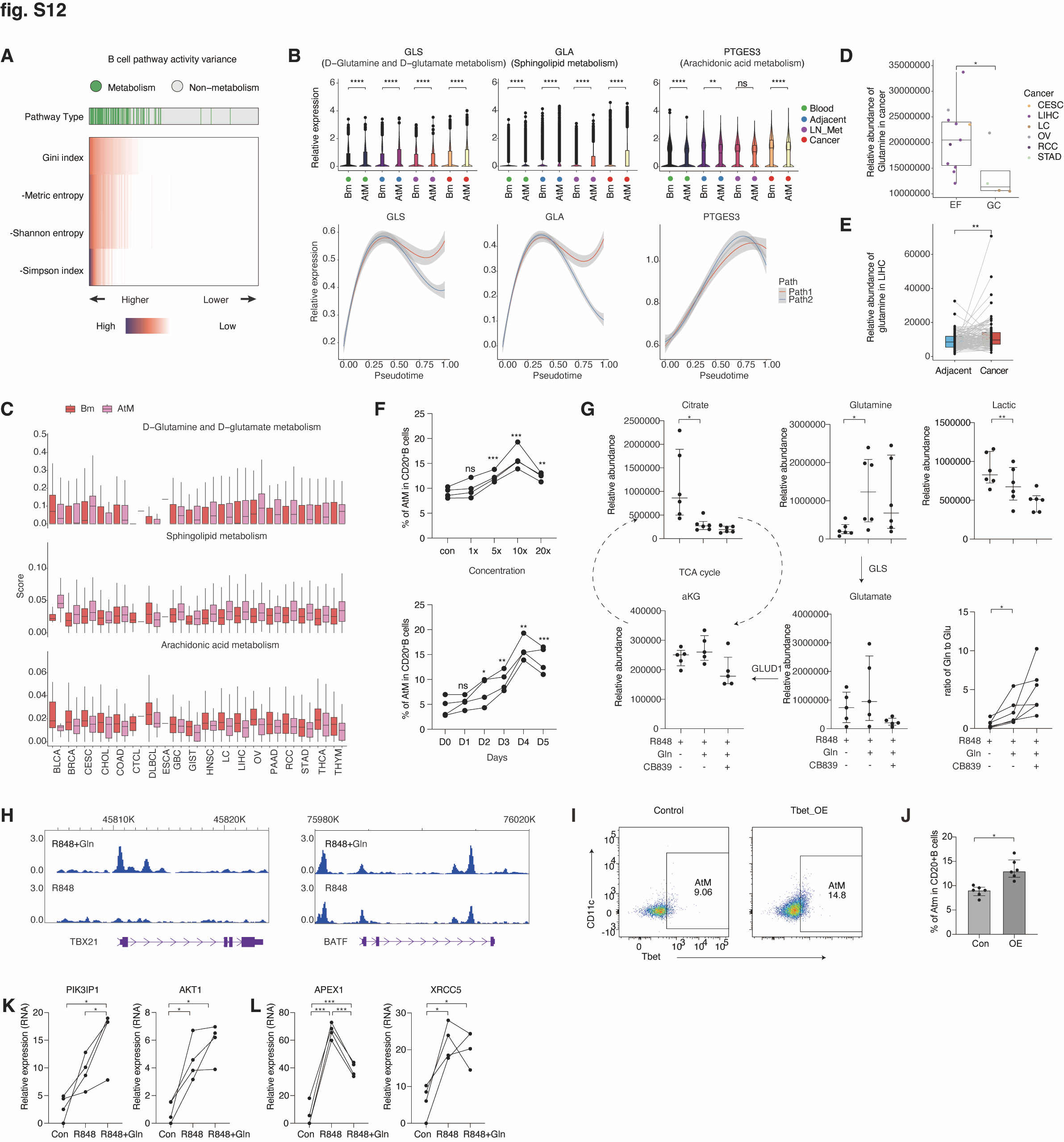
Fig.S12. AtM B 细胞的代谢-表观遗传特征。(A) 使用四个通路方差指数估计 B 细胞亚群的通路活性方差,并且无监督聚类显示代谢通路在 scRNA-seq 数据集中排名高于非代谢通路。(B) 不同组织中富集于 Bm 和 AtM B 细胞的选定代谢基因的表达 (顶部),以及它们在推断的伪时间 (底部) 沿着 path1 (红色) 和 path2 (蓝色) 细胞中的动态表达。中心线表示线性拟合,阴影线表示 95% 置信区间。(C) 箱型图显示了使用 scMetabolism 计算的 scRNA-seq 数据集中不同癌症类型中 Bm 和 AtM B cells 中选定代谢途径的富集。(D) 非靶向代谢组学检测的 EF 和 GC 来源优势癌中的谷氨酰胺。(E) 非靶向代谢组学检测的 LIHC (n = 109) 配对癌组织和邻近正常组织中的谷氨酰胺。(F) 健康血 B 细胞用 R848 连续五天刺激,使用不同的谷氨酰胺生理血浆浓度 (DPBS,1x、5x、10x 和 20x)。FACS 检测 CD20 B 细胞中 AtM B 细胞的频率 (n = 4)。(G) 健康血 B 细胞单独用 R848 刺激或与 R848 在 10 倍谷氨酰胺或 10 倍谷氨酰胺和 CD839 存在下刺激 24 小时。提取细胞内代谢物并通过质谱检测 (n = 5)。(H) ATAC-seq 轨迹显示健康血 B 细胞用 R848 单独刺激或在 10 倍谷氨酰胺存在下用 R848 刺激 4 天后 TBX21 和 BATF 位点的染色质可及性。(I 和 J) 过表达 TBX21 的健康血 B 细胞用 R848 和谷氨酰胺刺激 4 天。FACS 检测代表性流式图 (I) 和 AtM B 细胞的频率 (J) (n = 6)。(K 和 L) 用 DPBS (对照) 或单独用 R848 或用 R848 和 10 倍谷氨酰胺刺激 4 天的健康血 B 细胞中 mTORC1 通路 (K) 和 CSR 相关基因 (L) 的相对基因表达 (n = 4)。数据显示 IQR 的中位数 (G 和 J),须线表示最小值和最大测量值 (B、C、D 和 E)。*, P < 0.05; , P < 0.01; *, P < 0.001; ns,不显着。P 值由双侧 Wilcoxon 检验 (D)、双侧配对 Student t 检验 (F、G、J 和 K) 确定。
考虑到谷氨酸在 TME 中的基本作用和大量存在(90-92),我们研究了谷氨酸与我们队列中 B 细胞免疫表型的关联。通过基于质谱的非靶向代谢组学,我们的数据表明,以 EF 反应为主的癌症(肝细胞癌、宫颈鳞状细胞癌和肾细胞癌)的谷氨酸显著高于 GC 主导的癌症(胃腺癌和肺癌)(图 S12D)。此外,肝细胞癌中的肿瘤与邻近正常组织相比,谷氨酸显著更高(n=109)(图 S12E),而结直肠腺癌和胃腺癌这两种 GC 主导的癌症,其谷氨酸水平低于邻近正常组织(93)。因此,我们假设谷氨酸代谢可能在 TME 中启动 EF 反应中发挥潜在作用。
为了验证这一假设,我们收集了健康血液中的 B 细胞,并用 R848(TLR7 激动剂)、IFNg 和谷氨酸刺激它们。类似于 IFNg 在自身免疫疾病中的作用(21, 22),与单独 R848 相比,谷氨酸显著诱导了 AtM 分化,而 GLS 抑制剂(CB839)显著减弱了这一效应(图 6, B 和 C)。作为对照,Bm 细胞对 IFNg 和谷氨酸的刺激反应显著减少,表明谷氨酸通过对立的调节机制影响 AtM 和 Bm 细胞。此外,在体外谷氨酸刺激下,AtM 逐渐增加,并在第 4 天左右达到高峰,剂量依赖性最大化约为生理浓度的 10 倍(图 S12F)。我们监测了 B 细胞在谷氨酸刺激下的氧消耗率和三磷酸腺苷(ATP)产量,并观察到线粒体呼吸加上糖酵解的全球降低(图 6D)。这表明谷氨酸可能重塑 B 细胞的代谢特征,导致我们假设谷氨酸抑制了 B 细胞的克隆扩张或正选择,从而将 B 细胞分化转向 AtM B 细胞(94)。
外滤泡 B 细胞培育免疫调节微环境,并与人类癌症的不良预后相关¶
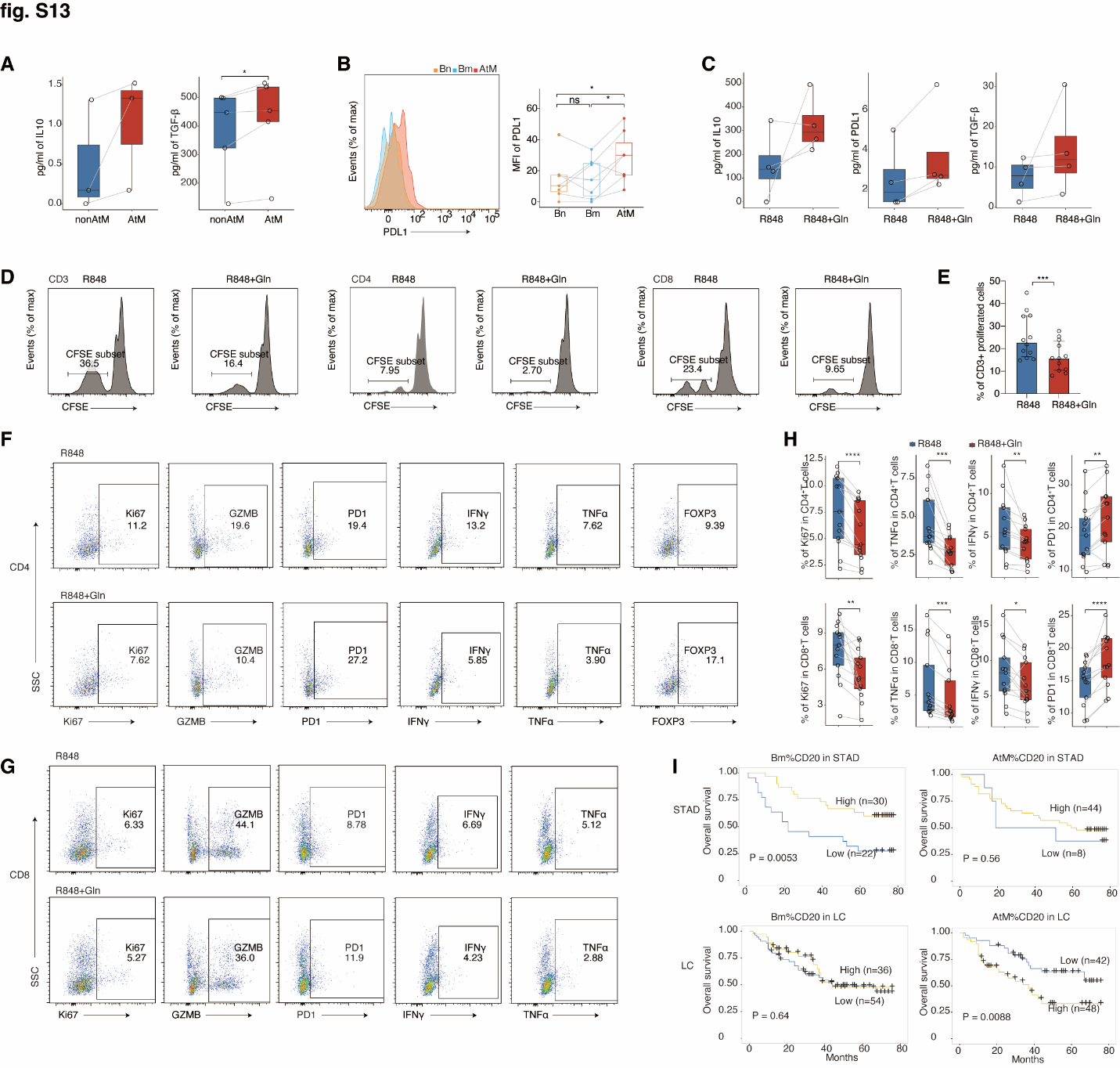
Fig.S13. AtM B 细胞的免疫调节功能与更差的预后相关。(A) 从 LIHC 患者中分离出肿瘤浸润的 AtM 和非 AtM B 细胞,并用 PMA 和离子霉素 (PI) 刺激 5 小时。收集上清液,通过 ELISA 测定 IL10 (左) 和 TGF β (右) 的浓度 (n = 3-5)。(B) LIHC 患者肿瘤浸润的幼稚 B 细胞、Bm 细胞和 AtM B 细胞中 PDL1 的代表性图 (左)。LIHC 患者肿瘤浸润的幼稚 B 细胞、Bm 细胞和 AtM B 细胞中 PDL1 的 MFI 箱型图 (右,n = 7)。(C) 健康血 B 细胞单独用 R848 刺激或在谷氨酰胺存在下用 R848 刺激 4 天。收集刺激的 B 细胞并用 PI 刺激 5 小时。收集上清液,通过 ELISA 测定 IL10、PDL1 和 TGF β 的浓度 (n = 4)。(D 和 E) 健康血 B 细胞单独用 R848 刺激或在谷氨酰胺存在下用 R848 刺激 4 天。收集刺激的 B 细胞,并与 CFSE 标记的健康血 T 细胞以 2:1 的比例共培养 3 天,同时加入 CD3/CD28 珠。通过流式细胞术测定增殖的 CD4+、CD8+ 和 CD3+ T 细胞的代表性图 (D) 和增殖的 CD4+ T 细胞的频率 (E) (n = 12)。(F-H) 健康血 B 细胞单独用 R848 刺激 (顶部) 或在谷氨酰胺存在下用 R848 刺激 (底部) 4 天。收集刺激的 B 细胞,并与健康血 T 细胞以 2:1 的比例共培养 5 天,同时加入 CD3/CD28 珠。CD4+ (F) 和 CD8+ (G) T 细胞中表达的功能标记物的代表性流式图。通过流式细胞术测定 CD4+ 和 CD8+ T 细胞的 Ki67、TNFα、IFNγ 和 PD1 的频率 (H) (n = 13)。(I) 来自 STAD (n = 52) 和 LC (n = 90) 患者的 CD20+ B 细胞中 Bm 和 AtM B 细胞频率的 OS 的 Kaplan-Meier 生存曲线。数据显示 IQR 的中位数 (E) 和须线表示最小值和最大测量值 (A、B、C 和 H)。*, P < 0.05; , P < 0.01; *, P < 0.001; ****, P < 0.0001. P 值通过双侧配对 Wilcoxon 检验 (A、C)、双侧配对 Student t 检验 (E 和 H) 和双侧 log-rank 检验 (L) 测量。
鉴于外滤泡 AtM B 细胞与 T 细胞在 TLS 内的空间共定位,我们探讨了 AtM B 细胞对 T 细胞的潜在影响(图 5A)。经刺激后,分选的肝细胞癌浸润的 AtM B 细胞分泌的 IL-10 和转化生长因子 -β(TGF-β)较多,并表达的 PDL-1 高于非 AtM B 细胞,这一结果与对照相比,通过谷氨酸诱导的 B 细胞也得到了验证(图 S13, A 至 C)。接下来,我们用谷氨酸诱导外周 B 细胞转化为 AtM,并与外周 CD3+ T 细胞共培养体外。AtM B 细胞能够减少 CD4+ 和 CD8+ T 细胞的增殖(图 6M 及图 S13, D 和 E),并损害 T 细胞产生 IFNγ、肿瘤坏死因子 -α(TNF-α)和颗粒酶 B 的能力(图 6N 及图 S13, F 和 G)。AtM B 细胞促进了向调节性 T 细胞(Treg)和耗竭 T 细胞的分化(图 S13H),这与先前的研究相似,这些研究显示 CD27− 耗竭 B 细胞和位于不成熟 TLS 中的 B 细胞与 Treg 相关并共定位(41, 97)。
最后,我们探讨了 Bm 和 AtM B 细胞在癌症中的预后价值。在四个独立队列(结直肠腺癌、胃腺癌、肺癌和肝细胞癌)中,无论是 EF 或 GC 主导的癌症,Bm 细胞与良好的预后相关,而 AtM B 细胞与更差的生存率相关(图 6O 和图 S13I)。此外,在接受抗 PD1 治疗的黑色素瘤(n = 26)(98)和肺癌(n = 21)(99)的已发布队列中,AtM B 细胞的丰度显著与治疗抗性相关,而 Bm 细胞则与改善的反应和更长的生存期相关(图 6, P 和 Q)。总体来说,这些观察结果表明,EF 来源的 B 细胞与不成熟的 TLS 和耗竭的 T 细胞相关,导致免疫治疗抗性和某些癌症的预后不良。====