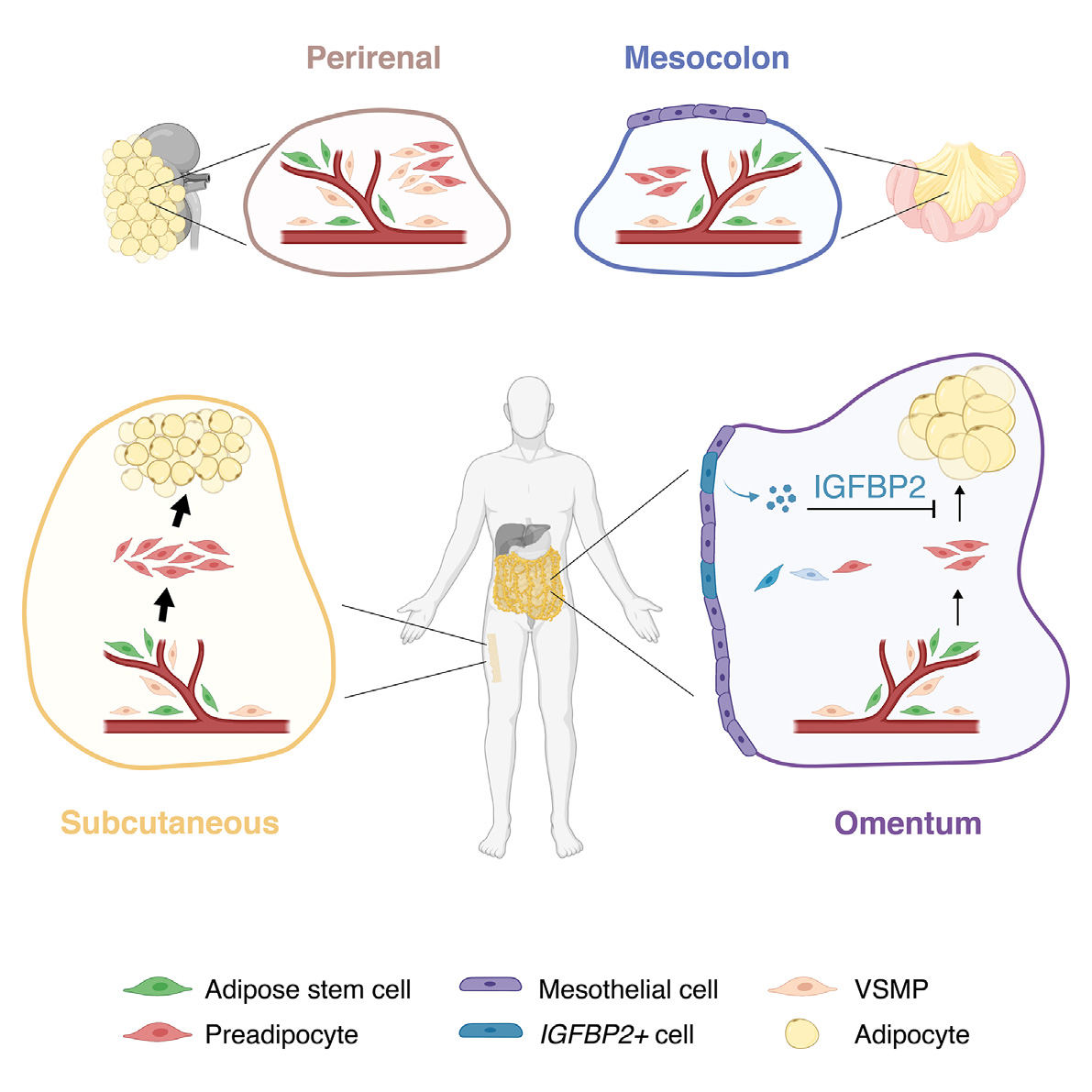
A human omentum specific mesothelial like stromal population inhibits adipogenesis through IGFBP2 secretion
摘要¶
脂肪组织的可塑性由基质血管部分(SVF)内在分子和功能上多样的细胞协调。尽管目前已经鉴定出几种小鼠和人类脂肪 SVF 细胞亚群,但我们仍然缺乏对人类脂肪库中脂肪干细胞和祖细胞(ASPC)群体的细胞和功能变异性的理解。为了解决这个问题,我们对超过 30 个来自四个人类脂肪库的 SVF/Lin−样本进行了单细胞和批量 RNA 测序(RNA-seq)分析,揭示了两种广泛存在的人类 ASPC(hASPC)亚群,这些亚群具有不同的增殖和脂肪生成特性,但也表现出库依赖性和 BMI 依赖性的比例。此外,我们鉴定出一种特异于网膜的、高 IGFBP2 表达的基质群体,该群体在间皮细胞和间充质细胞状态之间转换,并通过 IGFBP2 分泌抑制 hASPC 的脂肪生成。我们的分析强调了不同脂肪小生境的分子和细胞独特性,同时我们发现的抗脂肪生成的 IGFBP2+ 特异于网膜的群体为网膜 hASPCs 的有限脂肪生成能力提供了新的生物医学相关的理由。
引言¶
我们对脂肪组织(AT)表型的关键特征,如在代谢变化响应中的周转和扩展动态的理解仍然有限,特别是在人体 AT 中。此外,这些表型根据 AT 的解剖位置而有所不同。这一点通过“代谢健康”的皮下(SC)AT 与“不健康”的内脏 AT 的频繁对立得以体现。然而,术语“内脏”和“皮下”涵盖了几个更细致的解剖位置,以及与疾病更细致的特征和联系。例如,特定解剖位置的脂肪积累与肥胖相关的胰岛素抵抗有更强的联系。部分原因是不同脂肪库通过新脂肪细胞形成(增生)和/或其现有脂肪细胞的(过度)生长(肥大)来增加其大小的内在能力不同。虽然普遍接受的是来自不同解剖位置的人类 AT 扩展方式不同,但我们对这些表型差异的原因知之甚少。一种可能性是,这些差异可能部分由不同脂肪库中基质血管部分(SVF)的细胞组成变异,特别是脂肪干细胞和祖细胞(ASPCs)的变异驱动。整个人类 AT 的单细胞 RNA 测序(scRNA-seq)图谱提供了人类 ASPCs 异质性的见解。然而,这些 scRNA-seq 研究主要集中在最广泛研究的两种 AT:皮下和网膜(OM),后者是人类的主要内脏 AT。因此,超出 SC 和 OM 脂肪库的 hASPC 组成的相似性和/或差异仍不明确。
在小鼠研究中表明,ASPCs 在不同脂肪库中具有高度异质性,但可以分类为至少三大亚群,具有特定的细胞表面标记和不同的功能特性。例如,Dpp4+(或 Ly6c+)细胞代表脂肪干细胞(ASCs),这是一组多能间充质干细胞,在暴露于适当的因子组合时致力于脂肪生成。相比之下,Icam1+(或 Aoc3+)细胞可以分类为前脂肪细胞(PreAs),与 ASCs 相比,显示出较低的增殖能力和更为专一的脂肪生成状态。最后,一组高表达 F3 的细胞被称为脂肪生成调节细胞(Aregs),因为它们能够调节其他 ASPCs 的分化能力。初步的功能性 hASPCs 亚群特征研究表明,它们与在小鼠中鉴定的亚群有一定的相似性,其中 DPP4+ ASPCs 具有较高的增殖性和较低的脂肪生成性,而 ICAM1+ ASPCs 则相反。这些发现表明小鼠和人类的 ASPCs 可能共享相似的群体。然而,到目前为止,还没有在多个人体脂肪库中系统地进行 hASPC 异质性和行为的功能性特征研究。
在此,我们对来自四个主要人体脂肪库的 30 多位人类供体的 SVF 依附细胞的基因表达谱进行了全面概述:SC、肾周围(PR)、OM 和结肠系膜(MC,即与结肠相关的系膜脂肪)AT,结合了约 34,000 个非免疫(CD45-)和非内皮(CD31-)SVF 细胞的 scRNA-seq 数据(SVF/Lin-)。我们分析了在不同脂肪库中共同和不同的主要 hASPC 亚群及其转录和功能特征。此外,我们建立了一种分选策略,以分离、量化和特征化 SC、OM 和 PR 脂肪库中不同的细胞亚群,评估它们的脂肪生成潜力和增殖能力。最后,我们鉴定了一种新的 OM 特异性细胞群,该群抑制 hASPC 的脂肪生成分化,并通过发现推测的表达胰岛素样生长因子结合蛋白(IGFBP2)的(IGFBP2+)细胞丰度与 BMI 之间的显著相关性,暗示了其生物医学相关性。
结果¶
人类 SVF 细胞在其体外脂肪生成潜力和转录组上表现出脂肪库依赖性差异¶
为了功能性表征不同人体脂肪库中的基质细胞,包括 hASPCs,我们从 SC(20 位供体)、PR(8 位供体)、OM(19 位供体)和 MC(4 位供体)AT 中分离了 SVFs。SVF 依附细胞被培养,并在汇合后暴露于脂肪生成混合物 14 天(图 1A;见 STAR 方法)。脂滴(LDs)染色显示,与先前的发现一致,腹膜腔外的 AT(SC 和 PR)细胞形成了成熟的脂肪细胞(图 1B 和 1C)。相反,腹膜内脂肪库(OM 和 MC)的细胞生长缓慢,并在脂肪生成分化条件下几乎不形成 LDs(图 1B、1C 和 S1A-S1C)。有趣的是,新鲜分离的 PR 细胞在体外显示出最高的脂肪生成潜力(图 1B 和 1C)。然而,在更长的时间/传代后,它们的分化水平与 SC 细胞相似(图 S1B)。此外,所有脂肪库的基质细胞在其分化能力上显示出较高的个体间变异(图 1D)。最后,我们评估了实验性脂肪评分(图 1D;见 STAR 方法)与供体的 BMI、年龄和性别等生理参数之间的可能相关性,但除了 PR 细胞在女性和老年人中表现出较低的脂肪生成倾向外,没有发现其他相关性(图 S1D-S1H)。然而,我们队列的人口统计特征可能会偏倚这些观察结果(图 S1D;表 S1 和 S2),因为样本供体主要是年轻和肥胖的人,并且仅分析了相对较小比例的 PR 样本(n = 8)。
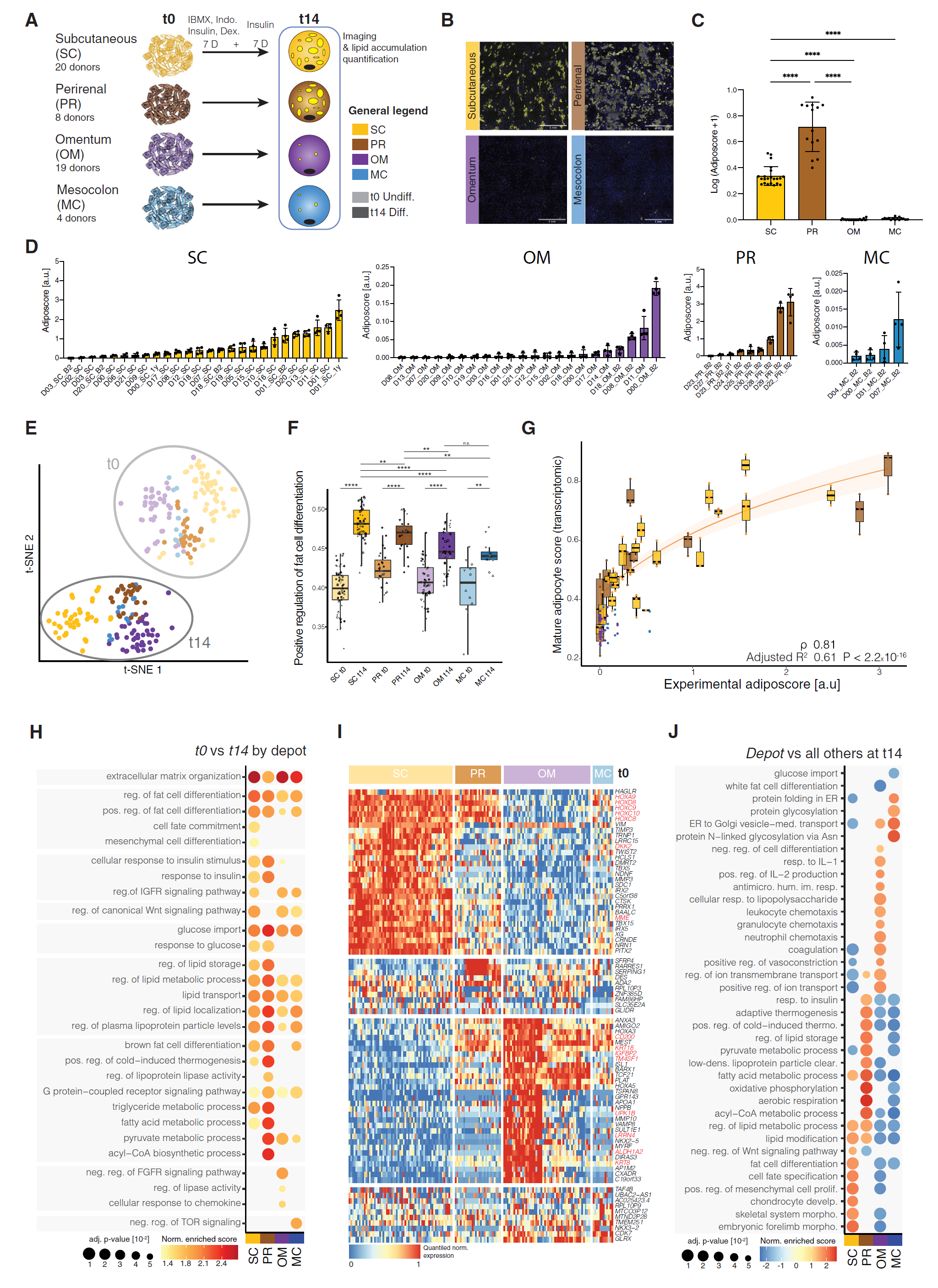
图 1 人类 SVF 细胞在其脂肪生成潜力和转录组上表现出脂肪库依赖性差异
(A)实验设置方案。从四个人体脂肪库中采集的 SVF 依附细胞在分化前或分化后 14 天用于转录组和成像分析。 (B)分化后 SVF 依附细胞的代表性荧光显微镜图像;黄色为脂质,蓝色为 DNA。比例尺,1 μm。 (C)(B) 中 SVF 依附细胞的脂肪评分;n = 14-22,4-5 位供体,3-5 个独立孔。 (D)供体和脂肪库的脂肪评分分布;皮下(SC),20 位供体(D);肾周围(PR),8 位供体;网膜(OM),18 位供体;结肠系膜(MC),4 位供体。在所有面板中,B2 表示来自同一供体的生物重复,1 年(1y)表示同一供体在术后 1 年。在所有情况下,评估了每位供体的 4 个独立孔。 (E)基于来自指示的脂肪库(SC,黄色;PR,棕色;OM,紫色;MC,蓝色)和时间点(t0,浅色;t14,深色)的 SVF 依附细胞的转录组数据的 t-SNE 分析;n = 12-61,4-20 个生物重复,每个重复 1-4 个独立重复。 (F)“脂肪细胞分化正调控”的评分,基于 (E) 数据中相应 GO 术语(GO: 0045600)的缩放表达。 (G)(D) 中的基于图像的脂肪评分与同一供体的基于转录组的“成熟脂肪细胞评分”之间的关系。样本按脂肪库(SC,黄色;PR,棕色)和供体分组。Spearman 相关和调整后的 R2(y ~ log(x + 1))值显示在橙色线(95% 置信区间)上。 (H)在 (E) 数据的每个脂肪库 t0 与 t14 样本的基因表达分析结果上通过基因集富集分析(GSEA)找到的富集术语。 (I)比较 (E) 中显示的数据的 t0 时点指示脂肪库与其他三个脂肪库的差异表达基因。 (J)在 (E) 数据的每个脂肪库 t14 与其他脂肪库的基因表达分析上通过 GSEA 找到的富集术语。
∗p ≤ 0.05,∗∗p ≤ 0.01,∗∗∗p ≤ 0.001,∗∗∗∗p ≤ 0.0001,一元 ANOVA 和 Tukey 诚实显著性差异(HSD)事后检验(C),未配对双侧 t 检验(F)。图中所有箱线图显示平均值为深色带,箱体显示第 25 和第 75 百分位数,须表示数据集中的最小值和最大值。所有条形图显示平均值,误差棒显示平均值的标准差。
为了探讨不同脂肪库之间的脂肪生成能力是否反映在其转录组中,我们对来自不同个体和脂肪库的 SVF 依附细胞在未分化状态(t0)和脂肪生成分化 14 天后(t14)的样本进行了批量 RNA seq 和测序(BRB-seq)(SC n = 22,OM n = 16,PR n = 8,MC n = 4)。主要的变异来源是暴露于脂肪生成混合物,然后是细胞的解剖来源(图 1E 和图 S1I-S1M)。所有 t0 样本都高表达 THY1,这是一个众所周知的间充质标记物,除了 OM 样本,其表达较低(图 S1N)。暴露于分化混合物诱导了所有脂肪库中与细胞外重塑、胰岛素反应和脂肪细胞分化正调控相关的基因(图 1F、图 S1O 和 S1P),表明它们可以在一定程度上启动脂肪生成程序。然而,与 OM 和 MC 相比,SC 和 PR 中的脂肪生成相关术语显著富集(图 1F、图 S1O 和 S1P)。此外,PR 和 SC 样本在分化后仅上调了晚期脂肪生成标记(图 S1Q),支持在 OM 和 MC 细胞中观察到的极低 LD 积累。成熟脂肪细胞标记的表达与 LD 积累相关,正如通过图像基于的脂肪评分量化所示(ρ = 0.81,图 1G),显示出个体间变异在转录组水平上的反映。
通路分析显示,PR 和 SC 来源的细胞在分化后在脂质储存和脂肪酸代谢程序中富集(图 1H)。未分化细胞 t0 的转录组比较显示,发育基因如 HOXC8-10、HOXA9 和 HOXD8 在 SC 样本中高表达(图 1I),这与先前的报道一致。这进一步通过与其他脂肪库相比的形态发生和发育相关的多个术语富集得到体现(图 1I 和 1J)。有趣的是,在 t14,SC 样本与其他脂肪库相比也显示出(脂肪)细胞分化相关术语的富集(图 1J)。相反,t14 时 PR 富集的基因与产热和氧化代谢相关(图 1J)。在 t14 的 OM 样本中,我们观察到非脂肪生成基因表达特征,分别显示“分化负调控”和“白色脂肪细胞分化”术语的正向和负向富集(图 1J)。OM 细胞在暴露于脂肪生成混合物前后也表现出显著较高的与炎症反应相关的基因表达(图 1J 和图 S1R)。这可能是由于 OM 样本的人口统计学特征,主要反映了接受减肥手术的肥胖患者(图 S1D;表 S1),这些 OM 脂肪可能表现出炎症迹象。OM 细胞还表现出与血管和上皮/内皮发育相关的基因富集(图 1J 和图 S1S)。最后,MC 富集的基因与内质网应激、蛋白质折叠和运输相关(图 1J)。
总的来说,来自每个脂肪库的培养 SVF 细胞具有特定的基因特征,突出了 AT 的区域特化。此外,脂肪生成潜力通过腹膜外和腹膜内脂肪库来源细胞中促脂肪生成标记的上调或下调反映出来。
人源脂肪来源的基质细胞在单细胞水平上具有高度异质性¶
接下来,我们探讨了脂肪库间的转录组和表型差异是否由细胞异质性驱动。为此,我们对来自 SC(n = 3)、OM(n = 3)、MC(n = 2,来自同一供体)和 PR(n = 3)脂肪样本的 SVF Lin-(即 CD45-/CD31-)细胞进行了 scRNA-seq 分析(共来自 6 位供体)(表 S2),共分析了 34,126 个细胞(平均每个脂肪库约 8,500 个细胞)。我们首先独立分析每个数据集,即每个脂肪库和每个供体,揭示了每个脂肪库内和之间的异质性(图 2A)。我们进行了三次独立分析,以探索所识别的亚群在不同脂肪库和供体之间是否共享分子特征。首先,我们计算了各数据集之间顶级簇标记的重叠(图 S2A)。我们发现,虽然来自同一脂肪库或供体的样本内共享标记的百分比往往最高(图 S2B 和 S2C),但在大多数识别的亚群中,跨脂肪库和供体的重叠平均超过 50%(图 S2A)。使用 scmap 将每个数据集投射到其他数据集上时也证实了这一结果,显示无论脂肪库来源如何,平均超过 75% 的特定群体细胞投射到其他数据集的对应群体(图 S2D)。最后,我们通过将每个数据集视为不同批次并相应校正数据来整合数据。再次,我们在 t-SNE 空间中观察到脂肪库对应群体的出色重叠(图 2B),这一点在聚类分析中进一步证实(图 2C)。我们的结果表明,来自 SC、PR、OM 和 MC 脂肪库的人类脂肪 SVFs 至少包含两种主要的 hASPC 亚群(图 2D 和 2E),我们在另一个未探索的脂肪库中也捕获到了这些亚群,即在一组重度肥胖患者中的胆囊周围脂肪(图 S2E)。
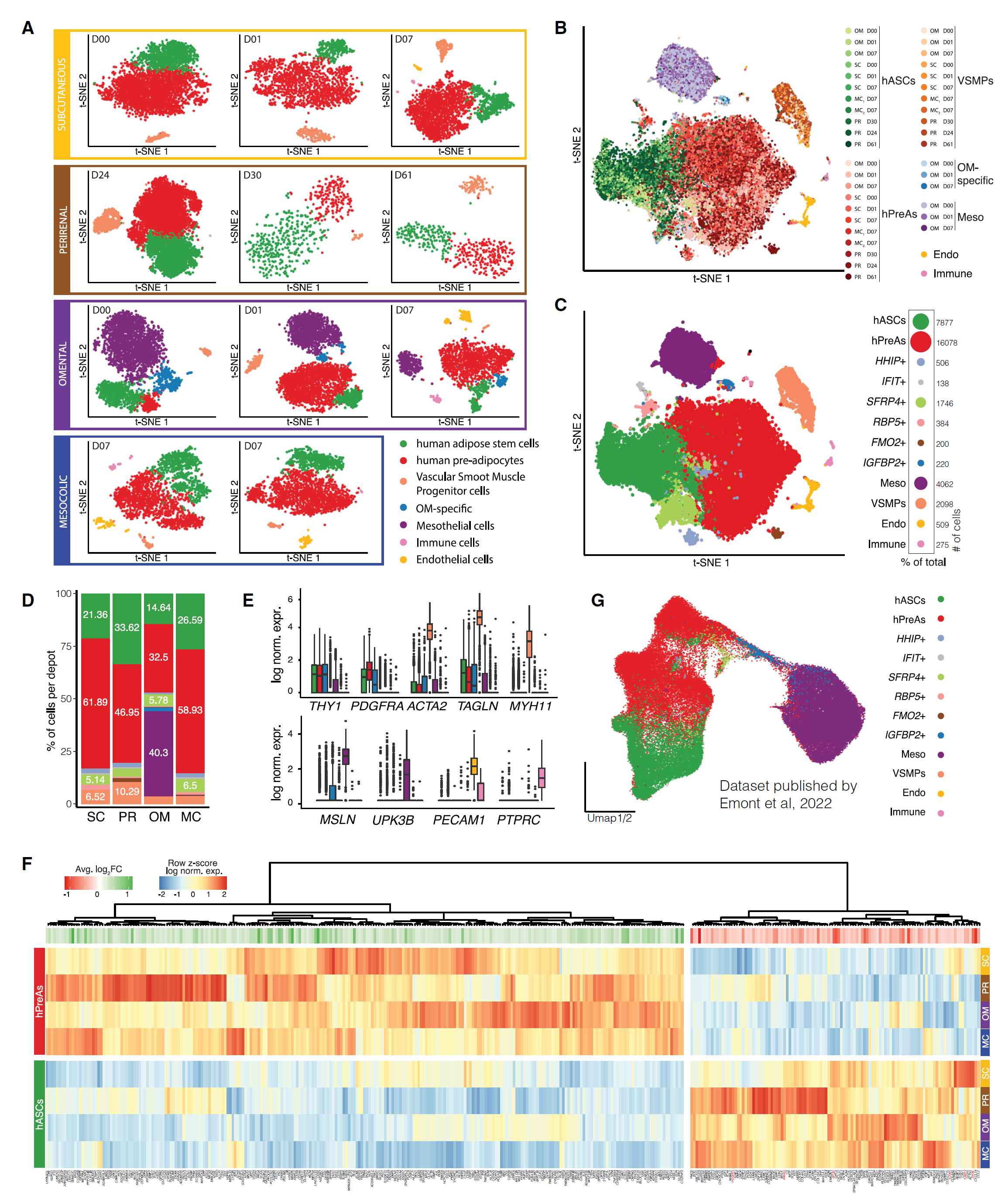
图 2 人类脂肪基质细胞在单细胞水平上具有高度异质性
(A)从 SC、OM、MC 和 PR 脂肪库以及六位不同供体中分离的 SVF Lin−细胞的单细胞 RNA 测序(scRNA-seq)数据集的 t-SNE。标识出的 hASPC 亚群如下所示。每个数据集中的细胞数量从左到右分别为:SC:3,929,4,169,2,162;PR:8,583,600,509;OM:4,262,2,042,2,670;MC:2,650,2,550。 (B)跨四个脂肪库和六位供体(D)的整合 scRNA-seq 数据集的 t-SNE(表 S2;OM,n = 3,SC,n = 3,和 MC,n = 2(相同供体),PR,n = 3,不同供体)。 (C)(B) 中的数据的 t-SNE,按识别的细胞簇着色。属于每个簇的细胞百分比和确切数量显示在右侧。 (D)每个脂肪库中每个簇的细胞百分比(不包括免疫和内皮细胞)。 (E)(C) 中不同亚群中选择标记的对数标准化基因表达。箱线图显示平均值为深色带,箱体显示第 25 和第 75 百分位数,须表示数据集中的最小值和最大值。 (F)基于 (C) 在人类脂肪干细胞(hASC)和前脂肪细胞(hPreA)群体之间的差异表达基因的热图。 (G)从 Emont 等人的 scRNA-seq 数据中的 hASPCs 和人类间皮细胞的 UMAP,通过转移我们的细胞簇注释按细胞类型/状态着色。
根据基因表达特征,我们将这两个 hASPC 亚群标记为 ASCs(hASCs)和 PreAs(hPreAs)(图 2C 和 2F)。所有脂肪库的 hASCs 共享 DPP4、CD55 和 PI16 的基因特征,以及与增殖、胶原合成和干细胞特性相关的基因(图 2F 和图 S2F)。相反,hPreAs 差异表达已承诺的脂肪生成细胞的标记,如 PPARG、FABP4、PDGFRA、APOC 和 APOE,并显示与分化、承诺和脂质转运相关的术语富集(图 2F 和图 S2F)。此外,我们的注释与人类 SC AT 中观察到的 ASPC 状态以及使用独立参考人类图谱预测的 OM AT 状态一致(图 2G 和图 S2G)。
总之,我们发现,在单细胞水平上,两种典型的 hASPC 群体(hASCs 和 hPreAs)主导了 SVF 的转录组景观,并在每个分析的脂肪库中都存在。据我们所知,这些 hASPC 状态从未在超出 SC 和 OM 的人体解剖位置中描述过。
在脂肪库中存在共同和独特的基质群体¶
除了 hASCs 和 hPreAs,我们还鉴定出五个其他脂肪库普遍存在的簇(血管平滑肌前体 [VSMP] 细胞,以及 HHIP+、IFIT+、SFRP4+ 和 RBP5+ 细胞群体),还有一个 PR 和 MC 特异性(FMO2+)和两个 OM 特异性(间皮和 IGFBP2+)簇(图 2C 和 2D)。
VSMP 群体基于肌肉相关标记的表达鉴定,如 MYH11、ACTA2 和 TAGLN(图 2E 和图 3A),类似于之前描述的特征。
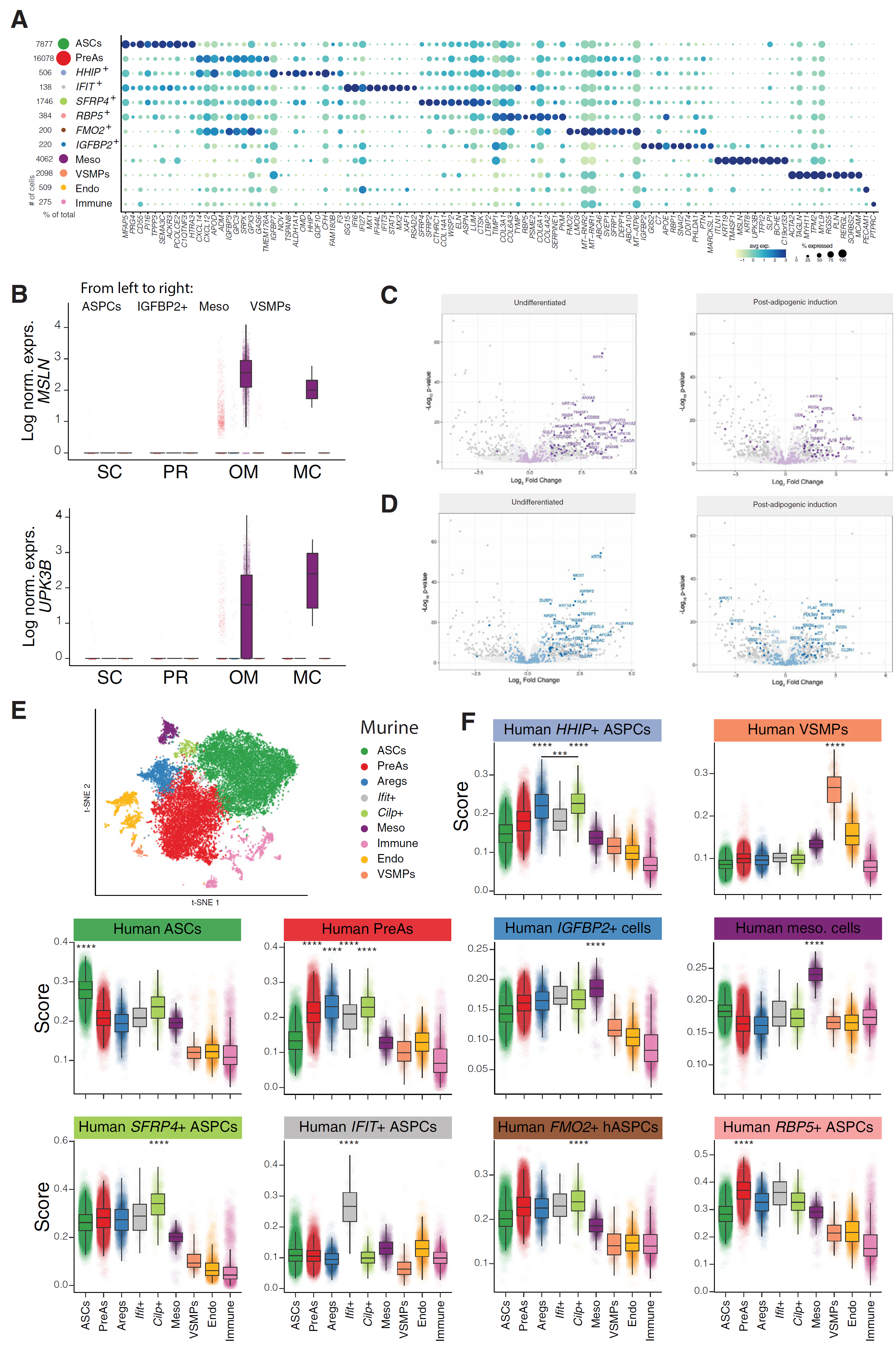
图 3 脂肪库中存在共同和独特的基质群体
(A)图 2C 中每个簇的 10 个差异表达标记的点图。 (B)MSLN(顶部)和 UPK3B(底部)在 hASPCs 中的对数标准化表达,按脂肪库来源分组。箱线图显示平均值为深色带,箱体显示第 25 和第 75 百分位数,须表示数据集中的最小值和最大值。 (C)火山图显示 OM 与 SC、PR 和 MC 的 SVF 依附细胞的差异基因表达。使用 scRNA-seq 数据集鉴定的顶级间皮标记为深紫色,而差异表达基因(log2FC > 1,调整后的 p 值 < 0.01)为浅紫色。左图:未诱导细胞,右图:分化细胞。 (D)火山图显示 OM 与其他脂肪库(SC、PR 和 MC)的扩展 SVF 依附细胞的差异基因表达。使用 scRNA-seq 数据集鉴定的顶级 IGFBP2+ 细胞标记为深蓝色,而差异表达基因(log2FC > 1,调整后的 p 值 < 0.01)为浅蓝色。左图:未诱导细胞,右图:分化细胞。 (E)整合 scRNA-seq 数据集的 t-SNE4,7,11,显示了小鼠内脏和皮下脂肪库中鉴定的簇。 (F)箱线图——设计与(B)相同——显示在图 2C 中识别的每个人类细胞群体在小鼠细胞群体中的每个对应小鼠标记的得分,定义如 Ferrero 等人所述。
HHIP+ 簇显示出几个小鼠基质亚群的同源标记(F3、CLEC11A、GDF10、MGP 和 INMT),这些亚群我们之前已表征为 Aregs(图 3A 和图 S3A),在转录组上类似于已发表的人类 AT 图谱中的 EPHA3+ 簇。在我们的数据集中,EPHA3 特异性地在 HHIP+ 细胞中表达(图 S3A)。此外,通过将我们的注释转移到已发表的图谱上,我们确认 EPHA3+ 群体对我们的 HHIP+ 群体的预测评分显著高于其他 hASPCs(图 S3B)。最后,鉴于 HHIP 编码的是一个表面标记,我们能够通过流式细胞术确认在 SC AT 中存在人类 SVF Lin−/HHIP+ 细胞群体(图 S3C 和 S3D)。
另一个基质群体,IFIT+ 簇,存在于每个脂肪库和供体中,其特征是干扰素相关基因(如 IFIT3、IFI6 和 IFI27)的特异性表达(图 3A 和图 S3E),反映了病毒免疫反应(图 S3F)。虽然在小鼠 OM 中报道了一种间皮 Ifit+ 群体,我们的 IFIT+ 群体不表达间皮标记,而是表达间充质标记(图 3A 和图 S3G)。
SFRP4+ 簇的特征是高表达分泌的卷曲相关蛋白 2 和 4(SFRP2 和 SFRP4)(图 3A 和图 S3H),与已发表的人类 AT 图谱中的一个亚群对齐。虽然所有脂肪库中都存在 SFRP4+ hASPCs,但我们观察到 OM 脂肪库中的 hASPCs 中 SFRP2 的表达更高,而不是 SFRP4(图 S3J 和 S3K)。
我们还发现了三个特定脂肪库的细胞簇:FMO2+ hASPCs 特异于 PR 和 MC,而 IGFBP2+ 和间皮细胞主要特异于 OM AT,尽管在 MC 中也检测到少量细胞(图 2C、2D 和 3B),这可能是因为 MC 也被腹膜覆盖。间皮细胞的特征是表达 MSLN、UP3KB、LRRN4 和角蛋白相关基因(图 3A-3C),在 OM AT 中构成了丰富的细胞类型(图 2A 和 2D),与在批量转录组学中观察到的角蛋白相关基因表达增加一致。同样,IGFBP2+ 细胞标记,包括 IGFBP2,但也包括其他如 APOE 和 C7(图 3A 和 3C),在 OM 样本中相对于其他脂肪库富集。将我们的注释投射到已发表的人类 AT 图谱上,验证了在独立数据集中存在类似的细胞群体(图 2G 和图 S2G)。
最后,我们系统地将每个簇的表达评分映射到我们之前在小鼠中识别的簇上(图 3E 和 3F),发现拟议的命名法之间高度一致。通过反转分析并将小鼠簇的表达评分映射到人类整合数据集上(图 S3L),进一步支持了这一点。
总之,我们对人类 AT 来源基质细胞的跨解剖学分析在单细胞水平上揭示了在所有分析的脂肪库中存在的五个群体:两个典型的 hASPC 亚群(hASCs 和 hPreAs)、VSMPs 和三个较少丰富的基质群体:HHIP+、IFIT+ 和 SFRP4+ 细胞。OM SVF 中特有的是高度丰富的间皮细胞群体和较少丰富的 IGFBP2+ 细胞簇。此外,我们发现人类和小鼠之间的 scRNA-seq 簇高度一致。
SVF Lin−亚群的分离和表型表征¶
接下来,我们旨在功能性表征跨脂肪库的细胞亚群。首先,我们关注两个主要群体:hASCs 和 hPreAs(图 2C)。基于我们的 scRNA-seq 表达数据,我们开发了一种分选策略(图 4A 和 4B),其中 hASCs 被分离为 Lin−/TM4SF1−/CD26+(以下简称 CD26+),由于 DPP4(编码 CD26)的特异性表达(图 S4A)。对跨膜 4 L6 家族成员 1(TM4SF1)的选择旨在耗尽 hASPCs 中的间皮细胞和 IGFBP2+ 细胞,这些细胞主要存在于 OM AT 中(图 S4A-S4C)。为了分离 hPreAs,我们关注差异表达的 hPreA 标记,如 GPC3(图 2F),但测试的抗体在流式细胞术中表现不佳(数据未显示)。因此,我们将 hPreAs 分离为 Lin−/TM4SF1−/VAP1+(简称 VAP1+),基于在 hPreA 群体中高度表达的血管粘附蛋白 1(VAP1),由 AOC3 基因编码(图 S4A)。然而,这种策略有一个缺点,即 VAP1 在 VSMPs 中也高度表达,并且一些 hPreAs 群体不表达 VAP1(图 S4A 和 S4B)。因此,我们实施了一个额外的分选层,旨在富集不表达 CD26 或 VAP1 的 hPreAs(Lin−/TM4SF1−/CD26−/VAP1−,标记为双阴性(DN)细胞)。
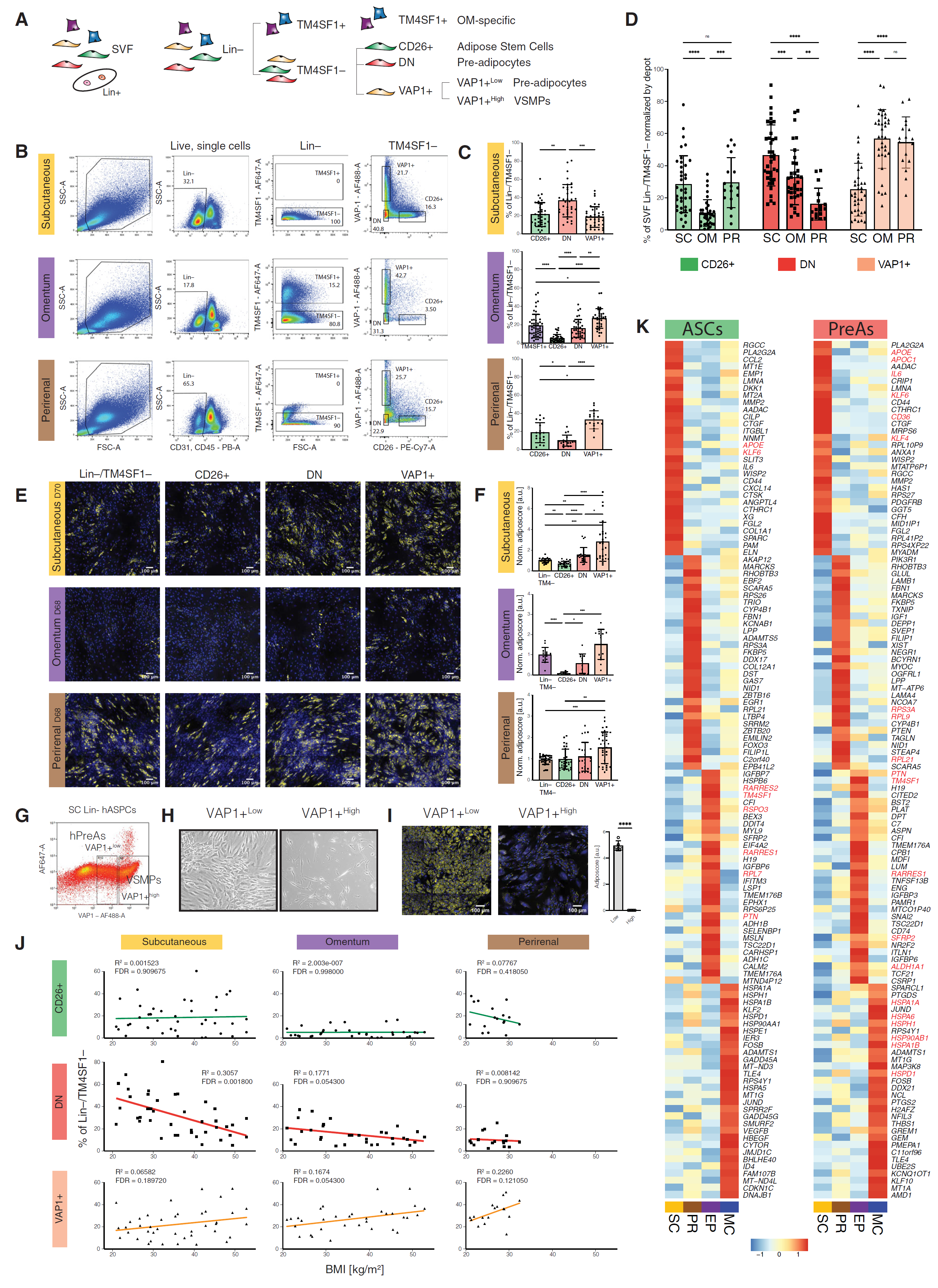
图 4 探索 hASCs、hPreAs 和 VSMPs 之间的表型差异
(A)用于富集不同 hASPC 亚群和 OM 特异性细胞的分选策略。 (B)流式细胞术分析图谱和门控策略,用于从同一供体的 SC、OM 和 PR SVFs 中分离 SVF Lin−/TM4SF1−细胞。 (C)从 SVF 细胞的 Lin−/TM4SF1−部分门控的每个细胞亚群的丰度;SC n = 37,OM n = 35,PR n = 17 位供体。 (D)各脂肪库中指示的 SVF 群体的相对比例;SC n = 37,OM n = 35,PR n = 17 位供体。 (E)来自每个脂肪库的 SVF Lin−/TM4SF1−、CD26+、DN 和 VAP1+ 群体在脂肪生成分化后的代表性荧光显微镜图像;黄色为脂质,蓝色为 DNA;比例尺,100 μm。 (F)从荧光显微镜图像(如 E)中量化的脂肪评分。值标准化为 Lin−/TM4SF1−群体的平均脂肪评分;n = 12–21,3–7 位供体,每个供体 1–4 个独立孔。 (G)SC Lin−细胞的流式细胞术图谱,显示门控策略以分离 VAP1+low hPreAs 和 VAP1+high VSMPs;n = 3。 (H)正在扩展的 VAP1+low hPreAs 和 VAP1+high VSMPs 的明场显微镜图像。 (I)代表性荧光显微镜图像显示分化后的 VAP1+low hPreAs 和 VAP1+high VSMPs,并量化脂肪评分,n = 5,3 位供体,每位供体 1–2 个孔。 (J)各供体中每个指示的 SVF 群体的% Lin−/TM4SF1−细胞与 BMI 之间的相关性。 (K)与所有其他脂肪库相比,在指示脂肪库中高表达的前 30 个基因的热图,聚焦于 hASCs(左)或 hPreAs(右)。按行缩放的平均对数标准化表达。 ∗p ≤ 0.05,∗∗p ≤ 0.01,∗∗∗p ≤ 0.001,∗∗∗∗p ≤ 0.0001,一元 ANOVA 和 Tukey HSD 事后检验(C,D,F 和 I),以及线性回归分析及其相对拟合优度和 Pearson 相关的错误发现率(FDR)调整 p 值(G)。所有条形图显示平均值,误差棒显示平均值的标准差。
使用这种分选策略,我们分析了 37 位人类供体的 SVF Lin−部分的谱系(表 S1;图 4C)。我们发现,与 PR 和 SC ATs 相比,CD26+ 池在 OM AT 中较少,而 SC AT 以 DN 细胞为主,OM 和 PR 以 VAP1+ 细胞为主(图 4D)。在两位供体的 MC AT 中也检测到了相同的三种群体,其比例类似于 OM AT(图 S4D 和 S4E)。与我们的转录组学发现一致,只有 OM 来源的 SVF 显示出明确的 TM4SF1 阳性群体(图 4B、4C 和 S4F),尽管在 MC SVF Lin−中也检测到少量 TM4SF1+ 细胞(图 S4F)。
确认这些亚群的存在后,我们接下来旨在研究它们在体外的表型行为。单独分选时,CD26+ 群体比所有其他群体增殖得更快,无论其脂肪库来源(图 S4G)。CD26+ 细胞在脂肪生成潜力方面得分最低(图 4E 和 4F),支持它们位于脂肪生成谱系的根部。VAP1+ 细胞的脂肪生成潜力最高,其次是 DN 细胞(图 4E 和 4F)。然而,如上所述,VAP1+ 细胞可能包括 hPreAs 和 VSMPs。因此,我们旨在澄清哪些群体是这种高脂肪生成潜力的原因。由于在 scRNA-seq 数据中 AOC3 在 VSMPs 中的表达高于 PreAs(图 S4A),我们将 VAP1+ 群体分层为具有中度(VAP1+low;排除约 20% 最高阳性细胞)或高 VAP1 表达(VAP1+high;约 15% 最高阳性细胞)的细胞(图 4G)。铺板后,VAP1+high 细胞采用了 VSMPs 特有的长纺锤形状(图 4H)并未能分化为脂肪细胞(图 4I)。相反,VAP1+low 细胞表现出典型的间充质外观和显著的脂肪生成分化能力(图 4H 和 4I),与作为 hPreA 富集分数一致。因此,VAP1+ 分数的高脂肪生成能力可能由 VAP1+low/hPreAs 驱动,而不是 VAP1+high/VSMPs。
接下来,我们调查了每个 SVF Lin−亚群的相对丰度与供体的元数据(如 BMI、年龄和性别)之间的潜在相关性。令人感兴趣的是,我们发现尽管 CD26+ 细胞的比例不受 BMI 影响,后者似乎与 DN 细胞的耗竭相关。这种负相关性在 SC 中特别高,但在 OM AT 中也存在,并伴随 VAP1+ 细胞比例的略微增加(图 4J)。相反,供体的年龄或性别似乎并不影响任何分析的脂肪库中 SVF Lin−池内的细胞群体平衡(数据未显示)。
所有三种 OM 群体在脂肪生成能力方面均显著低于等效的 SC 和 PR 细胞(图 4E)。为了确定细胞内在特征是否可以解释不同的脂肪生成潜力,我们在我们的 scRNA-seq 数据集中探索了这些亚群的脂肪库特异性转录组特征。我们注意到,跨脂肪库,hASC 细胞的转录组比 hPreA 更相似(图 2F 和 S4H),支持了在承诺过程中积累的脂肪库特异性特征的假设。然后,我们确定了 hASCs 或 hPreAs 中以脂肪库特异性方式富集的基因(图 4K)。与其高脂肪生成潜力一致,来自 SC 和 PR 脂肪库的 hASCs 和 hPreAs 显示出显著更高的已知脂肪生成基因和转录因子的表达,如 KLF4、KLF6、WISP2、APOE、APOC1 和 CD36(图 S4I)。例如,PIK3R1 是 PR 中相对于其他脂肪库上调最多的基因,磷脂酰肌醇 3- 激酶(PI3K)信号在人体间充质干细胞的脂肪生成中起着关键作用。对于显示有限脂肪生成潜力的群体,MC 细胞过表达与未折叠蛋白或蛋白质折叠相关的基因(图 S4I),如热休克蛋白(HSPs)(图 4K),这是一大类分子伴侣。HSPs 被报道与过氧化物酶增殖物激活受体γ(PPARγ)相互作用,要么稳定它并增强脂肪生成(Hsp90),要么使其不稳定并抑制脂肪生成(Hsp20)。相反,OM 细胞再次显示出与炎症反应相关的基因富集(图 S4I),以及一些先前描述的对脂肪生成产生负面影响的标记(RARRES2、RSPO3、RPL7、PTN、GAL、ALDH1A1 和 IGFBP3;图 4K)。
总之,我们表明 hASPC 小生境根据解剖来源拥有不同的亚群丰度,其平衡随 BMI 的增加而改变。此外,即使在所有脂肪库中普遍存在,hASCs 和 hPreAs 显示出脂肪库特异性基因特征,似乎是在承诺过程中获得的。
OM 特异性细胞抑制网膜和皮下 hASPCs 的脂肪生成¶
我们接下来想知道 OM 特异性细胞群体(例如间皮细胞和 IGFBP2+ 细胞;图 5A)的存在是否会影响该脂肪库的 SVF 细胞的脂肪生成能力,因为这些独特的亚群表达了一些先前与网膜 SVF 细胞的脂肪生成障碍相关的基因(例如,CD200、WT1 和 ALDH1A2)。
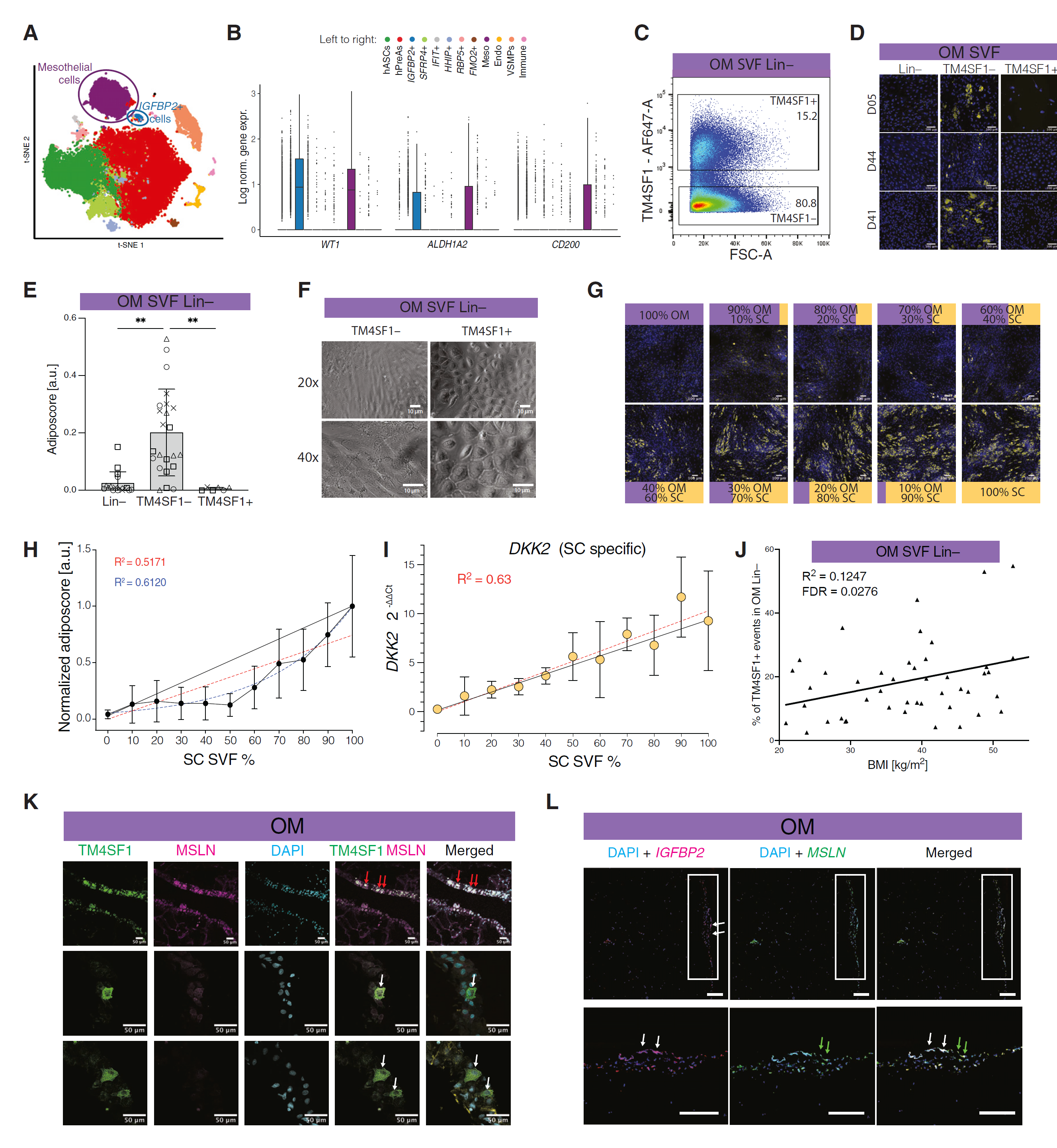
图 5 OM 特异性细胞抑制 hASPCs 的脂肪生成
(A)整合 scRNA-seq 数据集的 t-SNE 图,突出显示间皮细胞和 IGFBP2+ 群体。 (B)基于(A)中的 scRNA-seq 数据,在指示的细胞群体中的 WT1、ALDH1A2 和 CD200 的对数标准化表达。箱线图显示平均值为深色带,箱体显示第 25 和第 75 百分位数,须表示数据集中最小值和最大值的数据点。 (C)流式细胞术门控策略,用于分选 OM SVF Lin−特异性亚群为 Lin−/TM4SF1+ 和 Lin−/TM4SF1−细胞。 (D)分化后 OM SVF Lin−、Lin−/TM4SF1−和 Lin−/TM4SF1+ 细胞的代表性荧光显微镜图像。 (E)(D) 中显示的细胞群体的脂肪评分量化;n = 6–23,4 位供体,每个供体 1–6 个独立孔。条形图显示平均值和平均值的标准差作为误差棒。 (F)纺锤状 OM hASPCs(Lin−/TM4SF1−)和卵石状 TM4SF1+ 群体的明场显微镜图像。 (G)混合实验中 14 天分化后的 SVF Lin−细胞的代表性荧光显微镜图像。OM 和 SC 脂肪组织(ATs)的 SVF Lin−细胞在分离后按指示比例混合。 (H)(G) 中显示的不同混合 OM 和 SC SVF Lin−细胞群体的脂肪评分量化。值标准化为 100% SC Lin−条件的脂肪评分。误差棒表示平均值的标准差;相应的线性和指数回归及其 R2 系数分别以红色和蓝色显示。黑线表示 0% 至 100% SC SVF Lin−细胞之间线性稀释的脂肪生成预期增加;n = 16,4 个生物学重复,每个供体 4 个独立孔。 (I)DKK2(一个 SC 特异基因)的基因表达水平,按 HPRT1 表达和 0% SC 标准化以控制混合比例的正确性(G)。误差棒表示平均值的标准差。线性回归及其 R2 系数值以红色显示;黑线将最低值连接到最高值;n = 4,2 个生物学重复,每个供体 2 个独立孔。 (J)基于流式细胞术分析的 OM SVF/Lin−/TM4SF1+ 部分与供体 BMI 之间的相关性;线表示线性回归分析及其相对拟合优度;p 值通过进行 Pearson 相关计算。 (K)基于免疫组织化学的 TM4SF1+(绿色)和 MSLN+(粉色)细胞在 OM AT 中的定位。箭头指示 AT 小叶周围的 TM4SF1+/MSLN−细胞(白色)和 TM4SF1+/MSLN+ 细胞(红色)。比例尺,50 μm。 (L)RNAScope 原位定位 IGFBP2+(粉色)和 MSLN+(绿色)细胞在 OM AT 中的分布。箭头指示 AT 小叶周围的 IGFBP2+/MSLN+ 细胞(白色)和 IGFBP2−/MSLN+ 细胞(绿色)。比例尺,200 μm。 对于(D)和(G):黄色为脂质;蓝色为 DNA;比例尺,100 μm。对于(K)和(L):青色为 DNA。
我们使用 TM4SF1 作为两个 OM 特异性群体的表面标记(图 S4C),研究了带或不带 TM4SF1+ 细胞的 OM hASPCs 的脂肪生成潜力(图 5C)。我们确认,OM Lin−/TM4SF1−细胞(现称为 OM hASPCs)显著比总 OM Lin−部分更具脂肪生成性(图 5D 和 5E)。相比之下,OM Lin−/TM4SF1+ 细胞(TM4SF1+)未积累脂质滴(LDs),并显示出间皮细胞特有的圆形卵石状形态(图 5D-5F)。重要的是,与总 Lin−部分相比,OM hASPCs 细胞的分化增加大于预期的 TM4SF1+ 细胞的比例移除(约占总 Lin−部分的 20%,图 4C)。这表明 TM4SF1+ 细胞可能抑制 OM hASPCs 的脂肪生成能力。
为了评估 OM 特异性细胞对分化的抑制作用,我们将典型的高脂肪生成性 SC 或 PR Lin−细胞与逐渐增加比例的 OM Lin−细胞共同培养(图 5G 和 5H 用于 SC,图 S5A 和 S5B 用于 PR)。共同培养的脂肪生成潜力并非与 OM 与 SC Lin−细胞的比例成线性关系(图 5H)。然而,DKK2 的表达(一个 SC 特异性标记,图 S5C)随着 SC 细胞比例的增加而线性增加,排除了 SC 细胞被 OM 细胞过度生长的可能性(图 5I)。将 OM Lin−细胞与 PR Lin−细胞混合显示没有明显的调节效应,正如通过分化增加与 PR 细胞比例之间的相对线性关系所证明的(图 S5A 和 S5B)。因此,我们的研究结果表明,OM TM4SF1+ 细胞降低了邻近细胞的脂肪生成能力,并且对此抑制的敏感性是脂肪库特异性的。这表明 OM TM4SF1+ 细胞可能在 OM AT 的扩展中起到一定作用。有趣的是,OM TM4SF1+ 细胞在总 SVF Lin−细胞池中的相对比例与供体的 BMI 呈正相关(图 5J)。
基于我们的 scRNA-seq 数据,TM4SF1+ OM 特异性细胞可以进一步分层为两种群体:经典的间皮细胞和 IGFBP2+ 簇(图 5A)。为了单独研究这些群体,我们使用 TM4SF1 作为标记物来富集两种 OM 特异性群体,并添加间皮素(MSLN)作为经典标记物来专门富集间皮细胞,因为 MSLN 在间皮细胞中的表达高于 IGFBP2+ 细胞(图 S4A 和 S4C)。因此,我们将间皮细胞定义为 TM4SF1+/MSLNhigh,而 IGFBP2+ 细胞定义为 TM4SF1+/MSLNlow。为了验证这两种群体在体内的存在,我们首先使用针对 MSLN 和 TM4SF1 的抗体进行免疫组织化学分析,两者均高度染色 AT 小叶的边界(图 S5D),揭示了围绕 OM 的间皮单层腹膜结构。大多数阳性染色细胞对这两个标记物的染色强度相同(图 5K 和图 S5D,红色箭头)。然而,一些细胞在 TM4SF1 通道中的染色强度明显高于 MSLN 通道(图 5K 和图 S5D,白色箭头),类似于 IGFBP2+ 细胞的基因表达特征。我们接下来旨在更直接地可视化 IGFBP2+ 细胞,但由于 IGFBP2 是一种分泌蛋白,免疫组织化学可能不适合。因此,我们采用了 RNAScope 技术进行原位杂交。与组织学和 scRNA-seq 数据一致,大多数 IGFBP2 阳性细胞在某种程度上共表达 MSLN(图 5L,白色箭头)。然而,大多数 MSLN 阳性细胞不表达 IGFBP2(图 5L,绿色箭头)。因此,scRNA-seq、免疫组织化学和 RNAScope 数据表明,经典的间皮细胞可以与 IGFBP2+ 簇区分开来,尽管 IGFBP2+ 细胞仍然残留表达 MSLN。
网膜 IGFBP2+ 基质细胞在间皮和间充质状态之间转换¶
我们的 scRNA-seq 数据集揭示了 IGFBP2+ 簇具有有趣的双重基因表达特征,既共享 hASPCs 和间皮细胞的标记物(图 6A)。重要的是,IGFBP2+ 细胞没有显示出较大的文库大小或捕获的特征数量(图 S6A),减少了这些细胞为双细胞的可能性。此外,这些细胞表达特定标记物,如 IGFBP2、RBP1、WNT4 或 WNT6,并且表达水平高于单独的 hASPCs 或间皮细胞(图 6B),这在技术上对于随机共同包封的细胞是不可能的。当将我们的细胞注释转移到已发表的人类 SC 和 OM AT 单细胞图谱时,我们发现只有 OM 的细胞对 IGFBP2+ 细胞有阳性预测评分(图 S6B)。此外,预测为 IGFBP2+ 细胞的细胞与在 AT 单细胞 RNA-seq 图谱中独立识别的簇对齐(图 S2G 和 S6C-S6E),并显示出 IGFBP2+ 细胞标记物的富集(图 S6E)。有趣的是,这一群体的丰度(相对于 hASPCs 和间皮细胞)与供体的 BMI 相关(ρ = 0.95,图 S6F)。除了表达自己的特定标记物(图 S6G 和 S6H),预测的细胞还共表达间皮和 hASPC 标记物(图 S6I),并沿着两种细胞类型之间的“桥梁”排列。这种基因表达的双重性可能反映了细胞从一种细胞类型向另一种细胞类型转变。为了计算机测试这一假设,我们对聚合的 OM scRNA-seq 数据集进行轨迹推断,使用基于划分的图抽象(PAGA)。推断的图预测了通过 IGFBP2+ 细胞将 OM hASPCs 连接到间皮细胞的分支(图 6C 和 6D)。作为图结构有效性的正负对照,hASCs 和 hPreAs 通过一个稳健的分支连接,而 VSMPs 没有连接到主轨迹。当按假时间排序细胞,从 hASCs 到间皮细胞的轨迹起点(图 6E),我们观察到连接分支上 hASPC 和间皮细胞标记物的逐渐减少和增加(图 6F),以及 IGFBP2+ 细胞标记物的上调(图 6G)。总之,这些结果表明,IGFBP2+ 细胞可能代表在间皮和间充质细胞类型之间转变的细胞。因此,我们发现基因本体(GO)术语“上皮到间充质转化”(EMT)在 IGFBP2+ 细胞中富集,以及 Wnt 家族基因、基质金属蛋白酶(MMPs)、锌指 E 框结合(ZEB)转录因子和其他先前与 EMT 相关的基因表达较高。转化生长因子β(TGF-β)信号也被描述为与伤口愈合和纤维化相关的 EMT 的主要调节因子。与此一致,我们发现 IGFBP2+ 细胞在与“响应 TGF-β”相关的表达上富集。其他与 EMT 相关的 GO 术语,如血管生成、缺氧、炎症反应、细胞周期标记和粘附分子下调,均在 IGFBP2+ 细胞标记物中显著富集。因此,我们的研究结果表明,可能存在在间皮和间充质细胞类型之间转变的细胞。
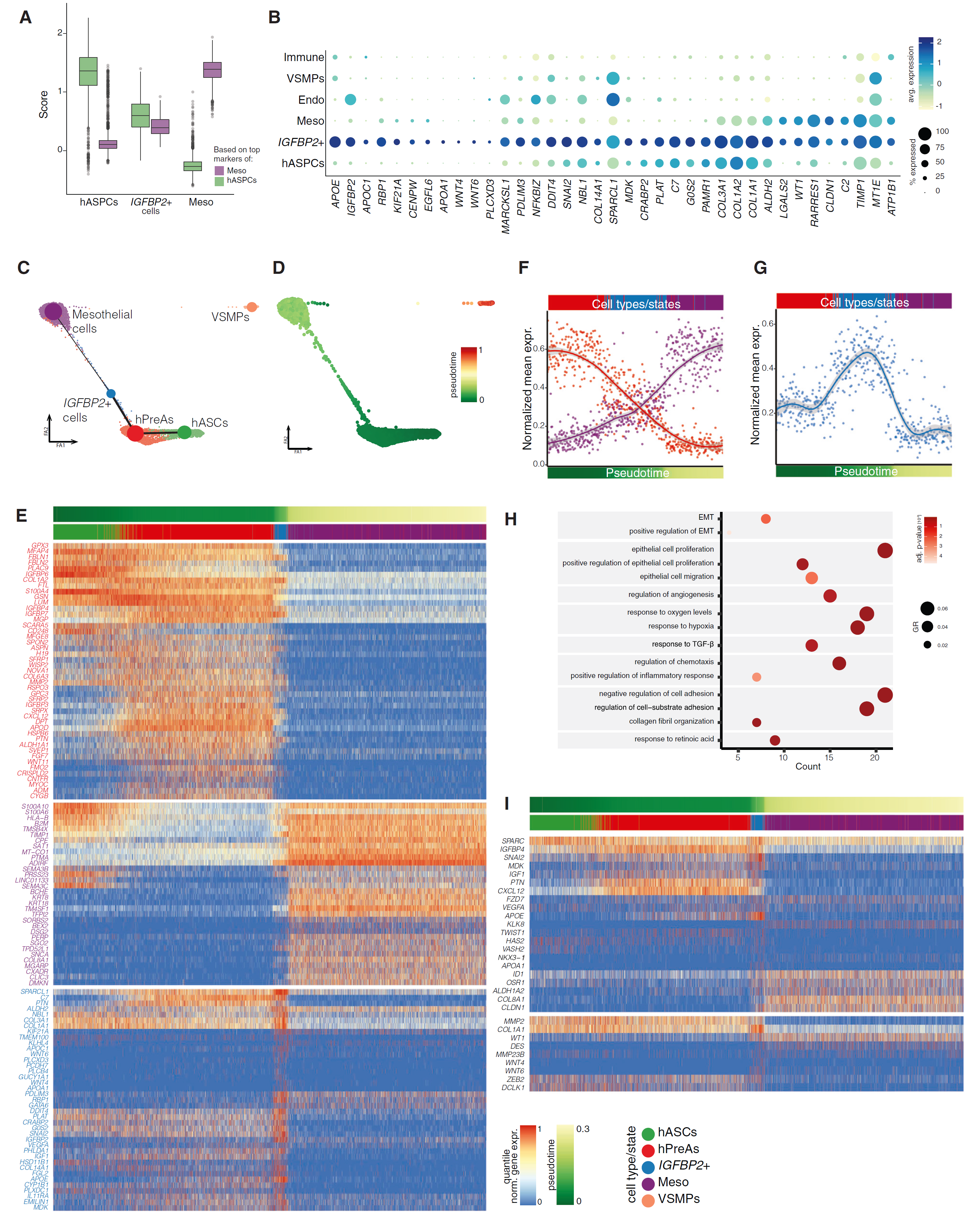
图 6 IGFBP2+ 细胞可能在间皮和间充质状态之间转变
(A)基于顶级间皮标记或 hASPC 标记在 OM hASPCs、IGFBP2+ 细胞和间皮细胞中的得分分布。箱线图显示平均值为深色带,箱体显示第 25 和第 75 百分位数,须表示数据集中最小值和最大值的数据点。 (B)图 2C 中各簇的顶级 IGFBP2+ 细胞标记的平均表达和表达细胞的百分比。 (C)叠加在 ForceAtlas2 布局上的 PAGA 推断轨迹。点的大小与簇中的细胞数量成正比,线的粗细与轨迹关系的置信度成正比。 (D)(C) 中描述的 PAGA 推断轨迹,按推断的伪时间着色(从 hASCs 开始)。 (E)沿 (D) 中显示的轨迹计算的伪时间的基因表达变化热图。红色:从 hASPCs 到间皮细胞减少的基因;紫色:从 hASPCs 到间皮细胞增加的基因;蓝色:特定于 IGFBP2+ 细胞的基因;按行缩放的对数标准化基因表达(分位数标准化)。 (F)(E) 中红色或紫色基因表达在伪时间沿线每个细胞的分位数标准化基因表达的平均值。图表重点关注 hPreAs(红色)和间皮细胞(紫色)之间的转变,经过 IGFBP2+ 细胞(蓝色)。显示了局部估计散点图(LOESS)平滑和 95% 置信区间。 (G)如 (F),但针对蓝色高亮的基因表达,重点关注 hPreAs(红色)和间皮细胞之间的转变,经过 IGFBP2+ 细胞(蓝色)。 (H)基于 IGFBP2+ 细胞标记富集的关键 GO 术语的点图。 (I)(D) 中显示的轨迹伪时间沿线 EMT 相关基因的基因表达变化(顶部:执行 GO 富集分析时富集的基因,底部:文献中找到的其他 EMT 相关基因)。
网膜 IGFBP2+ 基质细胞通过 IGFBP2 抑制脂肪生成¶
为了基于其基因表达特征(图 S2C)分离和功能表征 IGFBP2+ 细胞,除了间皮细胞之外,我们使用荧光激活细胞分选(FACS)进一步基于 MSLN 信号分离 Lin−/TM4SF1+ 群体。因此,将间皮细胞(Lin−/TM4SF1+/MSLNhigh)与低 MSLN 表达的 IGFBP2+ 细胞(Lin−/TM4SF1+/MSLNlow)分离开来。此外,剩余的 OM hASPCs 可以收集为 Lin−/TM4SF1−部分(图 7A 和图 S7A)。这种分选策略通过 Lin−/TM4SF1+/MSLNlow 细胞中比 OM hASPCs(Lin−/TM4SF1−)和 SC SVF Lin−细胞更高的 IGFBP2 表达得到了验证(图 7B)。有趣的是,汇合的 Lin−/TM4SF1+/MSLNlow 细胞显示出经典的间皮卵石样形态;然而,在扩展时,它们倾向于采用纺锤状形态,类似于间充质细胞(图 S7B),支持其潜在的转换状态。与 IGFBP2 作为分泌因子一致,OM Lin−/TM4SF1+/MSLNlow 细胞培养上清液中 IGFBP2 的浓度显著高于 Lin−/TM4SF1+/MSLNhigh 细胞或 OM、SC 或 PR hASPCs 的培养上清液(图 7C)。我们还确认了 IGFBP2 由体外孵育的 OM AT 分泌,并随时间线性增加(图 7D)。
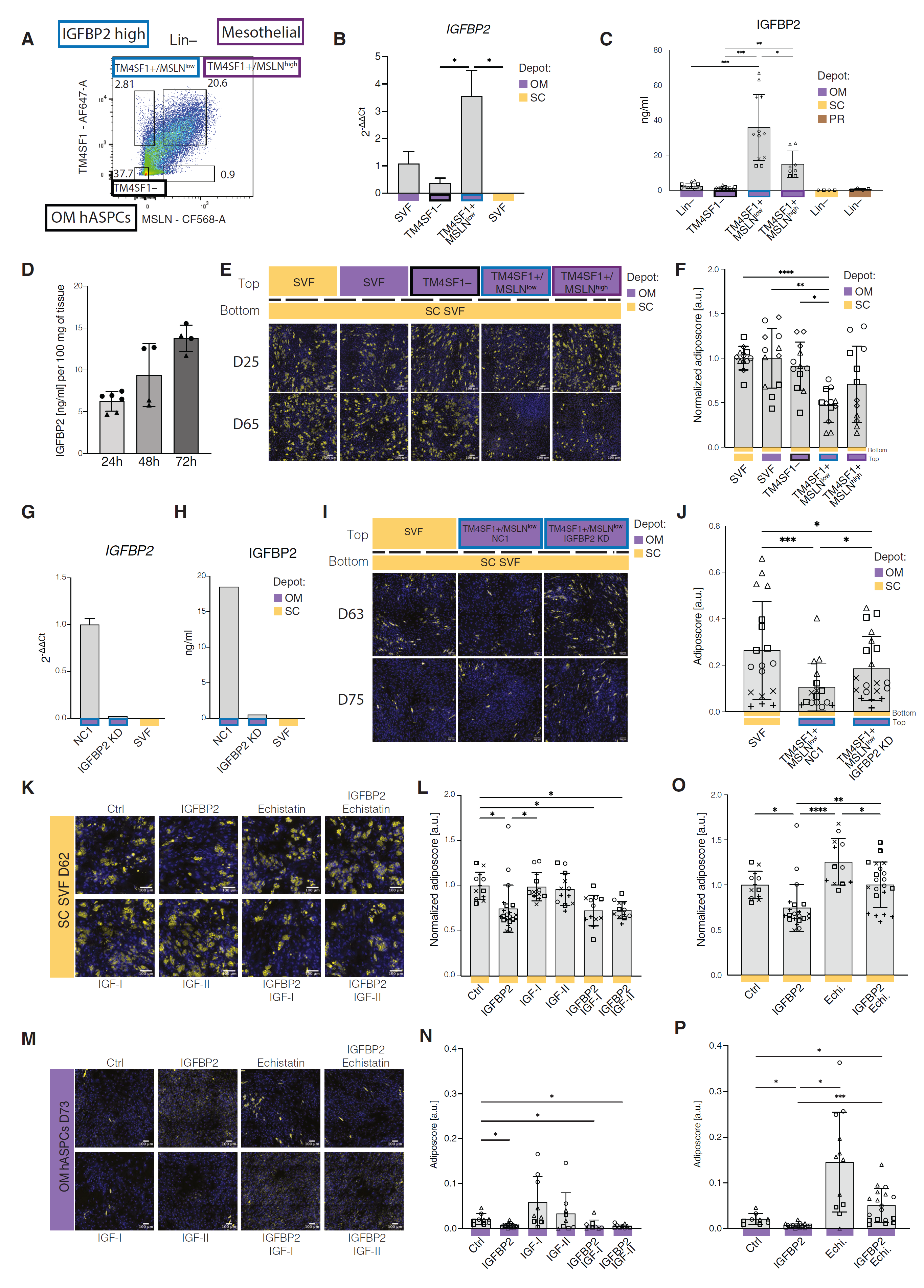
图 7 网膜 IGFBP2+ 基质细胞通过 IGFBP2 抑制脂肪生成
(A)流式细胞术门控策略,用于富集特定的 OM SVF Lin−亚群:Lin−/TM4SF1−(OM ASPCs)、Lin−/TM4SF1+/MSLNlow(IGFBP2+ 细胞)或 Lin−/TM4SF1+/MSLNhigh(间皮细胞)。 (B)OM SVF 细胞亚群中的 IGFBP2 表达;n = 4,2 位供体,2 个重复。 (C)指示群体在 48 小时内分泌的 IGFBP2;n = 8,4 位供体,2 个重复。 (D)100 mg OM 脂肪组织在指定时间窗口内分泌的 IGFBP2;n = 4,2 位供体,2 个重复。 (E)SC SVF 细胞在跨膜装置底部的代表性荧光显微镜图像,在脂肪生成分化后与跨膜顶部指示的群体共培养。 (F)“接受”细胞的脂肪评分量化,如(E)所示。值标准化为参考顶部 SC SVF- 贴附条件的平均脂肪评分;n = 12,4 位供体,3 个独立孔。 (G)IGFBP2 siRNA(IGFBP2 KD)或非靶向 siRNA 对照(NC1)处理的 SVF/Lin−/TM4SF1+/MSLNlow 细胞中的 IGFBP2 表达。SC SVF- 贴附细胞用作阴性对照;n = 2,1 位供体,2 个技术重复。 (H)IGFBP2 siRNA(IGFBP2 KD)或非靶向 siRNA 对照(NC1)处理的 OM SVF Lin−/TM4SF1+/MSLNlow 细胞上清液中的 IGFBP2 水平。SC SVF/Lin−细胞用作阴性对照;n = 2,1 位供体,2 个技术重复。 (I)SC SVF 细胞在跨膜装置底部的代表性荧光显微镜图像,在脂肪生成分化后与跨膜顶部指示的细胞共培养。 (J)“接受”细胞的脂肪评分量化,如(I)所示;n = 16–20,4 位供体,2–4 个独立孔。 (K)SC SVF 细胞在脂肪生成分化后处理:IGFBP2 2 nM、IGF-I 10 nM、IGF-II 10 nM 和蛇毒素 100 nM 的代表性荧光显微镜图像。 (L)细胞的脂肪评分量化,如(K)所示,重点关注 IGFBP2 的 IGF 依赖信号通路。值标准化为对照细胞(Ctrl);n = 12,4 位供体,3 个独立孔。 (M)OM hASPCs 在脂肪生成分化后,如(K)中所示处理的代表性荧光显微镜图像。 (N)细胞的脂肪评分量化,如(M)所示,重点关注 IGF 相关信号通路。值标准化为对照细胞(Ctrl);n = 9,3 位供体,3 个独立孔。 (O)细胞的脂肪评分量化,如(K)所示,重点关注整合素相关信号通路。值标准化为对照细胞(Ctrl);n = 12,4 位供体,3 个独立孔。 (P)细胞的脂肪评分量化,如(M)所示,重点关注整合素相关信号通路。值标准化为对照细胞(Ctrl);n = 9,3 位供体,3 个独立孔。
对于(E)、(I)、(K)和(M):黄色为脂质;蓝色为 DNA;比例尺,100 μm。 ∗p ≤ 0.05,∗∗p ≤ 0.01,∗∗∗p ≤ 0.001,∗∗∗∗p ≤ 0.0001,一元 ANOVA 和 Tukey HSD 事后检验(B、C、F、L 和 O),REML 分析与相同供体的匹配值,和 Tukey HSD 事后检验(J、N 和 P)。所有条形图显示平均值和平均值的标准差作为误差棒。
由于 IGFBP2 被证明具有抗脂肪生成的特性,我们想知道表达 IGFBP2 的细胞是否可以解释 OM TM4SF1+ 部分的旁分泌抗脂肪生成效应(图 5D 和 5E)。为了测试这一点,我们使用了一个跨膜设置,在底部播种了脂肪生成的 SC SVF Lin−细胞,并在顶部放置不同分数的 OM 基质细胞(图 7E)。我们观察到,OM Lin−/TM4SF1+/MSLNlow 细胞对 SC 细胞施加了最强的脂肪生成抑制,而当 SC 细胞暴露于 OM Lin−/TM4SF1+/MSLNhigh 部分时,抑制作用要温和得多(图 7E 和 7F)。与共培养实验一致(图 S5A 和 S5B),PR hASPCs 对跨膜设置中 OM SVF Lin−细胞亚群的抗脂肪生成作用有抵抗力(图 S7C 和 S7D)。
为了评估 IGFBP2 分泌是否解释了表达 IGFBP2 的细胞的抗脂肪生成效应,我们使用小干扰 RNA(siRNA)敲低(KD)IGFBP2。在验证了 KD 在 mRNA 和分泌蛋白水平上的效果后(图 7G 和 7H),我们再次使用跨膜设置,将转染了对照(NC1)或 IGFBP2 siRNAs 的细胞暴露于 SC SVF Lin−细胞。暴露于 IGFBP2 KD 细胞的 SC 细胞形成的脂滴显著多于暴露于对照转染细胞的细胞(图 7I 和 7J),支持 IGFBP2 分泌参与了 Lin−/TM4SF1+/MSLNlow 细胞的抗脂肪生成作用。同样,用外源重组 IGFBP2 处理足以剂量依赖性地抑制来自 SC 或 PR 脂肪库的 SVF 细胞的脂肪生成,尽管在 PR 细胞中效果较温和(图 7K-7O,S7E 和 S7F)。这种浓度(1 nM = 33 ng/mL)与在 IGFBP2+ 细胞上清液中测量的范围相似(图 7C)。
IGFBP2 通过整合素信号抑制脂肪生成分化¶
IGFBP2 可以通过依赖胰岛素样生长因子(IGF)的途径或独立于 IGF 的途径发挥作用。在第一种情况下,hASPCs 细胞外环境中的 IGFBP2 会结合 IGF-I 和/或 IGF-II 并干扰其促脂肪生成信号。为了测试 IGFBP2 是否通过结合 IGFs 发挥作用,我们将 SVF- 贴附细胞与 IGFBP2、IGF-I 或 IGF-II 以及三种重组蛋白单独处理。尽管大多数文献使用 IGF-I 和 IGF-II 的浓度约为 10 nM,但我们无法观察到任何浓度范围内(2.5 至 40 nM)的 hASPCs 脂肪生成潜力的显著影响(图 S7E 和 S7F)。然而,我们的脂肪生成鸡尾酒通常会诱导高脂质积累,这可能掩盖了 IGFs 的任何脂肪生成效应。为了解决这个问题,我们还测试了效力较低的脂肪生成鸡尾酒中 IGFs 的效果。然而,在其中没有一种情况下,IGF-I 或 IGF-II 影响了脂质积累(图 S7G)。此外,对于 SC 细胞,IGFBP2 对脂肪生成的抑制作用在有无 IGFs 的情况下是相当的(图 7K 和 7L),表明 IGFBP2 以独立于 IGF 的方式影响脂肪生成。再次,PR 细胞对 IGFBP2 和 IGF 处理的作用较不敏感,这与我们先前的观察结果一致,表明 PR SVF- 贴附细胞在跨膜设置中对 OM SVF Lin−细胞或 OM SVF Lin−/TM4SF1+/MSLNlow 细胞的抑制作用较不敏感(图 S5A,S5B,S7C 和 S7D)。
接下来,我们探讨了 OM hASPCs 自身对 IGFBP2 和 IGF 处理的反应程度,因为这些细胞在解剖上与分泌 IGFBP2 的细胞共定位。即使 OM TM4SF1−细胞本质上脂肪生成能力低,我们观察到这些细胞在处理 IGFBP2 时分化能力受损(图 7M 和 7N)。与 PR 和 SC 细胞相反,OM 细胞对 IGF-I 和 IGF-II 处理更敏感,但批次间存在很大的变异性(图 7M 和 7N)。然而,当与 IGFs 和 IGFBP2 共同处理时,OM TM4SF1−细胞的分化再次显著低于未处理细胞(图 7M 和 7N)。IGF 处理不影响 IGFBP2 作用的事实进一步加强了 IGFBP2 以独立于 IGF 的方式发挥作用的概念。
或者,IGFBP2 也可以结合识别 RGD 结构域的整合素受体,最著名的是α5β1 整合素受体,其信号可以阻止脂肪细胞分化。为了测试整合素受体信号在 IGFBP2 抗脂肪生成作用中的影响,我们使用了已知的 RGD- 结合整合素受体拮抗剂 echistatin。当细胞同时处理 IGFBP2 和 echistatin 时,处理细胞的脂肪生成潜力与未处理对照细胞相似(图 7K 和 7O)。通过分析对 RGD- 结合整合素受体反应激活的细胞外信号调节激酶 1 和 2(ERK1/2)的磷酸化,确认了 IGFBP2 通过整合素信号的参与。IGFBP2 在 SC AT 的 SVF 细胞中增加了 ERK1/2 的磷酸化,这一作用被 echistatin 处理所消除(图 S7H)。相比之下,胰岛素激活 ERK1/2 不受 echistatin 的影响,支持 IGFBP2 信号的特异性作用(图 S7H)。有趣的是,IGFBP2 也在 PR AT 中触发 ERK1/2 信号,但程度较低(图 S7I),这可能解释了为什么在这种浓度下 IGFBP2 处理并未显著抑制脂肪生成。我们的结果还表明,echistatin 处理显著增强了 SC SVF- 贴附细胞的分化(图 7K 和 7O),而在 PR 细胞中则相对温和但显著增加了整体脂肪生成潜力(图 S7J 和 S7L)。这表明 IGFBP2/整合素信号轴在 SC AT 中更为显著。最引人注目的是,当用 echistatin 处理 OM TM4SF1−细胞时,我们观察到这些本质上不具脂肪生成能力的细胞积累脂滴的能力显著增加(图 7M 和 7P)。此外,与 echistatin 和 IGFBP2 共同处理导致的分化显著高于未处理细胞,但低于仅 echistatin 处理(图 7M 和 7P)。总之,这些结果突出了整合素受体信号在 hASPC 脂肪生成调节中的作用。
然后,我们测试了在本质上不表达 IGFBP2 的细胞中人工表达 IGFBP2,例如 SC hASPCs,是否足以削弱其脂肪生成潜力。为此,我们用编码 Myc-DDK-IGFBP2 或 Myc-DDK 的慢病毒载体转导 SC hASPCs 作为对照。转导 IGFBP2 的细胞有效地将 IGFBP2 分泌到细胞培养基中,并且这种作用通过将细胞与含有布雷佛霉素 A 和莫奈辛的蛋白质运输抑制剂混合物(PTIC)孵育完全阻止(图 S7M 和 S7N)。相应地,当用 PTIC 处理 Myc-DDK-IGFBP2 转导细胞时,在总裂解物中观察到大量 IGFBP2 的积累(图 S7N)。这些结果表明,我们转导的 SC hASPCs 有效表达并分泌 IGFBP2。当诱导分化时,对照细胞显示出明显的脂滴积累。相比之下,表达 IGFBP2 的细胞大部分保持纺锤形,只显示出一些小的脂滴(图 S7O)。总体而言,这些观察表明,强制表达 IGFBP2 削弱了 SC hASPCs 中的脂肪生成分化。
讨论 在本研究中,我们通过单细胞 RNA 测序(scRNA-seq)解析了人类皮下(SC)、肾周围(PR)、网膜(OM)和肠系膜(MC)脂肪组织(AT)的 Lin−细胞群。通过对比我们的数据与人类和小鼠脂肪组织的公开数据集,我们能够识别出在不同脂肪组织中共享的基质细胞群,包括三个相对较小的群体(HHIP+、IFIT+ 和 SFRP4+ 细胞),以及两个主要的群体:(1)hASCs,其对应于小鼠和人类的 DPP4+ 群体,以及(2)hPreAs,其对应于小鼠 Icam1+/Aoc3+ 和人类 ICAM1+ 群体。最后,在所有分析的人类脂肪组织中还发现了一个显著的 VSMP 群体。
我们还识别出了特定于脂肪库的细胞群体,例如几乎特有于 OM AT 的间皮细胞。尽管此前已报告了 OM SVF 中的间皮细胞的存在,它们在 ASC 微环境中的作用仍然不清楚。与此前在小鼠中的观察结果类似,我们的结果表明间皮细胞不会产生脂肪细胞。然而,特定亚群的间皮细胞可以抑制邻近 hASPCs 的分化,表明位于或散布在 OM AT 中的间皮组织可能对其可塑性有调控作用。这一特定亚群(排序为 Lin−/TM4SF1+/MSLNlow 细胞)表达并分泌高水平的 IGFBP2,强烈抑制了 SC 和 OM hASPCs 的脂肪生成能力。这与先前报道的 IGFBP2 的抗脂肪生成特性一致。从机制上看,我们的研究表明,IGFBP2 的抗脂肪生成作用是通过激活整合素受体信号传导介导的。IGFBP2 激活整合素受体,特别是α5β1 异二聚体的能力已被充分表征。与我们的结果一致,这些受体被其他分子(如纤维连接蛋白)激活或通过过表达 Itga5(编码整合素α5)抑制小鼠脂肪生成细胞系的终末分化。同样,我们的转录组分析显示,培养的 OM SVF 细胞可以启动脂肪生成程序的早期步骤,但未能有效地达到晚期阶段。在 OM SVF 中鉴定出抗脂肪生成群体可能有助于解释 OM SVF 在培养中的有限脂肪生成能力。然而,敲低 IGFBP2 只能部分恢复 OM hASPCs 的脂肪生成能力,表明 OM hASPCs 仍具有其他细胞内在机制,使其在体外分化时具有抗性。在这方面,OM 细胞表现出更多的炎症基因表达特征,这也可能解释了这些细胞的较低分化能力。此外,先前的研究表明,OM 来源的 ASPCs 分泌更多的 TGF-β配体,抑制 TGF-β信号可改善 OM 来源细胞的脂肪生成分化。值得注意的是,TGF-β可以增加 IGFBP2 的表达,这表明 IGFBP2 的分泌也可能参与 TGF-β对新生脂肪生成的抑制作用。
我们在 OM SVF 中识别出的抗脂肪生成细胞类型唤起了在小鼠 SC AT 中发现的 Aregs。因此,在人类中,特化的微环境细胞也可能对 AT 的可塑性做出贡献。然而,Aregs 和 OM 来源的 IGFBP2+ 细胞具有不同的细胞身份。尽管 Aregs 具有间充质性质,IGFBP2+ 细胞表现出间充质和间皮双重身份,并显示出间皮向间质过渡标记物的富集,这一过程可能由 IGFBP2 本身驱动。这表明,尽管具有同源抗脂肪生成作用的细胞类型可能存在于不同的脂肪库中,但它们可能具有不同的转录/细胞身份。
在推测 IGFBP2+ 细胞在体内的潜在生理作用时,需要考虑几个因素。首先,这些细胞在 OM AT 中的总 SVF 细胞中占比相对较小(约 2%)。因此,它们的作用可能是局部的。第二个方面是时间因素。我们最近描述了 Aregs 在断奶后获得其抗脂肪生成能力。因此,我们不能排除 IGFBP2+ 细胞的数量或其抗脂肪生成特性可能在不同的生命阶段进行调节,从而灵活地改变 OM AT 的生长反应。最后,进一步的研究将有必要了解这种新的抗脂肪生成细胞类型在病理生理状况下的作用。在这方面,我们观察到推测的 IGFBP2+ 细胞丰度与 BMI 之间存在显著正相关。这一观察结果似乎与先前报道的 BMI、代谢综合征发作和非酒精性脂肪肝病与循环 IGFBP2 血清水平之间的负相关相矛盾。一个可能的解释是,IGFBP2+ 细胞数量增加并不意味着表达或分泌水平增加。此外,由于 IGFBP2 由肝脏等其他器官分泌,全身 IGFBP2 水平可能不反映 OM AT 中 IGFBP2 的旁分泌分泌。
不同 hASPC 亚型的比例也可能影响 AT 中的增生和肥大反应。例如,我们发现 hASC 池在 OM AT 中比例最小,这支持了 SC 和 PR AT 通过增生扩展的能力比 OM AT 更大的假设。然而,不同脂肪库在响应营养物质或生物信号时的生长受个体间变异的影响很大。尽管脂肪细胞肥大,尤其是在 OM AT 中,似乎与代谢并发症相关,但这个特定脂肪库是通过肥大还是增生生长可能具有强烈的个体/遗传成分。我们可以推测,不同数量的 IGFBP2 表达细胞可能影响 OM AT 在人体中主要通过肥大还是增生方式生长。
总之,我们的研究有助于更好地理解不同人类脂肪库的行为。它还突出了在不同脂肪库和物种中保守的主要细胞群体。最后,它识别并机械性地表征了一种 OM 特异性细胞群体,该群体抑制邻近 hASPCs 的分化。Zhang 等人的一项最新研究在小鼠附睾 AT 中确实鉴定了“类间皮细胞”,这些细胞与间皮和间充质细胞共享标记,并且还通过高 Igfbp2 表达定义。这表明 OM IGFBP2+ 细胞可能在小鼠和人类之间保守,这反过来可能为研究其在 OM AT 可塑性中的相关性开辟新的实验途径。更好地了解 OM IGFBP2+ 细胞的作用还可能导致新的策略,使 OM hASPCs 更具脂肪生成性和减少炎症,这对于治疗与肥胖相关的代谢疾病可能是有价值的。
研究的局限性¶
我们的一些机械和功能性检测涉及到提前铺设完整的 SVFs 或分选的细胞亚群。我们不能排除我们的分选策略以及体外铺设和扩展细胞可能影响细胞的转录组和/或功能特性。对于探索原代培养细胞或组织解离后铺设细胞的科学领域来说,这是一个常见问题。在这方面,最近在空间、单细胞转录组和蛋白质组学方面的进展预计将揭示原代培养细胞与其原生环境中细胞之间的差异。另一个局限性是缺乏纵向的活检采样,无法明确预测不同细胞亚群比例如何影响其脂肪库的长期组成和功能。因此,重要的是认识到我们的研究并非设计用于探讨特定生命阶段、体重或疾病如何影响脂肪库中各种细胞亚群的丰度或功能。尽管我们发现了一些相关性,未来在更大、定义明确的队列上进行的研究将是必要的,以明确确定年龄和肥胖与不同细胞亚群比例/功能(如 TM4SF1+/MLSNlow(IGFBP2+)细胞)之间的关系。