Blimp 1 and c Maf regulate immune gene networks to protect against distinct pathways of pathobiont induced colitis
摘要¶
肠道对微生物的免疫应答受到细胞因子 IL-10 的控制,以避免免疫病理反应。在本研究中,我们使用结肠固有层白细胞(LPLs)的单细胞 RNA 测序技术,结合纯化的 CD4+ T 细胞的 RNA-seq 和 ATAC-seq,来展示转录因子 Blimp-1(由 Prdm1 编码)和 c-Maf 共同主导调控 Il10,同时在效应 T 细胞中负向调控促炎细胞因子。双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠感染幽门螺旋杆菌后,发展成严重的结肠炎,并在 LPLs 中增加了 TH1/NK/ILC1 效应基因,而 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠表现出中等病理变化和较弱的 1 型效应反应。感染后的 Maffl/flCd4Cre 小鼠的 LPLs 表现出增加的 17 型反应,Il17a 和 Il22 表达增加,以及粒细胞和髓细胞数量的增加,导致 T 细胞–髓细胞–中性粒细胞相互作用的增加。在没有 Prdm1 或 Maf 的情况下,感染小鼠的 LPLs 表现出与人类炎症性肠病过度表达基因不同的表达,揭示了人类疾病的潜在机制。
正文¶
免疫反应已经进化出来保护宿主免受感染;然而,例如细胞因子 IL-10 这样的机制被用来调控对病原体和病原体共生者的免疫反应,以防止不良炎症和宿主损伤 1,2,3,4,5。IL-10 缺乏的小鼠(Il10−/−)可能会发展成结肠炎 6,尽管在特定病原体无菌饲养的 Il10−/− 小鼠或无菌小鼠中表现不太明显 7,这是由诸如幽门螺旋杆菌(H. hepaticus)8 等病原体共生者触发的。T 细胞源的 IL-10 在控制肠道反应中起主导作用,特异性缺失 IL-10 的 T 细胞小鼠发展出与 Il10−/− 小鼠类似程度的结肠炎 9。Il10、Il10ra 或 Il10rb 基因的罕见功能丧失突变导致儿童炎症性肠病(IBD),尽管尚不清楚病原体共生者的感染是否促成这些病理状态 10。全基因组关联研究已经确认了与人类 IBD 相关的 230 多个位点,包括与促炎细胞因子及其上游转录因子相关的位点 11,如由 Prdm1(参考文献 12)编码的 Blimp-1。
共有的和特异的转录机制在 T 细胞中调节 Il10 和促炎基因表达,以确保对病原体或其他触发因素的控制性免疫反应 1,3,4,5,13,14,15。鉴于转录因子具有多个基因靶点,那些正向调控 Il10 的因子可能同时抑制 T 细胞中的促炎细胞因子表达。c-Maf 在体外和体内直接诱导多种 T 细胞亚群中的 Il10 表达 1,同时也作为 Il2(参考文献 13)和其他促炎细胞因子 16 的负向调节因子,并表现出特定环境下的效应 13。报道称,T 细胞或调节性 T 细胞(Treg)中删除 Maf 并未导致自发性炎症 13,17,而在其他研究中,具有 T 细胞或 Treg 特异性删除 Maf 的小鼠表现出肠道炎症的迹象 18,19。转录因子 c-Maf 和 Blimp-1 是多种 T 细胞亚群中 Il10 基因表达的主要共同调节因子 14,15。尽管报告称特异性删除 Prdm1 的 T 细胞会导致自发性结肠炎 20,21,22,伴随着 T 助细胞 17(TH17)细胞频率的增加 23,但其他研究报告这些小鼠中没有肠道炎症 14,24。此外,虽然 Blimp-1 作为分子开关以防止 Foxp3+RORγt+ Treg 的炎症活性 25,但在 Treg 中删除 Prdm1 并未导致严重的肠道炎症 26。报道称,具有 T 细胞特异性删除 Prdm1 和 Maf 的小鼠出现自发性结肠炎,这种病理状态与一群独特的 Treg 细胞及 Il10 表达的终止有关 14。
我们在这里报告称,特异性在 T 细胞中删除 Prdm1、Maf 或两种转录因子的小鼠在稳态下不会发展成结肠炎。在感染 H. hepaticus 后,T 细胞中缺失 Prdm1 或 Maf 导致轻度至中度的病理变化,而缺失这两种转录因子则导致严重的病理。我们通过对特异性缺陷的 T 细胞转录因子缺陷的 H. hepaticus 感染小鼠的结肠 LPLs 进行免疫反应的研究,使用组织 RNA 测序(RNA-seq)和单细胞 RNA 测序(scRNA-seq)进行调查,辅以纯化 CD4+ T 细胞的 RNA-seq 和转座酶可及染色质测序(ATAC-seq)分析,并通过流式细胞仪和结肠组织的免疫荧光染色验证关键发现。感染 H. hepaticus 的双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠表现出与 TH1 和自然杀伤/先天性淋巴细胞 1 (NK/ILC1) 效应功能相关的基因大幅增加,包括干扰素 -γ (IFNγ) 和粒细胞 - 巨噬细胞集落刺激因子 (GM-CSF),但在 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠中这种增加较低。相比之下,感染 H. hepaticus 的 Maffl/flCd4Cre 小鼠的 LPLs 表现出增加的 17 型反应,Il17a 和 Il22 的表达增加,以及天生免疥及中性粒细胞的显著特征。从转录组数据集中的人类 IBD 结肠活检中识别出过度表达的基因,在感染 H. hepaticus 的小鼠的 LPLs 中表现出差异性扰动,这些小鼠具有 T 细胞特异性缺陷的 Prdm1、Maf 或两者,可能反映了与人类 IBD 相关的不同病理机制。
结果¶
T 细胞中的 Blimp-1 和 c-Maf 通过淋巴细胞和髓细胞控制结肠炎¶
Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和 Prdm1fl/flMaffl/flCd4Cre 小鼠在稳态下未发展成结肠炎(扩展数据图 1a)。在感染 H. hepaticus 后,这些 T 细胞特异性转录因子缺陷的小鼠发展成了不同程度的结肠炎,总体趋势显示双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠发展出最严重的疾病,而 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠各自发展出轻度至中度的结肠炎,相比之下,作为对照的 Prdm1fl/flMaffl/flCd4Cre 小鼠(以下简称为对照小鼠)未显示出炎症或结肠炎(图 1a–c 和方法)。所有三种敲除小鼠的总 LPLs 数量相比对照组有所增加(图 1d),且在感染的单个 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠中 CD4+ T 细胞数量增加,而在双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠中增加最显著(图 1e)。
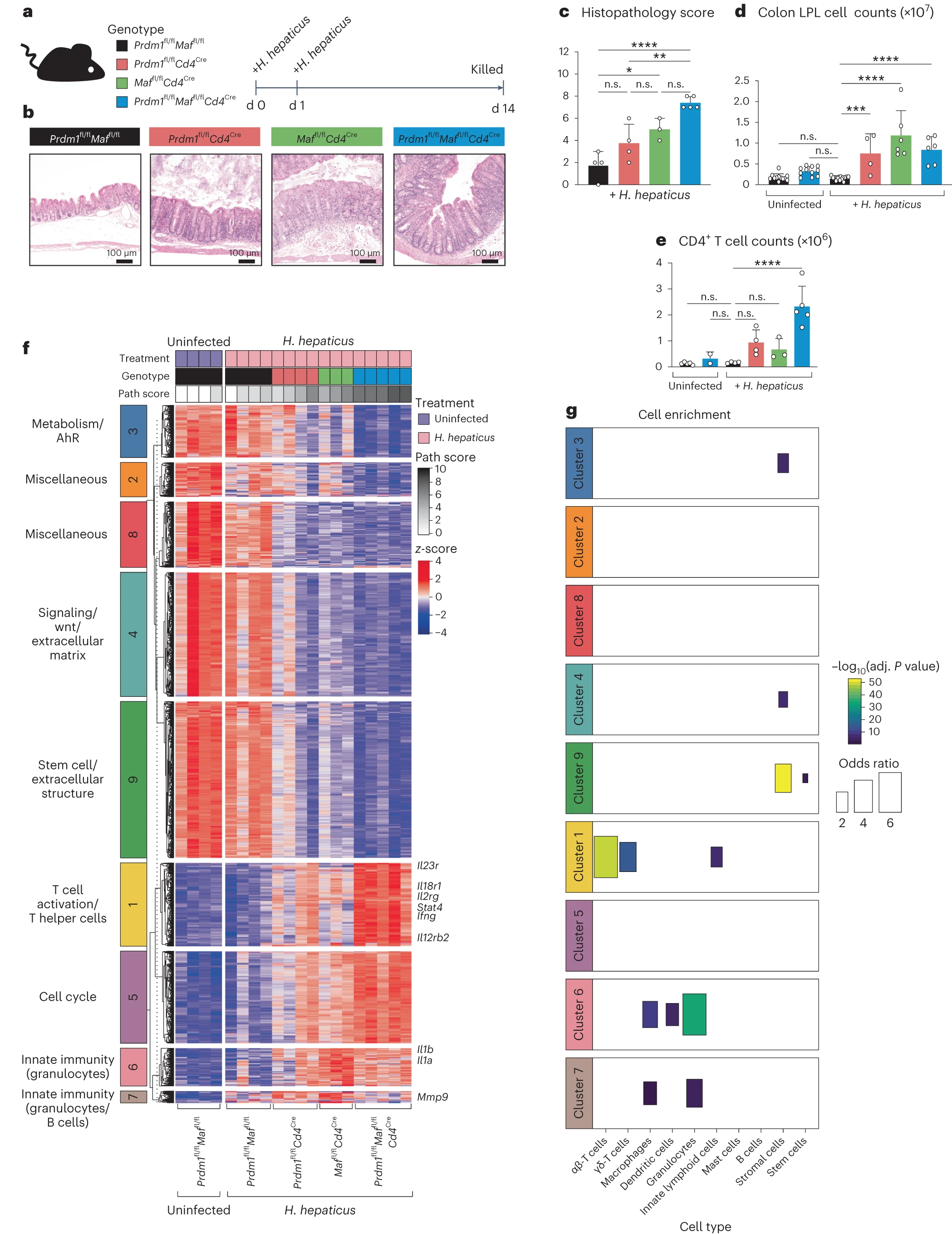
a, 实验方法示意图,显示了通过口服灌胃方法将小鼠感染幽门螺旋杆菌(H. hepaticus)。b–e, 感染 H. hepaticus 14 天后,每种基因型小鼠的代表性结肠苏木精 - 伊红(H&E)切片(b),以及相应的结肠组织病理学评分(详细描述在方法中)(c),感染组与未感染对照组的结肠 LPL 细胞计数对比(d)和每组感染 H. hepaticus 的总 CD4+ T 细胞计数对比未感染对照(e)。条形图中的每个点代表分析的单个小鼠。图表显示了平均值、误差条、标准差。通过单向方差分析(ANOVA)后进行 Dunnett 事后检验分析(*P ≤ 0.05,P ≤ 0.01,*P ≤ 0.001,****P ≤ 0.0001)**。比例尺,100 μm。对未感染的 Prdm1fl/flMaffl/fl 对照组和感染 H. hepaticus 的 Prdm1fl/flMaffl/fl 小鼠以及通过 Cd4Cre 介导的 Prdm1、Maf 或 Prdm1 和 Maf 双重删除的小鼠的总结肠 LPLs 进行了组织总 RNA 测序(Bulk tissue RNA-seq)。f, 基于 z 分数显示的表达值热图,展示了与未感染的 Prdm1fl/flMaffl/fl 对照相比,感染 H. hepaticus 的小鼠中识别出的差异表达基因(DEGs)(变化倍数 ≥1.5 且经 Benjamini–Hochberg (BH) 调整的 P < 0.05),使用 k 均值聚类方法分成九个簇。热图顶部显示了每只小鼠相关的病理学评分。g, 使用 Fisher 精确检验评估了 f 中每个簇的细胞类型特征(来源于之前的出版物 51)。仅绘制了统计显著富集的特征(经 BH 调整的 P < 0.05)。数据来自 n = 3–5 只小鼠。
鉴于 Blimp-1 和 c-Maf 诱导 Il10 基因表达 14,15,同时负向调节大量促炎细胞因子网络 15,我们决定研究特异性 T 细胞中删除 Prdm1、Maf 或 Prdm1 和 Maf 的组合是否会由于 IL-10 信号的消除而导致感染 H. hepaticus 的小鼠病理和炎症增加。为了解决这个问题,特异性缺失转录因子的 T 细胞和对照小鼠在注射抗 IL-10R 阻断抗体(mAb)或同型对照 mAb(扩展数据图 1b,右侧)的情况下感染 H. hepaticus。IL-10R 信号阻断导致野生型对照小鼠的结肠出现中度至严重的病理,并且在单个 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 感染 H. hepaticus 的小鼠中增加了病理。然而,最严重的病理仍然观察到在感染的双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中,无论是否注射抗 IL-10R mAb,与注射同型对照 mAb 的小鼠相比,病理没有显著增加(扩展数据图 1b,右侧)。这些发现表明,在 Prdm1fl/flMaffl/flCd4Cre 小鼠中观察到的高水平肠道病理是由于这两个转录因子在 Il10 基因调控的共主导作用以及对其他免疫因子的影响。
为了解析不同特异性 T 细胞转录因子缺陷小鼠观察到的病理机制,我们对感染 H. hepaticus 的和未感染小鼠的 LPLs 进行了 RNA 测序分析(扩展数据图 1c,d, 图 1f 和补充表 1)。Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 显示出与未感染对照小鼠相比的显著增加的差异表达基因(DEGs),而双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠与感染对照相比显示出更高数量的 DEGs,这些对照显示最少的 DEGs(补充表 2)。这些形成了九个类似调控的 DEGs 簇,使用通路分析工具进行注释(图 1f,补充表 2 和扩展数据图 1e),与每个热图顶部显示的病理评分相关。第 3 簇(代谢/AhR),第 4 簇(信号/Wnt/细胞外基质),第 9 簇(干细胞/细胞外结构)以及第 2 和 8 簇(杂项)的 DEGs 在感染 H. hepaticus 的转录因子缺陷小鼠的 LPLs 中都减少了,主要代表非免疫基因(图 1f)。相反,第 1 簇(T 细胞激活/T 助细胞)和第 5 簇(细胞周期)的 DEGs 在感染 H. hepaticus 的 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠的 LPLs 中部分增加,并在双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠中进一步增加(图 1f)。第 6 簇(先天免疫/粒细胞)和第 7 簇(先天免疫/粒细胞/B 细胞)的 DEGs 在感染 H. hepaticus 的 Maffl/flCd4Cre 小鼠中显著增加,并在双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠中也有所增加,但在感染的 Prdm1fl/flCd4Cre 小鼠中几乎没有增加(图 1f 和补充表 2)。使用 ImmGen Ultra Low Input 数据(GSE109125)派生的细胞类型特异性基因签名,验证了代表免疫途径的簇的通路注释(图 1g 和扩展数据图 1e)。第 1 簇(T 细胞激活/T 助细胞)在 αβ-T 细胞、γδ-T 细胞和 ILCs 中富集,第 6 簇(先天免疫)和第 7 簇(与粒细胞相关的基因)分别显示了巨噬细胞、树突细胞和粒细胞以及巨噬细胞和与粒细胞相关的基因的富集(图 1g)。
为了进一步探讨基因表达变化并识别与免疫相关基因的细胞来源,我们对独立实验中从感染和未感染 H. hepaticus 的小鼠的结肠中分离的 LPLs 进行了单细胞 RNA 测序(scRNA-seq)(图 2 和扩展数据图 2)。首先,将所有组的 LPL 数据集成到一个统一的流形近似和投影图中进行分析,揭示了 17 个独特的细胞簇(图 2a)进行注释,使用单细胞小鼠细胞图谱、Immgen 数据库(GSE109125)和手工整理进行标注(图 2a 和补充表 3)。从感染 H. hepaticus 的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPLs 的 scRNA-seq 数据显示了与未感染(fl/fl 对照小鼠和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠)以及感染对照 fl/fl 小鼠相比的独特表达谱(图 2b 和扩展数据图 2)。在未感染对照小鼠、未感染的双重缺陷 Prdm1fl/flMaffl/flCd4Cre+ 小鼠和感染对照小鼠的 LPLs 中,通过 scRNA-seq 识别出相似比例的免疫细胞类型,且没有肠道病理表现(图 2b 和扩展数据图 2)。然而,未感染的双重缺陷 Prdm1fl/flMaffl/flCd4Cre+ 小鼠的 LPL 制备显示出一些难以解释的上皮细胞比例增加,尽管这些小鼠没有表现出肠道病理(图 2b;见方法)。此外,在这些小鼠的稳态下,通过流式细胞术评估的 LPLs(图 2c)或 CD4+ T 细胞(图 2d)没有观察到增加。
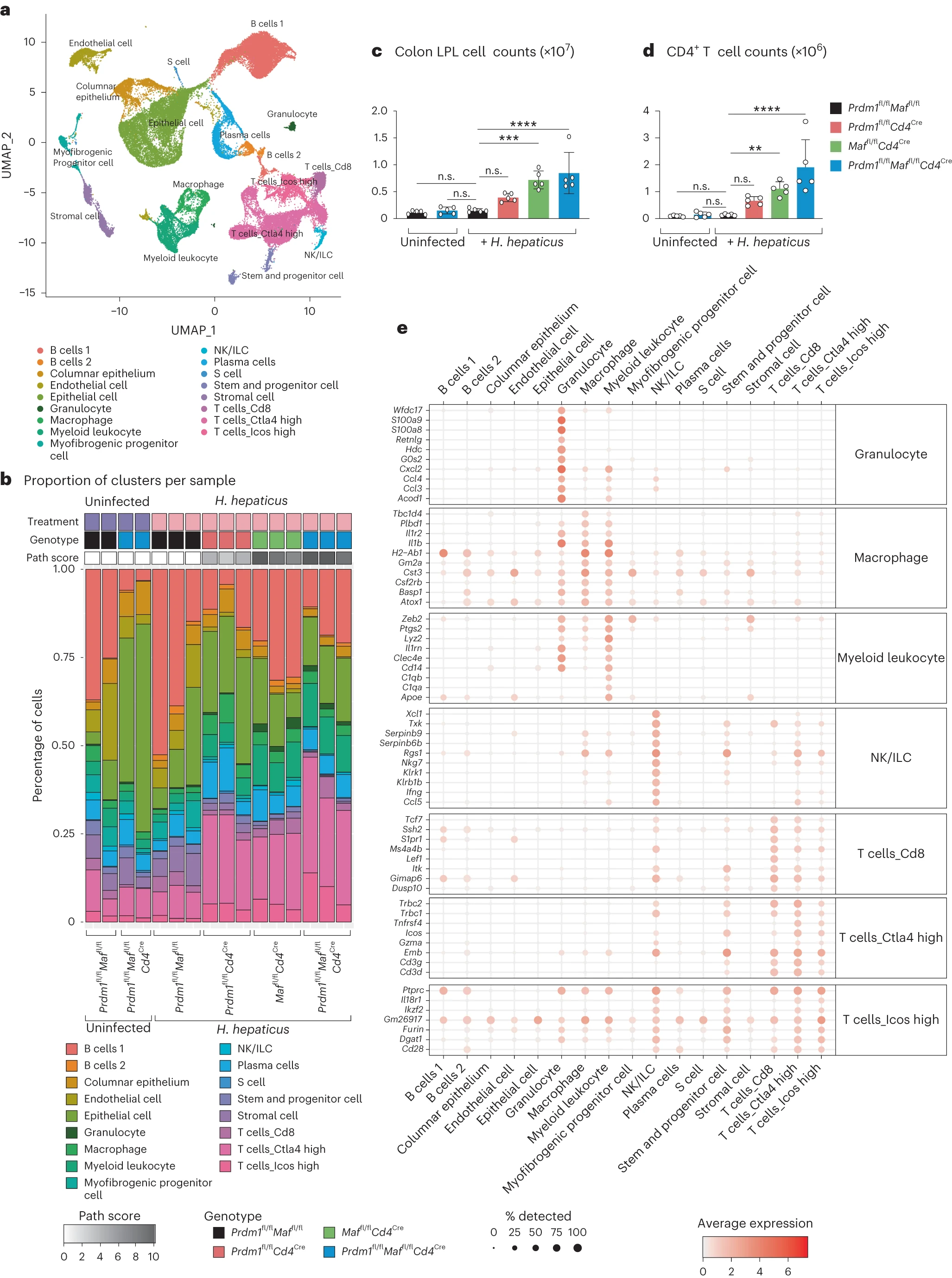
单细胞 RNA 测序(scRNA-seq)被用于分析从未感染的 Prdm1fl/flMaffl/fl 和 Prdm1fl/flMaffl/flCd4Cre 对照小鼠,以及感染 H. hepaticus 的 Prdm1fl/flMaffl/fl 小鼠和通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠中分离的结肠 LPL。a, 利用均匀流形近似和投影(UMAP)技术可视化所有条件下整合的 scRNA-seq 数据,通过识别/指定的细胞簇进行着色。b, 条形图显示每个实验条件下每个生物重复中每个细胞簇的细胞比例及相应的组织病理学评分(方法详述)。c, 每组感染 H. hepaticus 的小鼠与未感染对照的结肠 LPL 细胞计数比较。d, 实验中每组的总 CD4+ T 细胞计数与未感染对照的比较。条形图中的每个点代表分析的单个小鼠。图表显示平均值;误差条,标准差。通过单向方差分析(ANOVA)及 Dunnett 事后检验分析(*P ≤ 0.05; P ≤ 0.01; *P ≤ 0.001; ****P ≤ 0.0001)。数据来自 n = 5 只小鼠。e, 点图显示 a 中相关细胞簇的前十个差异表达标记基因,颜色代表所有细胞簇中平均基因表达量。点的大小表示每个细胞簇中表达该基因的细胞百分比。
在感染 H. hepaticus 的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中,再次通过流式细胞仪观察到肠道病理增加(图 2b),以及 LPL 和 CD4+ T 细胞数量增加(图 2c,d),与对照 fl/fl 小鼠相比。scRNA-seq 数据揭示了 T 细胞比例的类似增加,但还显示了更多的细节,例如在 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠的 LPL 中观察到 Ctla4 高表达 T 细胞的增加,以及在感染的双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中该细胞亚群增加更显著(图 2b,扩展数据图 2 和补充表 3)。观察到 Icos 高表达 T 细胞有较小的增加,但 CD8 T 细胞没有变化(图 2b 和扩展数据图 2)。NK/ILC 细胞簇表达了一组特异的 NK 细胞特有基因,包括 Nkg7, Klrb1b 和最高水平的 Ifng,确认了它们作为 NK/ILC1 细胞的身份(图 2e 和扩展数据图 3a)。尽管 Ctla4 高和 Icos 高的 T 细胞亚群分别聚集,但它们广泛共享前十个标记基因的表达(图 2e 和扩展数据图 3a)。scRNA-seq 数据还复制了在感染 H. hepaticus 的 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中,但不是在感染的 Prdm1fl/flCd4Cre 或对照小鼠中,粒细胞增加的结果,包括与中性粒细胞相关的基因 Acod1, S100a8 和 S100a9 的表达增加(图 2e, 扩展数据图 3a 和补充表 3)。标记为巨噬细胞和髓样白细胞的群体在感染 H. hepaticus 的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中增加(图 2b 和扩展数据图 2),并显示出与髓样或先天免疫反应相关的基因,如 Lyz2 (LysM), Csf2rb, Il1r2, Il1b 和 Cd14 的表达增加(图 2e, 扩展数据图 3a 和补充表 3)。因此,这些 scRNA-seq 数据确定了关键基因表达特征的细胞来源。
Prdm1 和 Maf 诱导 Il10 的同时也破坏效应 T 细胞的基因表达¶
从 LPL 中提纯的 CD4+ T 细胞中 Il10 mRNA 的表达在感染 H. hepaticus 的 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠中减少,并在双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠中减少最多(图 3a 和补充表 4、5)。这一点在 IL-10 蛋白产量的类似减少中得到了体现(扩展数据图 4a,d,e)。相反,感染 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠的 CD4+ T 细胞表现出 Ifng 表达的增加,双重缺陷的 Prdm1fl/fl Maffl/flCd4Cre 小鼠中观察到最大的增加,并且 IFNγ 蛋白产量也增加(扩展数据图 4a–c,e)。在总 LPLs 中通过 RNA-seq(图 3c)和 scRNA-seq(图 3d)观察到的 Ifng 表达增加更为明显,而不是在 CD4+ T 细胞中,这表明增加的 CD4+ T 细胞、γδ-T 细胞或 NK/ILC1 细胞数量可能促成了感染 H. hepaticus 的 T 细胞特异性转录因子缺陷小鼠 LPLs 中 Ifng 表达总水平的增加。在从 LPL 中提纯的 CD4+ T 细胞中,Il17a 和 Il22 表达在感染 Maffl/flCd4Cre 小鼠中最高,而在感染 Prdm1fl/flMaffl/flCd4Cre 和 Prdm1fl/flCd4Cre 小鼠中较低(图 3b),LPLs 中通过 RNA-seq(图 3c)和 scRNA-seq(图 3d)得到了类似的结果。感染 Maffl/flCd4Cre 小鼠中 CD4+ T 细胞的 Il17a 水平与未感染和感染对照小鼠中的相似(图 3b)。然而,scRNA-seq 显示 Il17a 在表达水平和表达 Il17a 的细胞百分比上的独家提升,表明增加的 CD4+ T 细胞、γδ-T 细胞或 ILC3 细胞数量可能促成了感染 H. hepaticus 的 Maffl/flCd4Cre 小鼠 LPLs 中 Il17a 表达的全局增加(图 3c,d)。Csf2 RNA 表达在 CD4+ T 细胞(图 3b)和感染双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPLs 的 scRNA-seq 中最高(图 3d),TH1 相关的效应分子 Ifng, Il18r1, Il12rb2, Il12rb1 和 Cxcr3 以及 Il23r 也是如此。这些基因在 Prdm1fl/flCd4Cre 小鼠中也有增加,但在 Maffl/flCd4Cre 小鼠中没有(图 3b,d 和扩展数据图 4k)。
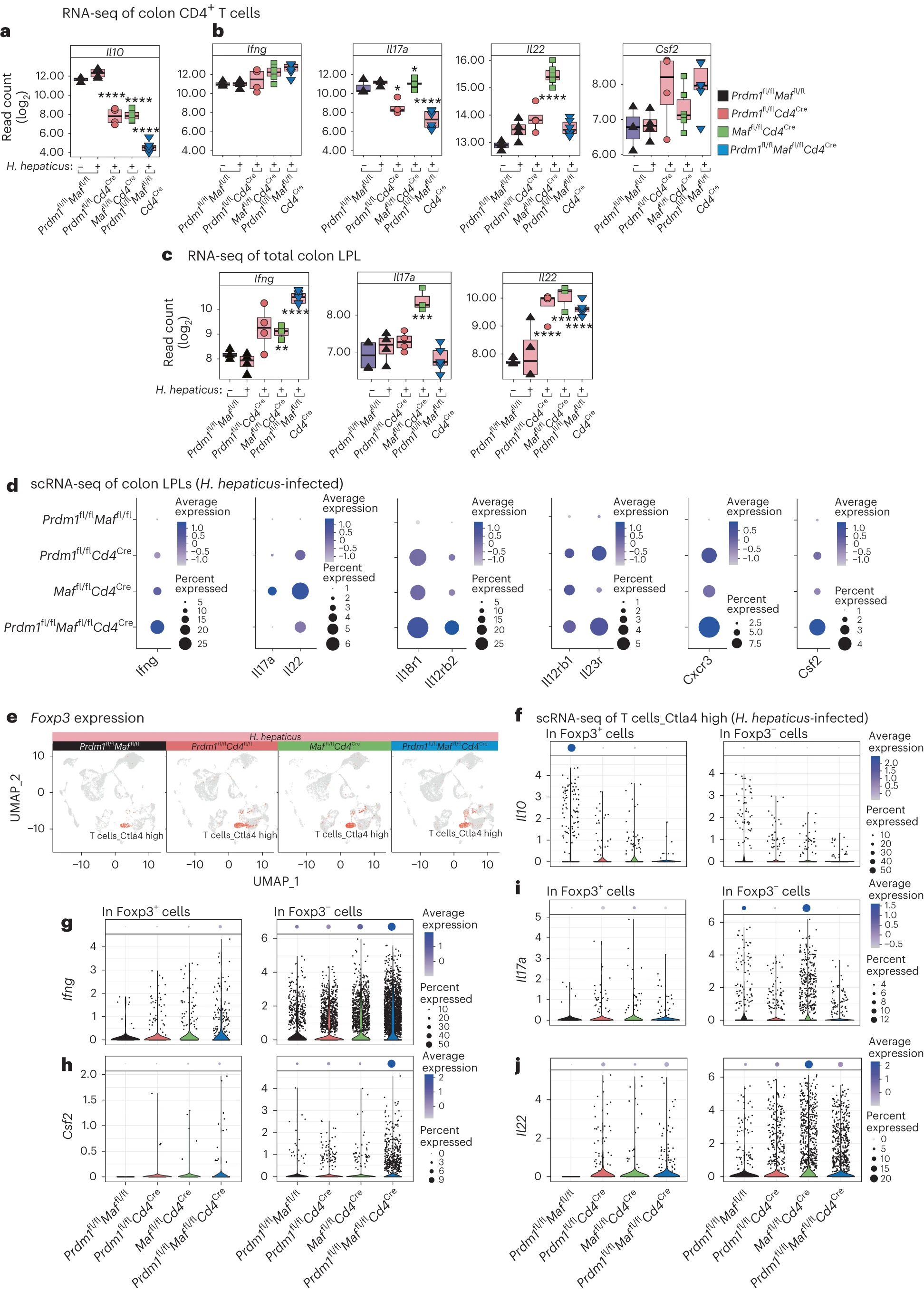
a, b, 从未感染的 Prdm1fl/flMaffl/fl 小鼠和感染 H. hepaticus 的 Prdm1fl/flMaffl/fl 小鼠以及通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠的结肠 LPL 中分离的 CD4+ T 细胞的 RNA-seq 基因表达,分别为 Il10 (a) 和 Ifng, Il17a, Il22 和 Csf2 (b)。c, 从未感染和感染 H. hepaticus 的小鼠中分离的结肠总 LPLs 的组织总体基因表达,包括 Ifng, Il17a 和 Il22。在 a–c 中,每个条件下与未感染 Prdm1fl/flMaffl/fl 小鼠相比的差异表达基因(DEGs)被标记为统计显著性,*BH 调整 P ≤ 0.05;BH 调整 P ≤ 0.01;*BH 调整 P ≤ 0.001;****BH 调整 P ≤ 0.0001。d, H. hepaticus 感染的 Prdm1fl/flMaffl/fl 小鼠或通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠的结肠 LPLs 中选定基因 Ifng, Il17a, Il22, Il18r1, Il12rb2, Il12rb1, Il23r, Cxcr3 和 Csf2 的 scRNA-seq 基因表达的点图。点的大小表示每个细胞簇中表达该基因的细胞百分比,颜色标尺表示表达水平。e, 在 UMAP 可视化的注释 scRNA-seq 数据集中,对每个感染 H. hepaticus 的基因型进行 Foxp3 的表达评估。f–j, 在表达 Foxp3(Foxp3+)或不表达 Foxp3(Foxp3−)的 'Ctla4 high' 细胞中,单细胞水平上的 Il10 (f), Ifng (g), Csf2 (h), Il17a (i) 和 Il22 (j) 的表达。小提琴图显示了每个条件下细胞内表达的分布;点图(顶部面板)显示了表达该基因的细胞比例,颜色标尺表示表达水平。
scRNA-seq 数据进一步调查,以确定在 H. hepaticus 感染的特异性 T 细胞转录因子缺陷小鼠的 LPL 中表达 Il10 和促炎细胞因子的细胞来源。Foxp3+ 调节性 T 细胞位于高 Ctla4 表达的 T 细胞簇中(图 3j),被确认为主要的 Il10 表达 T 细胞(图 3e)。在 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 感染小鼠中,Foxp3+ 调节性 T 细胞中产生 Il10 的细胞表达量和比例均减少,与感染对照小鼠相比较低,Foxp3−CD4+ 中表达 Il10 的 T 细胞数量也同样减少(图 3f)。在 H. hepaticus 感染的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中,通过流式细胞术观察到 Foxp3+ 调节性 T 细胞数量逐级增加(扩展数据图 5a–c)。与此相反,在感染的 Maffl/flCd4Cre 小鼠的 LPL 中,Foxp3+RORγt+ T 细胞几乎完全消失(扩展数据图 5b,c),之前的报道也有提及,而在感染的 Prdm1fl/flCd4Cre 小鼠中增加,双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠中稍微减少(扩展数据图 5b,c)。尽管如此,双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 小鼠表现出最严重的病理变化(图 1b,c 和图 2b),并在 CD4+ T 细胞中表达最低水平的 Il10(图 3a,f)。
与 Foxp3+ 调节性 T 细胞中 Il10 的主导表达相反,Ifng 和 Csf2 在 Foxp3− 的高 Ctla4 T 细胞簇中高度表达,而在 Foxp3+ 调节性 T 细胞中几乎检测不到(图 3g,h),并且在 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 中增加,并在双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 感染小鼠中表达最高。相反,通过 scRNA-seq 观察到,虽然 Il17a 和 Il22 也主要在 Foxp3−CD4+ T 细胞中表达,但在感染的 Maffl/flCd4Cre 小鼠的 LPL 中表达最高(图 3i,j),与通过流式细胞术纯化的 CD4+ T 细胞的 RNA-seq 数据一致(图 3b)。感染的 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中 Il17a 和 Il22 的表达减少,表明 Blimp-1 调控的因子可能抑制了 Il17a 和/或 Il22 的反应(图 3i,j)。总的来说,这些数据表明,由于 Maf 特异性缺陷引起的肠道病理与 Prdm1 甚至 Prdm1-Maf 双重缺陷的病理性质不同,这是由于对 H. hepaticus 感染的 17 型效应细胞因子反应而不是由两种转录因子控制的 1 型反应增加。
全局分析 RNA-seq 和 ATAC-seq 数据揭示了 H. hepaticus 感染的 Prdm1fl/flCd4Cre 和 Maffl/flCd4Cre 小鼠的 CD4+ T 细胞与对照小鼠相比在基因表达和差异可访问位点上的大量独特和重叠变化,而在感染的双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 CD4+ T 细胞中变化更大(扩展数据图 6a–g 和补充表 6 和 7)。通过结合 H. hepaticus 感染的特异性 T 细胞转录因子缺陷小鼠结肠 LPL 中纯化的 CD4+ T 细胞的 ATAC-seq 和 RNA-seq 数据与已发表的染色质免疫沉淀测序(ChIP-seq)数据,揭示了 Il10 位点中 Blimp-1 和 c-Maf 的公共和不同的结合位点(如先前报道 14 所述)。然而,在 Ifng 位点观察到 Blimp-1 的独特结合位点,而 c-Maf 在 Il17 位点有几个结合位点,在 Il22 和 Csf2 基因位点有弱结合位点(图 4a)。我们的数据支持这些转录因子在 Il10 的正向调节以及在促炎细胞因子基因的负向调节中的协作和独立作用。应用于 CD4+ T 细胞的 RNA-seq 数据的通路分析显示,在 H. hepaticus 感染的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 CD4+ T 细胞中,IL-12R 和下游 Stat1/Stat4 信号传导的增加用于 Ifng 的诱导,与感染对照小鼠相比,双重缺陷小鼠中观察到 IFNγ 的最大增加(图 4b)。通路分析显示,在 Maffl/flCd4Cre CD4+ T 细胞的 TH17 通路中 IL17A 和 IL22 的增加最高,而在感染的双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中明显减少,表明 Blimp-1 调控的因子可能抑制 Il17a 基因的表达(图 4c)。在 TH17 通路中观察到的 Csf2 表达再次增加,在所有 H. hepaticus 感染的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 的 LPL CD4+ T 细胞中增加,尤其是在 Prdm1fl/flMaffl/flCd4Cre 小鼠中与对照感染小鼠相比增加最显著(图 4c)。
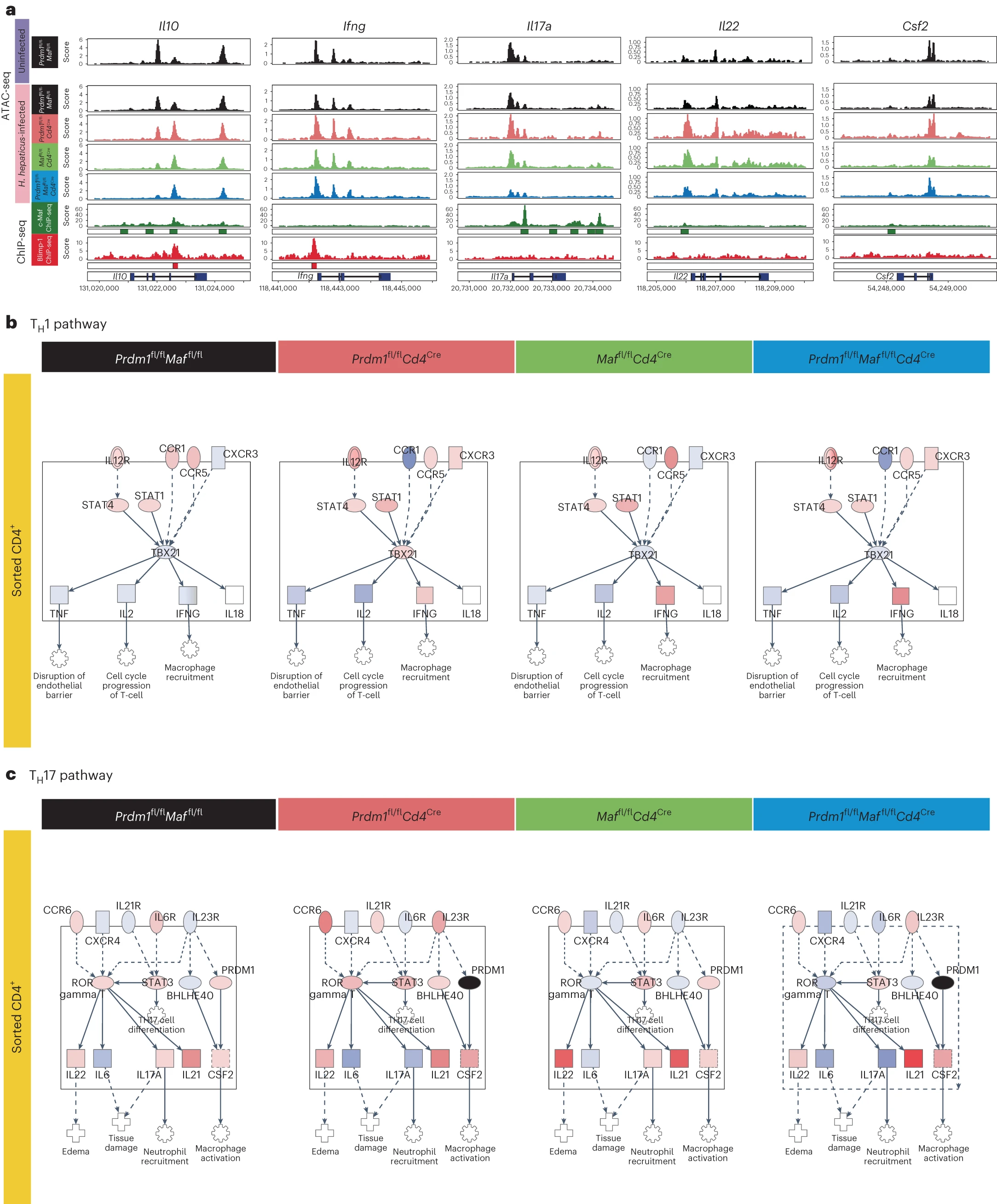
a, 在未感染的 Prdm1fl/flMaffl/fl 对照小鼠和感染 H. hepaticus 的 Prdm1fl/flMaffl/fl 小鼠以及通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠中,从结肠 LPL 中分离的 CD4+ T 细胞上进行了 ATAC-seq。每个条件下的 ATAC-seq 数据以及公开可用的 c-Maf(绿色)和 Blimp-1(红色)的 ChIP-seq 数据集在 Il10、Ifng、Il17a、Il22 和 Csf2 位点的基因组浏览器轨迹图。统计显著的 ChIP-seq 峰值(q < 0.05)分别用绿色或红色条表示在 c-Maf 和 Blimp-1 的标准化读取覆盖轨迹下方。
b,c, 使用 IPA 将排序的 CD4+ T 细胞 RNA-seq 数据叠加到 TH1(b)和 TH17(c)通路上。每个感染 H. hepaticus 条件相对于未感染的 Prdm1fl/flMaffl/fl 对照的基因表达变化叠加到了 TH1 和 TH17 通路上。所有条件间保持固定的标度,从 -5(蓝色)到 3.5(红色),并且在 Prdm1 缺陷的 T 细胞中,Prdm1 被着色为黑色。
T 细胞源的 Blimp-1 和 c-Maf 控制先天免疫¶
在 H. hepaticus 感染的 Maffl/flCd4Cre 小鼠的 LPL 中,“先天免疫和髓系相关”基因的平均表达量增加,在 Prdm1fl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中也有所增加,但程度较小(图 1f,g)。例如,编码肿瘤坏死因子 M(Oncostatin M)的 Il1a 和 Osm 基因(图 5b),这两者先前已与结肠炎相关联 11,28,29。此簇中的粒细胞相关基因,包括 Csf3r、Lcn2、S100a8 和 Cxcr2,在感染 Maffl/flCd4Cre 小鼠的 LPL 中表达最高,而在双重缺陷 Prdm1fl/flMaffl/flCd4Cre 和 Prdm1fl/flCd4Cre 小鼠中表达较少(图 5b)。同样,尽管在对照小鼠中,H. hepaticus 感染后粒细胞簇 7(图 1f,g)的平均基因表达量有所增加,但在感染的 Maffl/flCd4Cre 小鼠中进一步增加,在 Prdm1fl/flCd4Cre 感染小鼠中稍有增加,而在双重缺陷 Prdm1fl/flMaffl/flCd4Cre 感染小鼠中没有增加,显示出与 H. hepaticus 感染对照小鼠相似的水平(图 5c)。与粒细胞/中性粒细胞激活相关的基因,包括 Ncf2、Itgam、Mmp9 和 Padi4,在感染的 Maffl/flCd4Cre 小鼠的 LPL 中表达最高,而在 Prdm1fl/flCd4Cre 或双重缺陷的 Prdm1fl/flMaffl/flCd4Cre 感染小鼠中未见显著表达,这表明可能有由 Blimp-1 信号在 T 细胞中提供的潜在调控机制(图 5d)。此外,编码酶 aconitate decarboxylase 1 (Irg1) 的基因 Acod1,在髓系细胞中产生代谢物伊塔酸,该基因在感染的 Maffl/flCd4Cre 小鼠和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中表达最高(图 5d)。scRNA-seq 分析显示,粒细胞/中性粒细胞和髓系白细胞簇是感染的 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中 Il1a 和 Acod1 的来源(图 5e)。与粒细胞/中性粒细胞相关的基因,包括 Lcn2、S100a8、S100a9 和 Cxcr2,在 scRNA-seq 中仅在“粒细胞/中性粒细胞”簇中被检测到(图 5e)。尽管在感染对照小鼠中通过 scRNA-seq 检测到的少量粒细胞中观察到这些基因的基础表达,但在感染的 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中观察到这些与中性粒细胞相关基因的表达增加(图 5e)和粒细胞百分比及数量的增加(扩展数据图 2b,c)。与 scRNA-seq 数据一致,通过流式细胞术分析在感染的 Maffl/flCd4Cre 小鼠的 LPL 中观察到 Ly6G+CD11b+ 中性粒细胞百分比和数量的增加,而在双重缺陷 Prdm1fl/flMaffl/flCd4Cre 感染小鼠中增加较少,与未感染或感染对照小鼠以及感染的 Prdm1fl/flCd4Cre 小鼠相比,这些群体几乎无法检测(图 5f,g)。这一点通过结合 scRNA-seq 数据中的粒细胞特异性基因,如 Ncf2、Csf3r、S100a8 和 S100a9,以及先天细胞基因 Il1a、Il1b 和 Acod1 的基因表达和百分比的分析得到了加强,这些在感染的 Maffl/flCd4Cre 小鼠的 LPL 中达到最大值(图 5h)。在未感染和感染对照小鼠中,Ly6G−CD11b+ 髓系细胞数量较低,但在感染的 Prdm1fl/flCd4Cre 小鼠的 LPL 中,以及在 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中相比未感染或感染对照小鼠显著增加(图 5f,g)。这种髓系细胞的增加与在感染的 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中 Il1a、Il1b、Acod1 以及 Csf2ra 和 Csf2rb 的表达增加相一致(图 5e,h)。
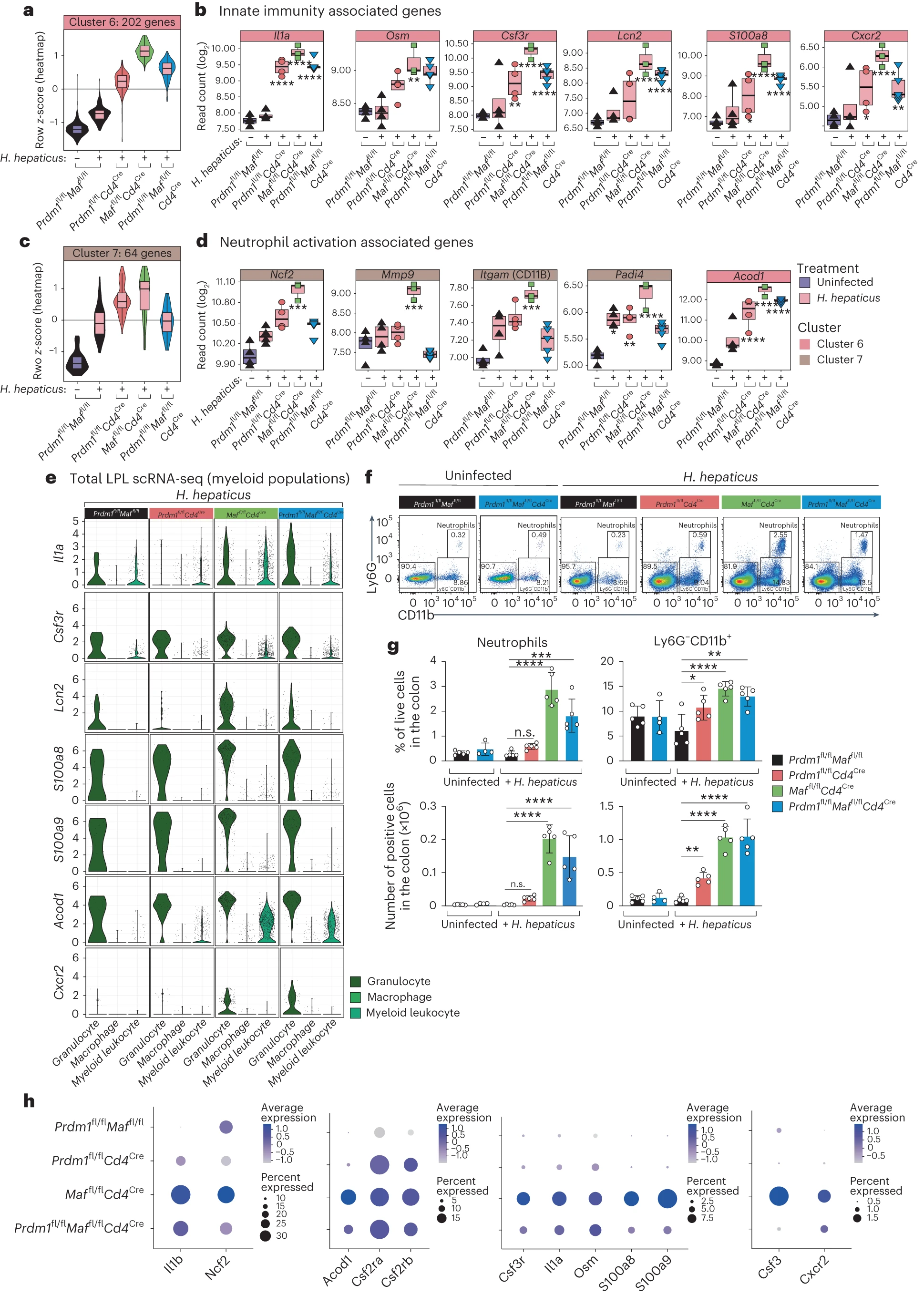
a-d,小提琴图和盒图总结了在第 1f 图中批量组织 LPL RNA-seq 数据分析的第 6 簇中发现的与先天免疫相关的基因的表达值(以 z 分数量化),以及第 7 簇中发现的与中性粒细胞激活相关的基因的表达值。每个条件相对于未感染的 Prdm1fl/flMaffl/fl 小鼠的差异表达基因(DEGs)标记如下(所有 P 值均经 BH 调整):*P ≤ 0.05; P ≤ 0.01; *P ≤ 0.001; *P ≤ 0.0001。e,查询在所有 H. hepaticus 感染条件下结肠 LPL scRNA-seq 数据集中的粒细胞、巨噬细胞和髓系白细胞簇中的选定先天免疫和粒细胞相关基因的表达。f,用于流式细胞术分析中性粒细胞(活体 CD90.2−TCR-β−CD19− CD11+Ly6G+)的代表性流图和分选策略,涵盖未感染的 Prdm1fl/flMaffl/fl 和 Prdm1fl/flMaffl/flCd4Cre,以及感染 H. hepaticus 的 Prdm1fl/flMaffl/fl 小鼠和通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠。g,从结肠固有层中中性粒细胞和 Ly6G−CD11b+ 细胞的百分比(顶部图表)和绝对细胞数(底部图表)的条形图。条形图中的每个点代表分析的单个小鼠。图表显示平均值,误差条,标准差。通过单向方差分析(ANOVA)后进行 Dunnett 事后检验分析(P ≤ 0.05; *P ≤ 0.01; **P ≤ 0.001; **P ≤ 0.0001)。数据来自 4-5 只小鼠。h,在感染 H. hepaticus 的对照 Prdm1fl/flMaffl/fl 小鼠和通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠的结肠 LPL 中选定基因 Il1b、Ncf2、Acod1、Csf2ra、Csf2rb、Csf3r、Il1a、Osm、S100a8、S100a9、Csf3 和 Cxcr2 的 scRNA-seq 基因表达的点图。点的大小代表每个细胞簇中表达该基因的细胞百分比,颜色标尺指示表达水平。
Prdm1 和 Maf 控制 T 细胞与髓系结肠细胞的相互作用¶
利用 CellChat 分析 scRNA-seq 数据识别的配体 - 受体对,如方法中所述,用于推断潜在的细胞间交流(图 6 和扩展数据图 7 和 8)。此研究中感兴趣的免疫细胞分析显示,来自 H. hepaticus 感染对照小鼠的 LPL 中 T 细胞 Ctla4 高表达群体与 B 细胞之间存在外向和内向的相互作用,而在感染的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中,髓系白细胞/巨噬细胞群体向 T 细胞 Ctla4 高表达群体传递增强的信号,反之亦然(图 6a)。这些发现通过结肠切片的免疫荧光染色得到验证(图 6b 和扩展数据图 9)。在 H. hepaticus 感染的 Prdm1fl/flCd4Cre 小鼠中,CD4+ T 细胞(白色)和 CD68+ 单核吞噬细胞(品红色)被发现增加并且彼此接近,而在 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 感染小鼠中更为显著(图 6b)。在 Maffl/flCd4Cre 感染小鼠中,阳性染色 MPO 的中性粒细胞最为丰富(图 6b),符合 RNA-seq 和流式细胞术数据,并且主要与 CD68+ 单核吞噬细胞和 CD4+ T 细胞共定位(图 6b)。在感染的 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠的 LPL 中,观察到髓系白细胞在外向和内向信号中的最大增加,其中包括强大的 CCL 和 CXCL 信号传递。推断 T 细胞 Ctla4 高表达群体向髓系白细胞的 Ccr1/Ccr5 传递强烈的 Ccl5 信号(图 6c,d),而髓系白细胞群体则被预测主要向 T 细胞 Ctla4 高表达群体的 Cxcr6/Cxcr3 传递强烈的 Cxcl16/Cxcl10 信号,突出了可能促进这些小鼠 LPL 中 CD4 T 细胞积累的潜在轴线(图 6c,d)。与 Cxcl2–Cxcr2 在中性粒细胞反应中的既定作用一致,推断髓系白细胞群体与粒细胞通过 Cxcl2–Cxcr2 轴的相互作用,并且在髓系白细胞群体内以及从髓系白细胞到粒细胞的强大 Ccl 交互作用也被检测到,在感染的 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/fCd4Cre 小鼠中(图 6c,d),可能促进了这些小鼠中中性粒细胞和髓系细胞数量的增加。尽管在感染对照小鼠中推断 IFNγ 信号从 NK 细胞传递给 B 细胞,但在感染的 Prdm1fl/flCd4Cre、Maffl/flCd4Cre 和双重缺陷 Prdm1fl/flMaffl/flCd4Cre 小鼠中观察到 T 细胞 Ctla4 高表达群体向髓系细胞和 B 细胞的外向信号(扩展数据图 8c)。在 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/fMaffl/fCd4Cre 小鼠中检测到髓系群体之间的 Csf1 信号传递(扩展数据图 8d),可能有助于增加髓系细胞和中性粒细胞。因此,Blimp-1 和 c-Maf 在 T 细胞中的转录调控失调可能导致 H. hepaticus 感染期间的病理变化,通过细胞间的细胞因子和趋化因子相互作用网络实现。
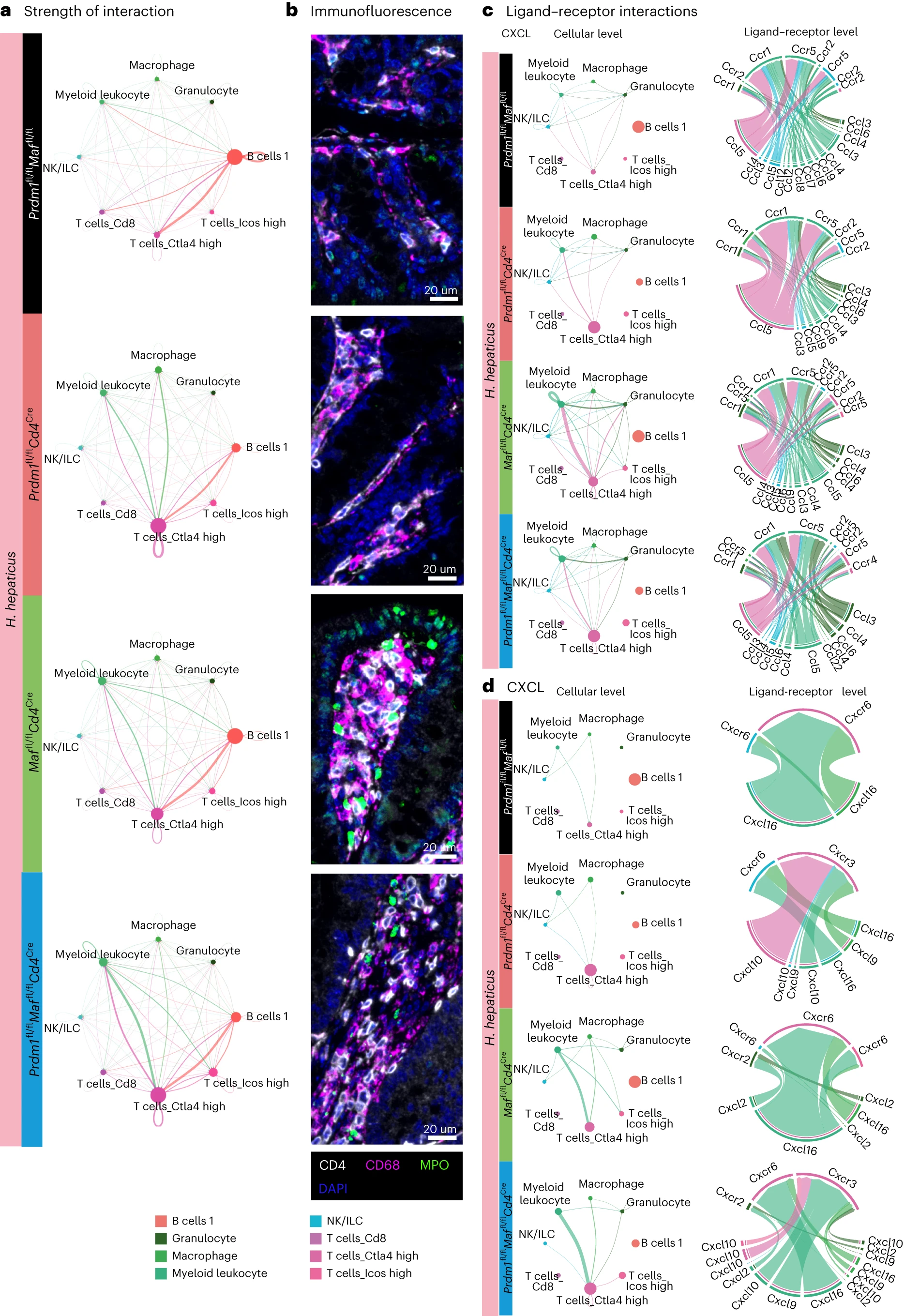
通过使用 CellChat 软件从结肠 LPL scRNA-seq 数据集中感兴趣的免疫细胞簇的配体及其受体的基因表达推断的细胞间通讯网络。a,表示在 H. hepaticus 感染的 Prdm1fl/flMaffl/fl 小鼠和通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠中细胞间相互作用的强度,用边缘宽度表示。b,代表性图像(n = 4-5),通过免疫荧光染色的结肠切片,标记 CD4+ T 细胞(CD4,白色)、单核吞噬细胞(CD68,品红色)、中性粒细胞(MPO,绿色)和核染色(DAPI,蓝色)来自 H. hepaticus 感染的 Prdm1fl/flMaffl/fl 小鼠和通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠。标尺为 20 微米。c,d,揭示 CCL(c)和 CXCL(d)通路下的细胞间通讯网络,涵盖所有 H. hepaticus 感染的 Prdm1fl/flMaffl/fl 小鼠和通过 Cd4Cre 介导删除 Prdm1、Maf 或 Prdm1 和 Maf 的小鼠。和弦图中,接收细胞位于顶部(内向信号),而发射细胞(外向信号)位于底部。边缘根据发射信号的细胞簇进行着色。在 a、c 和 d 中,节点大小与每个实验组中的细胞数量成比例,边缘根据发射信号的细胞簇进行着色。
在人类炎症性肠病(IBD)中,由 Blimp-1 和 c-Maf 调控的基因表达¶
从基因表达综合数据库(GEO)获取了克罗恩病和溃疡性结肠炎患者结肠活检的转录组数据(GSE193677 和 GSE126124)。通过模块分析显示与对照组相比上调或下调的基因簇。选择感兴趣的模块来查询我们的小鼠 LPL scRNA-seq 数据集,该数据集来自感染 H. hepaticus 的小鼠(图 7a,b,c 和补充表 8)。在人类 IBD 的“免疫效应器”模块中的基因,在感染 Prdm1fl/fCd4Cre 小鼠的小鼠 LPL scRNA-seq 簇中的“B 细胞 1”、“巨噬细胞/髓系白细胞”、“T 细胞 Ctla4 高”和“T 细胞 Icos 高”中表达较多,并且在 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/fMaffl/flCd4Cre 小鼠中表达更为显著(图 7d)。从人类“粒细胞、髓系”模块中的基因,这些基因在成人溃疡性结肠炎中表达更高,通常表现为结肠炎症,主要局限于小鼠 scRNA-seq 的“上皮”、“粒细胞”和“巨噬细胞/髓系白细胞”簇中,在 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/fMaffl/flCd4Cre 小鼠中表达水平最高(图 7e,f)。在 H. hepaticus 感染的双重缺陷 Prdm1fl/fMaffl/flCd4Cre 小鼠的 LPL 中表达水平最高的 T 细胞/ILC 相关基因(图 3)包含在这些人类 IBD 模块中,IFNG、CSF2、IL18R1、IL-12RB1、IL12RB2 和 IL23R 的表达在克罗恩病中增加,并且在溃疡性结肠炎中增加更显著(图 7f)。此外,在人类 IBD 的“免疫效应器模块”中,IL21 在溃疡性结肠炎中过表达(图 7f),并在 H. hepaticus 感染的双重缺陷 Prdm1fl/fMaffl/flCd4Cre 小鼠的 LPL 中表达量最高(图 7g),表明 IL-21 与 1 型反应相关。在感染 Maffl/flCd4Cre 小鼠的 LPL 中表达最高的 T 细胞/ILC 相关基因(图 3),包括 IL17A 和 IL17F,在人类 IBD 中也高度表达,特别是在溃疡性结肠炎中更为显著(图 7f,g 和补充表 8)。与髓系细胞和先天免疫相关的多个基因,我们之前显示在感染 Maffl/flCd4Cre 小鼠的 LPL 中表达最高(图 5h),在人类 IBD 中过表达,包括 IL1B、IL1A、CSF3、ACOD1、OSM、S100A8、S100A9 和 CXCR2(图 7f)。然而,ALPK2 在人类 IBD 中过表达,特别是在溃疡性结肠炎中(图 7f),在 Maffl/flCd4Cre 和双重缺陷 Prdm1fl/fMaffl/flCd4Cre 小鼠中表达相同(图 7g),而 CXCL10 在溃疡性结肠炎和克罗恩病中增加(图 7f),并在双重缺陷 LPL 中表达最高(图 7g)。在人类 IBD 的“粒细胞、髓系”模块中识别的其他基因,包括 NOD2、FCGR3 和 PROK2,这些在溃疡性结肠炎活检中表达最高(图 7f),在 Maffl/flCd4Cre 小鼠中表达最丰富(图 7g)。我们的发现表明,在人类 IBD 结肠活检中表达增加的基因,包括那些与克罗恩病和/或溃疡性结肠炎的增加风险相关的突变基因,如 NOD2、IL23R、IL21 和 IFNG11,在感染 H. hepaticus 的小鼠中特异性删除 Prdm1、Maf 或两种转录因子的 LPL 中表达差异显著,表明这些小鼠模型可能反映了人类 IBD 中相关的不同病理生物学机制。
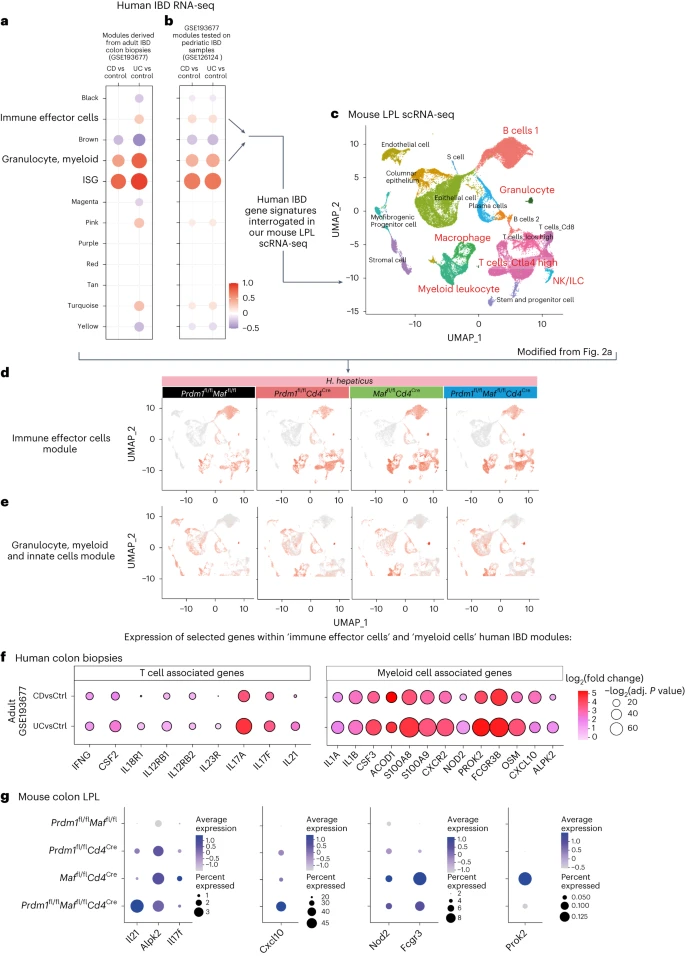
a, 利用 R 包 WGCNA 从成人IBD结肠活检(GSE193677)中导出共表达基因模块,并且 b, 在独立的儿童IBD数据集(GSE126124)中进行验证。CD代表克罗恩病,UC代表溃疡性结肠炎。在点图中,点的颜色和大小表示与对照相比在疾病中的富集倍数。重新命名的模块指示模块内基因相关的生物过程。富集得分是使用QuSAGE软件得出的;红色和蓝色分别表示模块内基因的过量和不足(与对照样本相比)。点的大小表示扰动程度(较大的点表示更高的扰动程度),且只有调整后的P值<0.05的模块被认为是显著的并在图中显示。
c, 然后在我们的小鼠结肠LPL scRNA-seq数据集中测试了“免疫效应细胞”和“粒细胞、髓系和先天细胞”模块中的基因富集情况。
d,e, 在我们的scRNA-seq UMAP中对“免疫效应细胞”(d)和“粒细胞、髓系和先天细胞”模块(e)进行评分。
f, 点图显示了在a和b中的模块与对照相比在人类IBD结肠活检中过表达的与T细胞相关或髓系细胞相关的基因。点的大小代表P值,而log2(倍数变化)由颜色标度指示。
g, 点图显示了在f中发现在人类IBD中过表达的选定基因的表达,在H. hepaticus感染的对照Prdm1fl/flMaffl/fl小鼠和通过Cd4Cre介导删除Prdm1、Maf或Prdm1和Maf的小鼠的结肠LPL scRNA-seq中。点的大小代表每个细胞簇中表达该基因的细胞百分比,表达水平由颜色标度指示。