Clonal associations between lymphocyte subsets and functional states in rheumatoid arthritis synovium
摘要¶
类风湿性关节炎(RA)是一种涉及抗原特异性 T 细胞和 B 细胞的自身免疫性疾病。本文对 12 名血清阳性 RA 患者的配对滑膜组织和血液样本进行了单细胞 RNA 和受体测序。我们发现克隆性扩增的 CD4+ T 细胞,包括 CCL5+ 细胞和外周辅助 T 细胞(Tph),这些细胞表现出近期激活和效应功能的显著转录组特征。CD8+ T 细胞比 CD4+ T 细胞显示出更高的寡克隆性,最大的滑膜克隆富含 GZMK+ 细胞。可能具有病毒反应性的 TCR 的 CD8+ T 细胞分布在不同的转录组簇中。在 B 细胞部分,NR4A1+ 激活 B 细胞和浆细胞在滑膜中富集并显示出显著的克隆扩展。我们识别出与滑膜 ABC、记忆和激活 B 细胞共享 BCR 的滑膜浆细胞。受体 - 配体分析预测了 IFNG 和 TNFRSF 成员作为滑膜 Tph-B 细胞相互作用的介质。综上所述,这些结果揭示了在 RA 患者滑膜中浸润的功能上不同的淋巴细胞群体之间的克隆关系。
简介¶
类风湿性关节炎(RA)中的滑膜炎症涉及免疫和非免疫细胞亚群之间的一系列复杂互动。在血清阳性 RA 的免疫反应中,一个核心特征是对瓜氨酸化蛋白的适应性免疫反应,涉及抗原特异性的 B 细胞和 T 细胞 1。RA 中 B 细胞的激活早已被人们所认识,因为疾病相关的自身抗体的特征性生产,包括类风湿因子(RF)和抗环瓜氨酸肽(抗 CCP)抗体 2,3,4,5。B 细胞可能在 RA 滑膜内局部激活,因为对滑膜组织的研究提供了体细胞高变异(SHM)和克隆扩展的证据 6,7。此外,CCP 和 RF 特异性 B 细胞可能经历不同的激活途径 8。滑膜 B 细胞还可以贡献抗体非依赖性功能,包括抗原呈递和细胞因子分泌,这涉及与其他细胞类型的互动 9,10,11,12。
T 细胞群体同样在 RA 滑膜炎症的启动和维持中起到了重要作用 13。基因关联表明,通过 MHC II 类向 CD4+ T 细胞呈递抗原在 RA 的发展中起关键作用 14,15。对 RA 滑膜组织和液体的细胞分型研究突出了大量的 T 外周辅助(Tph)细胞以及 T 滤泡辅助(Tfh)细胞,这两种细胞通过产生 IL-21 和 CD40L 为 B 细胞提供帮助 16,17,18,19。Tph 细胞与 Tfh 细胞在迁移模式上有所不同,前者表达趋化因子受体如 CCR2 和 CCR5 以归巢到外周炎症部位如类风湿关节 20,21。在 RA 滑膜内还积累了大量的 CD8+ T 细胞,其中一个显著的群体是表达颗粒酶 K 的细胞,可能通过产生炎症细胞因子而非细胞毒性来促进滑膜炎症 22。
除了对特定免疫细胞亚群的研究,单细胞 RNA 测序(scRNA-seq)对滑膜组织样本的图谱研究正在逐步呈现 RA 中免疫和非免疫群体的整体图景 23,24,25,26。这些研究突出了这些患者发炎组织中存在的细胞状态的多样性,以及这些状态的存在和效应如何在患者亚群中有所不同 25,26。对于淋巴细胞,T 细胞受体(TCR)或 B 细胞受体(BCR)的分析可以提供对淋巴细胞亚群扩展和发育关系的独特见解,因为每个新淋巴细胞都会生成一个独特的 TCR/BCR,并与其后代共享。此外,BCR 基因在抗原选择期间会经历体细胞高变异,这可以揭示 B 细胞的发育谱系。在 RA 患者中跟踪 TCR 在不同组织或纵向上的研究已经在不同关节中识别出共享的 T 细胞克隆 27,28,特定细胞亚群的克隆扩展 29,扩展克隆的持久性 30,以及可能表明共享抗原靶标的过度表达基因重排 28,31,32。然而,从 RA 滑膜 CD4+ T 细胞中扩展的 TCR 对瓜氨酸化肽的反应性一直难以证明 33。对 RA 患者的 BCR 谱系研究表明,RA 滑膜 B 细胞中存在体细胞高变异,并识别出从滑膜组织或液体中收集的 B 细胞的潜在特异性 6,34,35,36。尚未描述对滑膜组织淋巴细胞群体和血液中的 TCR 和 BCR 谱系进行单细胞水平的全面检查。这类研究有可能直接将克隆特征与特定淋巴细胞表型的功能作用、发育关系和细胞间相互作用联系起来,如在癌症免疫疗法和传染病的研究中所实现的那样 37,38,39,40。
在此,我们使用 5’基于液滴的 scRNA-seq 对 12 名 RA 患者的滑膜组织和匹配的外周血样本中的 T 细胞和 B 细胞同时研究其转录组和抗原受体谱系。我们的研究提供了高分辨率的克隆关系图景,涵盖了细胞状态内外以及发炎滑膜组织和外周血之间的关系。
结果¶
滑膜组织和外周血淋巴细胞的单细胞分析¶
我们收集了 12 名 RA 患者的滑膜组织样本(n=12)和匹配的外周血样本(n=10),这些样本是加速药物合作伙伴计划:类风湿性关节炎和系统性红斑狼疮(AMP RA/SLE)网络中分析的更大队列的一部分,优先考虑了滑膜细胞产量高且通过流式细胞术明显存在淋巴细胞群的样本 26。供体的平均年龄为 63.6 岁(范围 28-80 岁),主要为女性(n=11)。队列中的患者具有中度或高度的临床疾病活动指数(CDAI)分类,平均得分为 26.4(范围 10.5-64.0),主要为淋巴型,但在疾病持续时间、治疗和细胞类型丰度表型(CTAP)方面有一定的差异(补充图 1A 和补充数据 1)26,41,42。
组织样本先前已解离成单细胞悬液,以便使用 RNA 和细胞表面蛋白质分析进行 RA 滑膜中的细胞状态的无偏分析 26。初步分析后剩余的冷冻滑膜细胞被解冻并分类以分离 CD45+ CD3+ 和 CD45+ CD19+ 群体,这些群体随后被封装到液滴中并用于生成基因表达、细胞表面蛋白质和 TCR/BCR 单细胞测序库(图 1A 和补充图 1B)。已分类的 CD3+ T 细胞和 CD19+ B 细胞被加载以最大限度地捕获两种细胞系的数量(图 1E),并最小化基于不同淋巴细胞丰度的样本偏差(补充图 1C,D)。冷冻保存的 PBMCs 被解冻并平行分类。通过对所有样本进行统一的单细胞分析流程,我们共恢复了 84,750 个细胞。在应用 QC 标准后,剩下 83,159 个细胞,我们用它们进行了初步的低分辨率无监督聚类(图 1B 和补充图 2)。平均而言,我们每个滑膜组织样本获得 2888 个细胞(范围 804-5188 个),每个血样本获得 4851 个细胞(范围 3442-6601 个)(图 1C 和补充图 1A)。
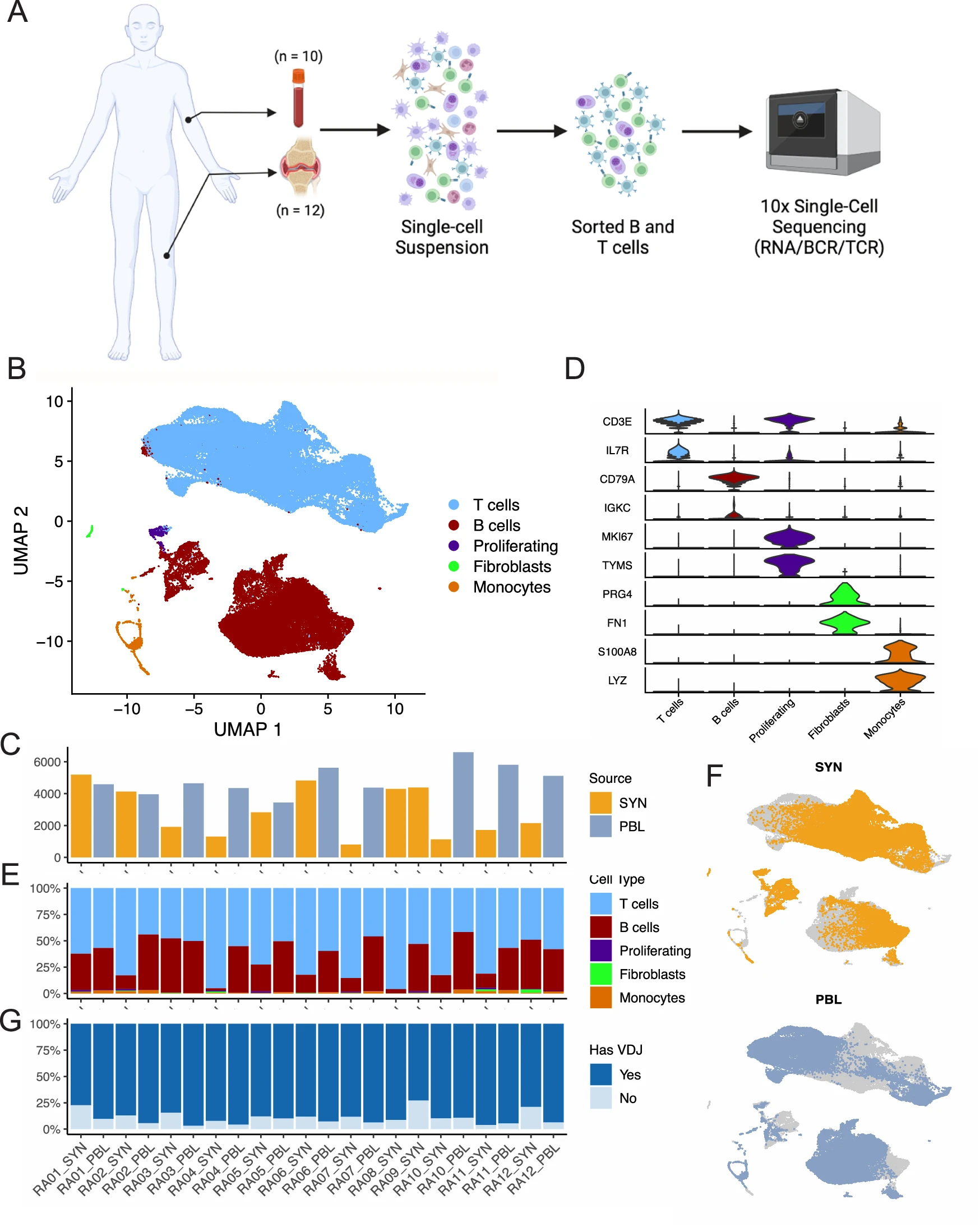
A 整体研究设计示意图。T 细胞和 B 细胞从滑膜组织活检(n=12)和匹配的外周血(n=10)中分离。使用 10X Genomics 平台生成了 5' 基因表达和受体谱系的单细胞文库。B 通过无监督聚类和 UMAP 投影的 83,159 个通过 QC 的细胞。C 每个样本回收的细胞数量条形图,颜色表示组织来源。D 小提琴图显示每个识别的细胞群体的选定标记物的表达分布。E 每个样本的簇组成条形图。F 结合聚类的 UMAP,上部为滑膜组织,下部为外周血。G 条形图突出显示每个样本的 VDJ 信息回收情况,不包括成纤维细胞和单核细胞群体。PBL 外周血淋巴细胞,SYN 滑膜组织。图 1A 由 BioRender.com 创建,依据 Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International 许可发布。通过平行检查基因表达和蛋白质检测,我们确定了几个表达标志物如 CD3E 和 IL7R 的 T 细胞群体,以及一个包含表达 CD79A 和 MS4A1(CD20)的 B 细胞和浆细胞的簇(图 1D 和补充图 3A、B)。这两个谱系的细胞可以在所有样本中找到(图 1E、F)。我们进一步确定了一个包含增殖 T 细胞和 B 细胞的簇,其特征是表达标志物如 MKI67 和 TYMS。最后,我们识别了两个稀有的污染细胞群体,分别表达成纤维细胞的标志物(PRG4 和 FN1)和单核细胞的标志物(S100A8 和 LYZ),这些细胞在后续分析中被排除(图 1D 和补充图 3A、B)。
在所有样本中捕获的 81,708 个淋巴细胞中,我们获得了 73,185 个细胞的配对 TCR 或 BCR 信息。在滑膜组织中,每个样本平均有 84.7% 的淋巴细胞具有相关的 TCR 或 BCR 信息(范围 72.9–96.1%),而在血液中,每个样本平均有 93.1% 的淋巴细胞具有此信息(范围 89.3–96.8%)(图 1G 和补充图 3C)。
滑膜组织和血液中 CD4+ T 细胞群体的差异丰度¶
对从滑膜组织和血液样本中获得的 35,301 个 CD4+ T 细胞进行亚簇分析,识别出 14 个 CD4+ T 细胞亚群(图 2A、B,补充图 4A 和补充数据 2)。我们确定了两个表达 B 细胞趋化因子 CXCL13 的簇,其中一个完全由 Tph 细胞组成,而另一个包含一些可检测到 CXCR5 的细胞,表明该簇包含 Tfh 和 Tph 细胞的混合体(补充图 4B、C)16,24,26。两个簇都表达与 B 细胞帮助相关的基因,如 MAF,并且都在 Tfh 细胞基因签名中得分较高(补充图 4B、D 和补充数据 3)。虽然 Tfh/Tph 簇显示出比 Tph 簇更高的 IL7R 和 CD69 标志物表达,但 Tph 簇显著提高了 PDCD1、CTLA4、LAG3 等的表达。此外,纯 Tph 亚群在 TCR 信号和 T 细胞激活的基因评分上比其他 CD4+ 簇更高,这表明该簇中的细胞是活化的(图 2C,补充图 4D、E 和补充数据 3)。
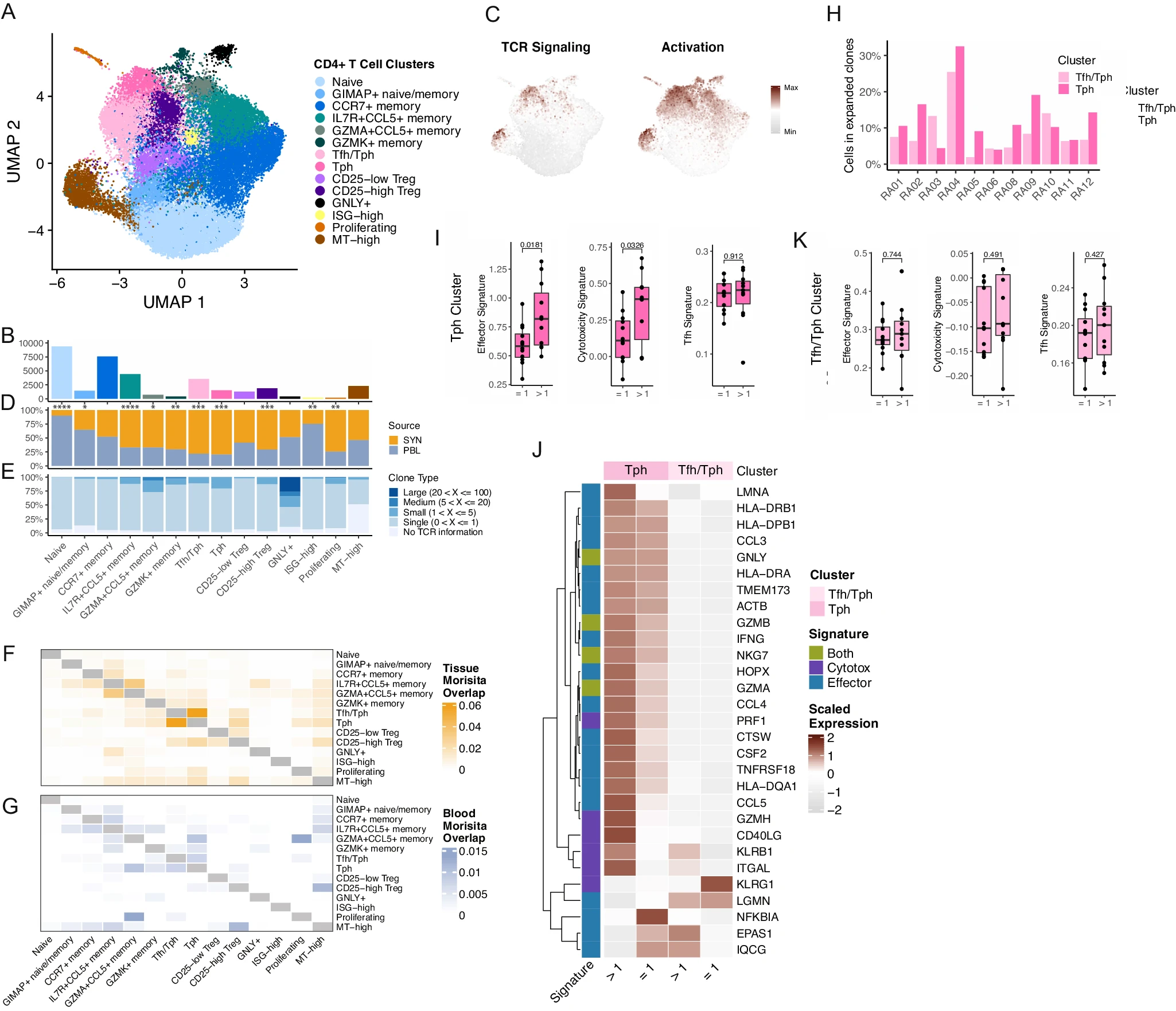
A CD4+ T 细胞重新聚类的 UMAP 投影。B 每个簇中包含的细胞数量条形图。C TCR 信号(左)和激活(右)特征的 UMAP 投影。D 每个簇中细胞的组织分布条形图,显著性由双侧配对 T 检验确定(Naive, p=2.22E-08; GIMAP+ naive/memory, p=0.0202; CCR7+ memory, p=0.886; IL7R+ CCL5+ memory, p=2.03E-05; GZMA+ CCL5+ memory, p=0.329; GZMK+ memory, p=0.00571; Tfh/Tph, p=0.000125; Tph, p=0.000666; CD25-low Treg, p=0.0758; CD25-high Treg, p=0.000205; GNLY+, p=0.808; ISG-high, p=0.00164; Proliferating, p=0.00332; MT-high, p=0.19)。E 每个簇的克隆大小分布条形图。F, G 通过 Morisita 指数计算的滑膜组织(F)和血液(G)成对克隆重叠值的热图。H 每个供体中发现扩展的滑膜组织 Tph 和 Tfh/Tph 细胞的百分比条形图。I 扩展和非扩展 Tph 细胞的效应子特征(左)、细胞毒性特征(中)和 Tfh 特征(右)的分布箱线图。每个点代表一个供体(n=12),P 值通过配对 T 检验确定。J 比较扩展和非扩展 Tph 和 Tfh/Tph 细胞的效应子和细胞毒性特征基因平均表达的热图。K 扩展和非扩展 Tfh/Tph 细胞的效应子特征(左)、细胞毒性特征(中)和 Tfh 特征(右)的分布箱线图。每个点代表一个供体(n=12),P 值通过配对 T 检验确定。对于 I 和 K,箱线图的下缘和上缘分别对应于第一个和第三个四分位数(第 25 和第 75 百分位数),上须从第 75 百分位数延伸到不超过边缘 1.5 倍四分位距(IQR)的最大值,下须从边缘延伸到不超过下边缘 1.5 倍 IQR 的最小值,中位数为中心线。
我们还发现了其他几类记忆细胞,它们具有趋化因子、趋化因子受体和颗粒酶的独特表达,包括 CCR7+(可能代表中心记忆细胞)、IL7R+ CCL5+、GZMA+ CCL5+ 和 GZMK+ 群体。此外,我们还鉴定出一个细胞毒性 CD4+ T 细胞群体,标志物为 GNLY、PRF1 和 GZMB 的表达,以及一个具有强烈干扰素反应特征的簇。一个可能包含混合的初始和记忆细胞的小群体,主要通过 GIMAP 家族成员(如 GIMAP4、GIMAP5)的高表达来区分,这些成员与淋巴细胞的存活和静止状态有关(补充数据 2)43。
亚簇分析还揭示了两类调节性 T 细胞(Tregs)。两类细胞都表达 FOXP3、CTLA4 和 TIGIT,但一个群体表现出较强的 IL2RA(编码 CD25)和 IL32 的表达,而另一个群体则显示出较高的 CCR7 和 TCF7,分别表明存在效应和中心记忆样 Tregs44。一个包含表达 SELL、TCF7 和 CCR7 的初始 T 细胞的大簇显示了先前鉴定的初始 T 细胞基因集的最强表达特征 45(补充图 4B-E)。最后,还检测到一个活跃增殖的细胞簇,以及一个具有高水平线粒体编码 RNA 的亚群(补充图 4B-E)。总之,本次聚类分析鉴定的 T 细胞群体与先前通过 RNA 和细胞表面蛋白质分析对更大滑膜组织样本集(本研究的 12 个滑膜样本是其中一部分)进行分析所鉴定的群体很好地一致(补充图 4F)26。
接下来,我们识别了在滑膜组织或外周血中差异表达的 T 细胞亚群。几个记忆/效应细胞群体在滑膜中比在血液中更丰富,包括 Tph、Tfh/Tph、CD25-high Treg、IL7R+CCL5+ 记忆、GZMA+CCL5+ 记忆、GZMK+ 记忆和增殖簇(图 2D 和补充图 4G)。相比之下,血液样本中包含更多的初始、GIMAP+ 和干扰素刺激的簇。平均而言,每个血液样本中 45% 的 CD4+ 细胞来自初始簇(范围 18-66%),而只有 5% 的滑膜组织 CD4+ T 细胞具有初始表型(范围 2-15%)。因此,与血液相比,在 RA 滑膜中富集了一系列具有不同转录组特征的记忆/效应 T 细胞群体。
克隆性扩展的 Tph 细胞显示出增强的效应和细胞毒性特征¶
接着,我们对滑膜组织和血液中的 CD4+ 群体的 TCR 谱系进行了研究。在 CD4+ 群体中,GNLY+ 细胞毒性簇显示出最高的克隆扩展,几乎包含了所有大于 20 个细胞的克隆。尽管分析的细胞数量可能影响检测到的克隆大小,但值得注意的是,GNLY+ 簇的丰度低于其他 CD4 簇(图 2B),但仍然可以检测到克隆扩展。定义为两个或更多具有相同 TCR 的细胞的克隆扩展,也在 Tph 和 GZMA+CCL5+ 记忆簇中被鉴定(图 2E 和补充图 4H、I)。对滑膜组织簇间克隆共享的分析显示,Tph 和 Tfh/Tph 簇之间存在高度的克隆重叠,表明这些簇中的细胞尽管在转录组上有所不同,但在发育上是相关的(图 2F、G)。通过将 Tfh/Tph 簇细分为具有和不具有可检测 CXCR5 转录本的细胞,我们鉴定出一组既存在于 CXCR5+ Tfh 细胞中又存在于 Tph 簇中的克隆(补充图 4J)。此外,滑膜 Tph 簇与循环簇的克隆重叠度最高,突出了滑膜组织内 Tph 群体的活跃增殖。我们还鉴定出一些来自血液的 T 细胞,其 TCR 与滑膜 Tph 或 Tfh/Tph 细胞匹配;这些血液 T 细胞最常见于血液 Tph 或 Tph/Tfh 簇中(补充图 4K)。总体而言,血液 CD4+ T 细胞簇的克隆共享模式与滑膜中总体相似,但重叠度较低,其中 GZMA+CCL5+ 亚群与增殖中的血液 CD4+ T 细胞的克隆重叠度最高(图 2F、G)。
在识别了在滑膜组织中高度代表性、克隆扩展且活跃增殖的 Tph 群体后,我们试图找出克隆扩展和未扩展的 Tph 细胞在组织中的区别。在供体中,平均 12.5% 的 Tph 细胞属于扩展的 TCR 克隆(范围 4-32.5%)(图 2H)。通过比较这些细胞与属于未扩展克隆的 Tph 细胞的转录差异,克隆扩展的 Tph 细胞显示出显著增加的效应功能和细胞毒性特征,包括 IFNG、PRF1、CD40LG 和 CCL5 的高表达(图 2I、J)。相比之下,扩展和未扩展细胞之间的 Tfh 基因特征评分没有差异,表明克隆扩展的 Tph 细胞并未失去其 B 细胞帮助功能。有趣的是,使用 Tfh/Tph 簇中的细胞进行类似比较,结果没有显著差异,进一步表明 Tph 簇中的细胞具有一组独特的特征(图 2K)。
不同组织类型中扩展的 CD8+ T 细胞克隆通过 GZMK 和 GZMB 的表达模式有所不同¶
接下来,我们分离并亚簇了滑膜组织和血液样本中的 CD8+ T 细胞,揭示了在所有样本中都存在的九个 CD8+ T 细胞群体(图 3A、B,补充图 5A 和补充数据 2)。其中,三个群体通过 GZMK 和 GZMB 的表达模式区分开来,所有这些群体都与最近一项滑膜组织研究中鉴定的簇有很强的对应关系(补充图 5B、C)26。一个簇仅表达 GZMK,而另一个簇表达 GZMK 和低水平的 GZMB。这两个群体也表现出较高的 GZMA 和 CCL5,而 GZMK/B+ 簇通过包括 CCL4 和 HLA-DRA 在内的标志物的高表达和 IL7R 的低表达进一步区分。第三个群体仅表达 GZMB,通过基因模块分析显示出高度的细胞毒性,并具有高水平的 GNLY 和 PRF1 的表达(补充图 5B-D)。我们还分离出一个可能的驻留记忆 CD8+ T(Trm)细胞群体,其特征是 ZNF683 和 XCL1 的高表达,通过检查先前发布的 Trm 基因列表,并与最近描述的滑膜 Trm 细胞一致(补充数据 3)46,47。我们鉴定出一个高表达 SELL 和 LEF1 且具有初始基因模块特征的初始 CD8+ 群体(补充图 5B-D)。还鉴定出另一个可能的初始细胞群体,其特征是高表达 IGTB1 和 LMNA。最后,我们发现了 CD8+ T 细胞的不同簇,分别具有高水平的干扰素反应、增殖或线粒体基因模块(补充图 5B-D)。
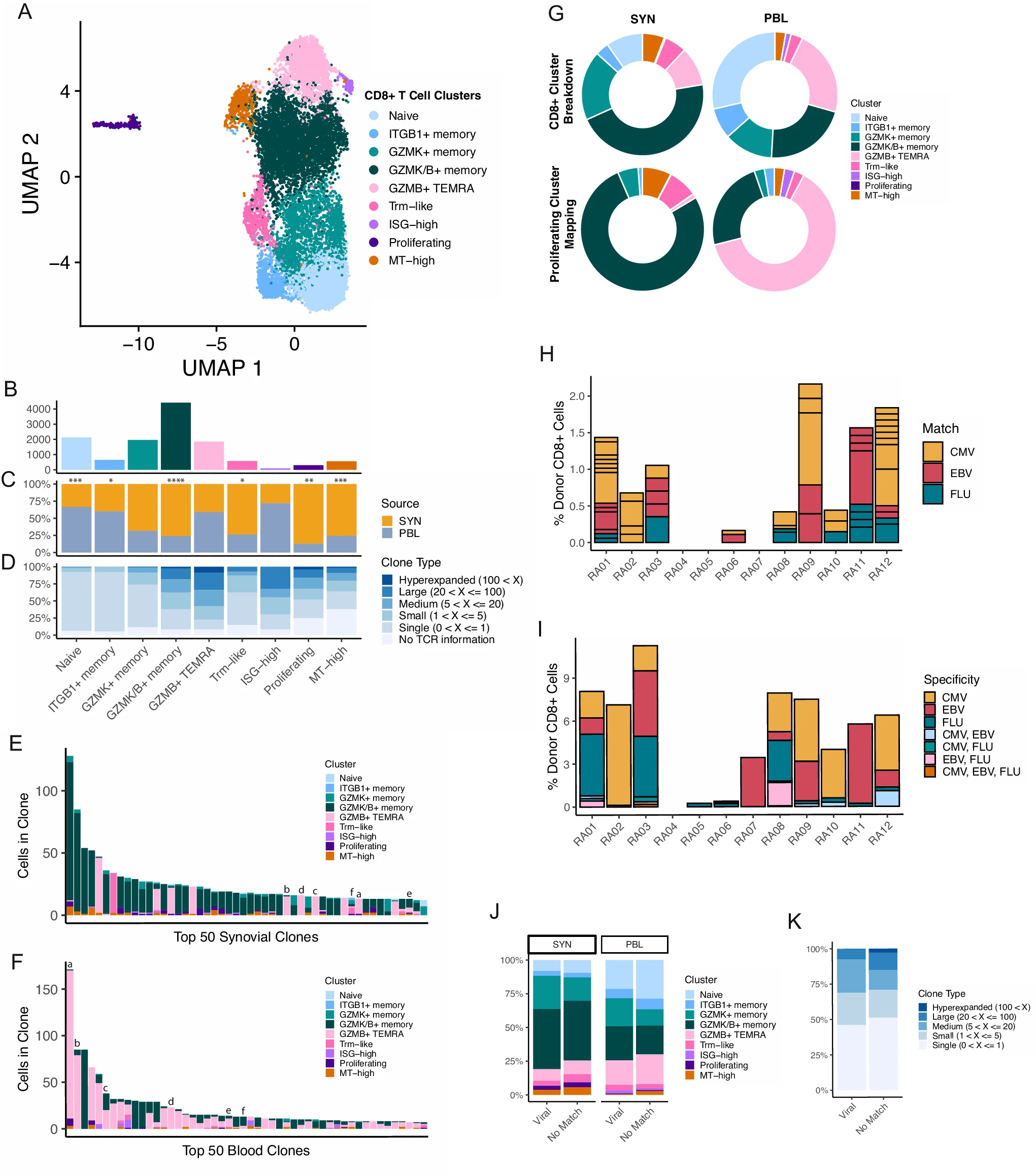
A CD8+ T 细胞重新聚类的 UMAP 投影。B 每个簇中包含的细胞数量条形图。C 每个簇中细胞的组织分布条形图,显著性由双侧配对 T 检验确定(Naive, p=0.000306; ITGB1+ memory, p=0.04; GZMK+ memory, p=0.0523; GZMK/B+ memory, p=9.16E-05; GZMB+ TEMRA, p=0.148; Trm-like, p=0.0473; ISG-high, p=0.304; Proliferating, p=0.00697; MT-high, p=0.000885)。D 每个簇的克隆大小分布条形图。E, F 分别为滑膜组织(E)和血液(F)中前 50 个扩展克隆的克隆大小和簇分解条形图。条形图上方的字母表示滑膜组织和血液间共享的克隆。G 甜甜圈图展示了增殖簇映射比例与一般簇比例的比较。H 每位患者中确切的病毒反应匹配的 CD8+ 细胞百分比条形图,按病毒分开显示。框大小表示克隆的大小。I 每位患者中具有 GLIPH2 模式匹配病毒反应性克隆的 CD8+ 细胞百分比条形图,按病毒分开显示。J 按组织来源分开的 GLIPH2 模式病毒反应匹配和非匹配细胞的簇分布条形图。K GLIPH2 模式病毒反应匹配和非匹配细胞的克隆大小分布条形图。
分析滑膜组织和外周血样本间簇代表性发现,GZMK/B+ 簇在滑膜组织样本中显著增加(图 3C 和补充图 5F),与最近的报道一致 22。仅表达 GZMK 或 GZMB 的簇在组织区隔间的丰度没有显著差异,尽管 GZMK+ 记忆群体在滑膜组织中趋于更高,而 GZMB TEMRA 簇在血液中略有升高(补充图 5F)。此外,Trm、增殖和线粒体高簇在滑膜组织样本中代表性提高。相比之下,初始和 ITGB1-elevated 群体在血液中的频率较高(图 3C 和补充图 5F)。
在表征 CD8+ 群体中的细胞状态后,我们试图将这些簇的克隆属性联系起来。总体上,我们发现 CD8+ 区隔中的克隆扩展程度远高于 CD4+ 亚群。我们发现 GZMK/B+ 记忆和 GZMB+ TEMRA 簇中的克隆扩展最强,同时也注意到 ISG-high 和增殖簇中的细胞属于扩展克隆(图 3D 和补充图 5G)。比较滑膜组织和血液中前 50 个最大克隆,揭示了簇组成的显著差异。滑膜组织中前 50 个克隆的细胞几乎全部属于 GZMK/B+ 记忆群体。相比之下,血液中前 50 个克隆的细胞大部分属于 GZMB+ TEMRA 簇,其他群体代表性较少(图 3E、F)。对最大克隆的分析以及对组织中亚簇间克隆重叠的更广泛检查,显示滑膜组织中的 GZMK/B+ 记忆簇与增殖细胞之间存在共享,而 GZMB+ TEMRA 与血液中的增殖成分重叠(补充图 5H、I)。为进一步分析,我们将增殖簇分为子集并将这些细胞映射到数据集的其他 CD8+ 细胞上。与一般簇比例相比,组织和血液增殖细胞分别映射到 GZMK/B+(201/261 组织增殖细胞)和 GZMB+ TEMRA(24/38 血液增殖细胞)簇,表明这两个群体在其不同组织中可能起着活跃但不同的作用(图 3G)。
对组织间克隆重叠的进一步检查显示,GZMK/B+ 记忆或 GZMB+ TEMRA 簇的组织和血液成分之间只有少量共享,但滑膜组织 GZMK/B+ 细胞与血液 GZMB+ TEMRA 细胞之间的克隆重叠基本不存在(补充图 5J)。在两种组织区隔中的前 50 个克隆中,只有 6 个可以在两者中找到,几乎全部在血液中的数量比滑膜组织多。值得注意的是,这些克隆中有四个即使在滑膜组织中仍保留 GZMB+ 偏斜(图 3E、F)。这些结果表明滑膜组织中的扩展 GZMK/B+ 细胞和血液中的 GZMB+ TEMRA 细胞具有功能上不同的角色。这些发现支持最近的研究,表明 GZMK/B+ 细胞可能并非以 GZMB+ 细胞毒性 T 细胞的形式到达滑膜组织后改变其表型,而是可能以 GZMK+ 细胞形式进入滑膜或在组织中局部扩展并采用包括 GZMK 表达的表型 22。
预测的病毒交叉反应性 CD8+ T 细胞未显示出扩展或表型特征的变化¶
病毒感染长期以来被认为可能导致和维持自身免疫性疾病 48。引发这种现象的一种可能性是病毒和内源蛋白之间存在交叉反应表位,这可能驱动一组 T 细胞的激活和扩展。我们试图在滑膜组织中识别可能的病毒特异性 T 细胞,以评估 RA 滑膜 CD8+ T 细胞中潜在病毒交叉反应性的程度。为此,我们收集了先前鉴定的 CMV、EBV 和流感 A 特异性 T 细胞数据库 49,50。然后,我们通过 beta 链 CDR3 序列和 HLA 在这里分析的 RA 滑膜 CD8+ T 细胞与数据库中的那些进行精确匹配(补充图 6A)。尽管三名 RA 患者(RA04、RA05 和 RA07)表达较少见的 HLA 等位基因(补充数据 5),阻止了与先前发现的特定克隆进行匹配的能力,但我们能够在大多数患者中识别到匹配的克隆(图 3H 和补充图 6B)。在患者之间和患者内部,我们进一步发现这些匹配指向所测试病毒的多个不同表位(补充图 6C)。在检查这些匹配 T 细胞属于哪个簇时,我们发现这些细胞分布在各个簇中,没有一个簇显著超过非匹配细胞(补充图 6D)。此外,我们注意到很少有匹配克隆是扩展的(16/56),最大的匹配克隆仅包括七个细胞。相比之下,对血液中的 CD8+ T 细胞分析得出了类似的结果,具有可比较数量的病毒反应性 T 细胞,并且病毒反应性细胞所代表的细胞表型也具有类似的广泛分布(图 3J 和补充图 6E、F)。
要求克隆序列和 HLA 的精确匹配可以提供对病毒反应能力的有力证据;然而,识别病毒特异性 T 细胞与我们数据集中那些细胞之间共享的模式可能允许识别具有检测病毒表位潜力的更大一组 T 细胞。因此,我们使用 GLIPH2 识别在 beta 链 CDR3 序列中富含病毒特异性 T 细胞和我们的 CD8+ T 细胞的模式 51。分别使用每种病毒(CMV、EBV 和流感)对 RA 滑膜 T 细胞运行 GLIPH2 算法后,我们过滤了包含病毒和 RA 克隆且具有 HLA 匹配的模式(补充图 6G)。我们获得了更多属于病毒相关 GLIPH 模式的克隆(369 个独特克隆)相比于我们的精确匹配(56 个独特克隆),这在供体之间是可变的(图 3I 和补充图 6H、I)。为了加强数据中匹配的关联性,我们试图识别患者年龄与潜在病毒反应性 CD8+ T 细胞百分比之间的关系。尽管没有显著相关性,但我们发现供体年龄与潜在 CMV 和 EBV 反应性克隆百分比之间的趋势,这与年龄相关的抗病毒库动态一致 52,53(补充图 6J)。与精确匹配的结果类似,匹配细胞和非匹配细胞的簇组成细分再次显示滑膜 CD8+ T 细胞之间没有显著差异,对血液 CD8+ T 细胞也得出了类似结果(图 3J)。此外,我们发现这些两组之间的克隆大小分布没有差异,也没有在前 50 个滑膜组织克隆中发现属于病毒 GLIPH 模式的克隆(图 3K)。
在 RA 滑膜中鉴定活化的先天性 T 细胞群体¶
先前已报道 RA 中存在先天性 T 细胞群体,包括自然杀伤(NK)细胞、γδ T 细胞和粘膜相关不变 T(MAIT)细胞,尽管许多这些亚群在 RA 中的明确角色仍不清楚 54,55,56,57。我们在滑膜组织和血液样本中鉴定并亚簇了先天性 T 细胞,得到了代表多种先天性谱系的七个亚群(图 4A,补充图 7A、B 和补充数据 2)。两类 γδ T 细胞群体,包括表达 TRDV1 的 Vδ1 亚群和表达 TRDV2 和 TRGV9(通常与 TRDV2 配对的 TCR γ 可变基因)的 Vδ2 亚群 58。Vδ1 群体表现出高水平的 GZMB 和 TIGIT 表达,而 Vδ2 细胞则有较高的 TYROBP 水平。在先天性细胞中还鉴定了 MAIT 细胞,表达标志物包括 SLC4A10、AQP3 和 ZBTB16(图 4B 和补充图 7C)。检测到两类 NK 细胞,包括 CD56-dim 和 CD56-bright 亚群,它们与 scRNA-seq 参考中的相应 NK 群体一致(补充图 7D)26。这些 CD3- 亚群并未在本研究的排序方案中预期包含,因此其频率可能不反映这些样本中的真实代表性。除了这些簇,我们还发现一个以 ZNF683(编码 Hobit)表达为特征的群体,似乎包含 γδ 和 NK 细胞,以及一个具有高线粒体基因表达的先天性细胞群体(补充图 7C)。比较滑膜组织和外周血中这些群体的频率,只有 Vδ1 亚群在滑膜中显著增加,滑膜组织中 T 细胞的平均比例为 2.1%(范围 0.1-4.5%),血液中为 0.5%(范围 0.1-1.4%)(图 4C 和补充图 7E)。
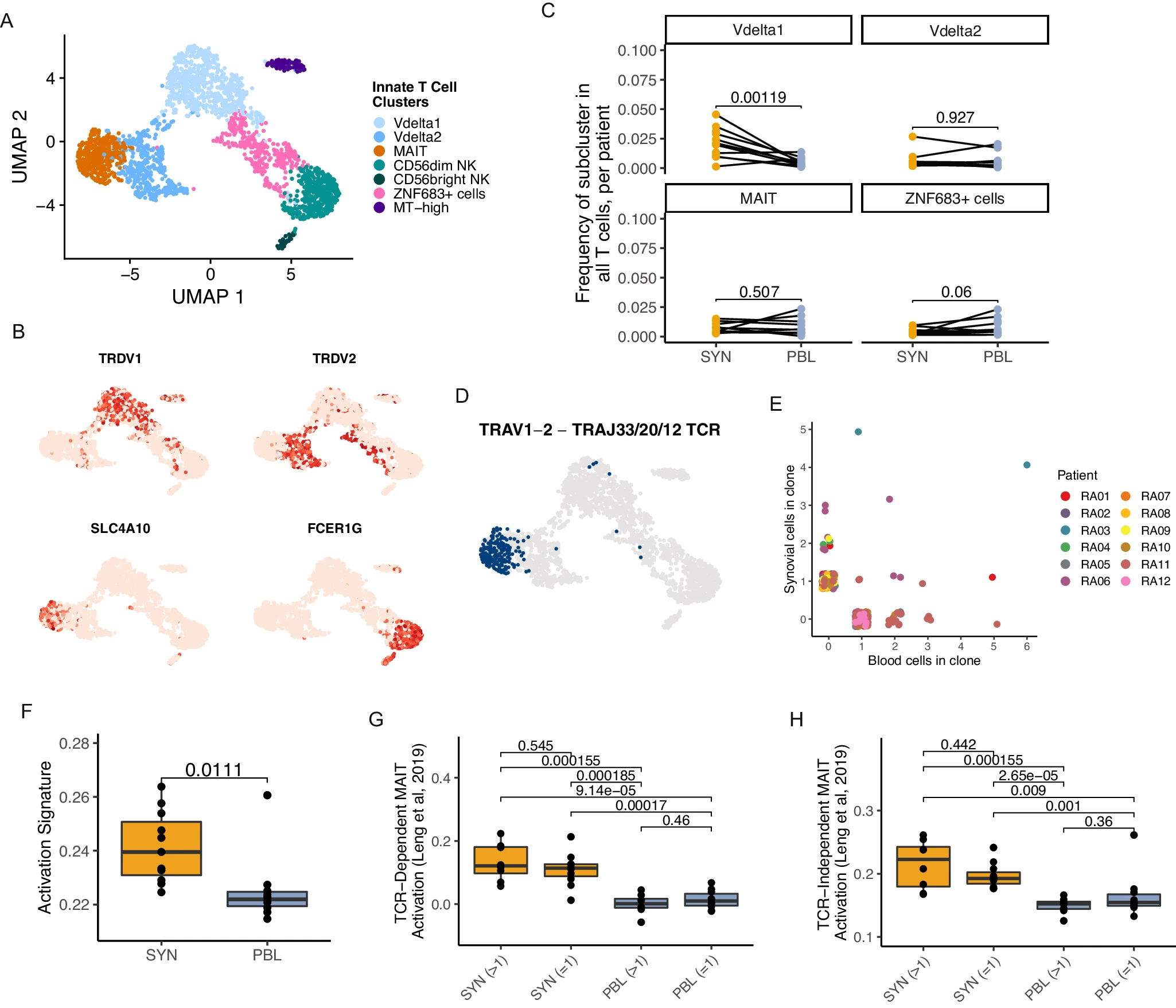
A 先天性 T 细胞重新聚类的 UMAP 投影。B 选择的先天性 T 细胞谱系标志基因表达水平的 UMAP 图。C 对每个选择的簇,细胞代表性的频率是样本中所有 T 细胞的比例。每个点代表一个样本,线条表示供体的配对血液和组织(n=12 名供体)。显著性通过配对 T 检验确定,并进行多重检验校正。D 高亮显示具有 TRAV1-2 和 TRAJ33、20 或 12 基因重排的先天性 T 细胞的 UMAP 图。E 按患者颜色标记的不同组织来源的每个 MAIT 细胞克隆大小的散点图。F MAIT 细胞簇中的活化特征箱线图。G, H 分别展示来自 Leng 等人 2019 年的 TCR 依赖(G)和非依赖(H)的 MAIT 细胞活化特征,按组织和克隆扩展进行分割。每个点代表一个样本(n=12)。显著性通过使用 Holm 校正的配对 Wilcox 检验计算。对于 F-H,箱线图的下缘和上缘分别对应于第一个和第三个四分位数(第 25 和第 75 百分位数),上须从第 75 百分位数延伸到不超过边缘 1.5 倍四分位距(IQR)的最大值,下须从边缘延伸到不超过下边缘 1.5 倍 IQR 的最小值,中位数为中心线。
利用数据集的谱系信息,我们通过检查 TCR α 链重排确认了 MAIT 细胞的存在。MAIT 群体的特征是使用 TRAV1-2,通常伴有 TRAJ33、TRAJ20 或 TRAJ12 重排 59。TRAV1-2 和 TRAJ33/20/12 基因重排的配对可以在超过一半的簇中具有相关 TCR 的细胞中检测到,而在数据集中其他 T 细胞中则基本不存在(图 4D 和补充图 7F、G)。然后我们试图在组织和血液之间克隆追踪这些 MAIT 细胞,发现扩展克隆在组织中独特存在,以及在滑膜和血液中都有的克隆亚群(图 4E 和补充图 7H)。
为了表征这些组织中克隆扩展和非扩展 MAIT 的转录差异,我们检查了活化特征。滑膜 MAIT 细胞的活化评分高于血液中的 MAIT 细胞(图 4F)。Vδ1 和 Vδ2 细胞也观察到类似的模式(补充图 7I)。因为已知 MAIT 细胞通过 TCR 依赖和非依赖机制进行活化 60,了解这与组织间差异的关系对于更好地解读这些细胞在 RA 滑膜中的潜在作用是相关的。来自多个独立来源的 TCR 依赖和非依赖 MAIT 活化基因特征显示滑膜中的两种机制得分显著高于血液 61,62。滑膜组织中的克隆扩展和非扩展 MAIT 细胞在两种机制的特征评分上均高于其血液对应物,但在两种组织中扩展和非扩展亚群之间未检测到显著差异,表明滑膜组织中的 MAIT 细胞亚群可能通过 TCR 依赖和非依赖机制活化(图 4G、H,补充图 7J、K 和补充数据 3)。总之,这些转录组和谱系数据提供了强有力的证据,表明 RA 滑膜中存在一个明确的、显得活化的 MAIT 细胞群体。
滑膜中富集的活化 B 细胞¶
类似于 T 细胞分析,我们通过亚簇分析 27,869 个 B 细胞,得到八个 B 细胞和两个浆细胞群体(图 5A-C,补充图 8A-C 和补充数据 2)。我们将其中四个群体注释为初始亚群,基于其相对较高的初始标志物表达,如 IgD 和 TCL1A,以及与血液和扁桃体中的初始 B 细胞强烈映射,在已发表文献中有记载(图 5E)并且在 RA 滑膜组织中通过 RNA 和表面蛋白质表达最近鉴定(补充图 8B)26。两个初始 B 簇通过 IgD 表达水平(初始 -IgD- 低,初始 -IgD- 高)区分。初始 -IgD- 低群体还表现出更高的 FCER2(CD23)。另外两个初始簇具有较高的 HSPA1B 表达(初始 -HSPA1B+)或较高的线粒体读取(初始 -MT- 高),并且与初始 B 细胞状态的映射较弱(图 5E 和补充图 8B、D)。这两个簇是滑膜中主要的初始群体。初始 -HSPA1B+ 具有激活表型,除了 HSPA1B 外,还上调 NR4A1 和 DNAJB1。鉴于 ZEB2 和 ITGAX(CD11c)的上调(补充图 8D、E),这一亚群类似于在红斑狼疮患者血液中扩展的激活初始 B 细胞 63。其他六个簇是非初始的,并主导滑膜中的 B 细胞。平均而言,每个血液样本中 64.5% 的 B 细胞来自初始簇(IQR 59.5–86.7%),而只有 9.1% 的滑膜组织 B 细胞具有初始表型(IQR 5.5–12.0%)。我们识别了一个表达记忆标志物的记忆 B 细胞簇,包括 CD27、TNFRSF13B、S100A10 和 S100A4(图 5B 和补充图 8C–E)。这个记忆簇映射到外周血记忆 B 细胞特征(图 5E)以及 26 中描述的交换记忆群体(补充图 8B)。最后,根据 V(D)J 测序,超过 60% 的血液和超过 75% 的滑膜记忆 B 细胞是类交换的(图 5H)。
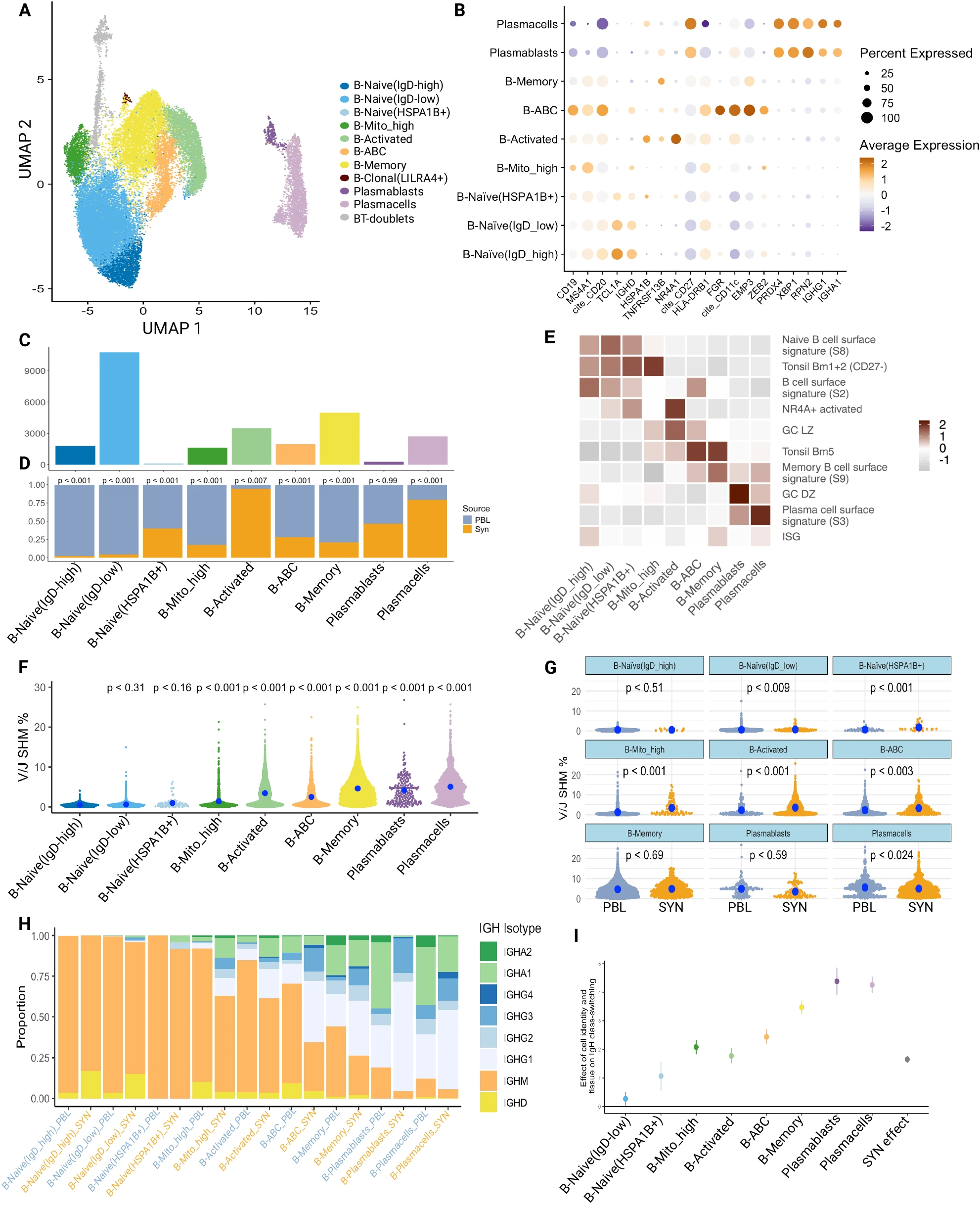
A B 细胞聚类的 UMAP 投影。未标记的灰色细胞(“NA”)由于高表达 CD3E 和高双重得分被称为 B-T 双重体;这些细胞在下游分析中被省略。标记为 B-Clonal(LILRA4+)的群体也由于细胞数量少且仅在两个血液样本中发现而被省略。B 注释簇时使用的显著标记物的点图。C 每个簇中包含的细胞数量条形图。D 每个簇内的组织分布条形图。显著性通过使用 MASC 的双侧混合效应模型确定,显示在补充图 8D 中。E 显示选定基因特征模块评分的热图。通路选定基因的热图见补充图 10A。F 量化各簇之间 SHM 速率差异的图(血液和滑膜细胞合并)。P 值通过带有供体随机效应的双侧线性混合效应模型评估。参考群体设为 B-Naive(IgD-high)。蓝点表示中位数。G 量化各群体内组织之间 SHM 速率差异的图。P 值通过带有供体随机效应的双侧线性混合效应模型评估。H 每个簇在质量控制后按组织分裂的生产性免疫球蛋白重链(IgH)同种型使用的条形图。I 效应大小(点的中心)和 95% 置信区间(误差条)的混合效应逻辑回归模型图,该模型将细胞的类交换状态(IgG 或 IgA ->“类交换”,IgM 或 IgD ->“未类交换”)回归到其表型和组织来源。随机效应包括供体(n=12 名供体),B-Naive(IgD-high)设为参考群体,PBL 设为参考组织来源。PBL 外周血淋巴细胞,SYN 滑膜组织。
附加的 B 细胞群体包括年龄相关 B 细胞(ABCs)、活化 B 细胞和 LILRA4+ B 细胞。年龄相关 B 细胞(ABCs)表达典型标志物 CD11c 和 FCRL5,如之前描述的那样(图 5B 和补充图 8C)24,26,63,64,以及其他 ABC 标志物如 TBX21(T-bet)和 ZEB2(图 5B 和补充图 8D)。有趣的是,ABC 簇中差异表达最高的基因之一是 IFI30,这突显了干扰素信号激活作为 ABCs 原位驱动的潜力(补充图 8C)。B 细胞活化簇基于 NR4A1 的高表达、相关的早期反应和生发中心轻区(GC LZ)基因进行注释(图 5B、E 和补充数据 3)。值得注意的是,ABCs 和活化 B 细胞均显示出类交换重组的证据(图 5H、I),与先前的报告一致 7,63。另一个小 B 细胞群体根据高 BCR 克隆性和高 LILRA4 以及 G 蛋白信号分子被命名为克隆 -LILRA4+。这个小群体仅在三个 PBL 样本中出现,89 个细胞中有 87 个属于一个样本,因此在下游分析中被省略。我们使用 XBP1 和 CD27 表达来识别浆母细胞(XPB1+CD27int)和浆细胞(XBP1+CD27hiIgA+IgG+)。浆母细胞也映射到 GC 暗区(GC DZ)特征(图 5E),可能反映出高增殖状态(特定基因见补充图 9A)。两个群体均表现出高水平的类交换重组和 SHM(图 5F-I 和补充数据 3)。
接下来,我们测试了每个群体在血液和滑膜中的富集情况。所有群体在血液和滑膜以及多个供体中都有发现(补充图 8A)。滑膜中活化 B 细胞和浆细胞显著更多。相比之下,Naive-IgD-low、Naive-IgD-high、B-memory 和 Naive-MT-high 簇在血液中显著富集(图 5D 和补充图 10D)。我们接着通过进行 GSEA 来识别滑膜和血液 B 细胞的差异特征(补充图 10B)。滑膜中的许多 B 细胞群体在与细胞激活和细胞因子介导的信号通路相关的 GO 通路中富集(补充图 10B)。前者与滑膜中 B 细胞的整体激活状态一致。有趣的是,任何滑膜 B 细胞状态中最显著的细胞因子介导的信号通路富集在浆母细胞中,表明细胞因子信号在组织中浆母细胞生成中的关键作用(补充图 10B)。
滑膜 B 细胞中的体细胞高变异和类交换的积累¶
本数据集的一个独特特征是能够将精确的 BCR 序列与转录组定义的滑膜和配对血液中的 B 细胞状态匹配。因此,我们可以确定哪些群体获得了 SHM,这些变异的性质,以及组织和血液之间的差异。如预期的那样,记忆 B 细胞和浆母细胞/浆细胞具有显著水平的 SHM。另一个有趣的发现是,活化 B 细胞和 ABCs 相比参考的 Naive-IgD-high 群体也具有更高水平的 SHM(图 5F)。
然后我们比较了各群体的血液和滑膜细胞之间的 SHM 速率(图 5G)。有趣的是,三个初始样 B 细胞群体——Naive-IgD-low、Naive-HSPA1B+ 和 Naive-MT-high——在滑膜中的突变率显著高于血液,表明如我们最近描述的那样,原位初始 B 细胞激活的光谱 7。值得注意的是,ABCs 和活化 B 细胞群体在滑膜中也表现出显著更高的突变,表明原位激活和选择。唯一在血液中突变率显著更高的群体是浆细胞。Naive-IgD-high、记忆和浆母细胞未显示组织特异性突变差异的显著性(图 5G)。
此外,我们还检查了每个细胞群体内以及血液和滑膜细胞之间发生的类交换量。滑膜 B 细胞状态在所有群体中,除了 Naive-IgD-high B 细胞外,相比其血液对应物表现出显著更多的类交换 BCR(IgG 或 IgA+,IgD-)(图 5H)。所有细胞群体显示出类交换 BCR 量的统计显著增加,相比类交换最少的群体:Naive-IgD-high B 细胞(图 5I)。值得注意的是,超过 50% 的滑膜 ABCs 显示出类交换的证据,这与在正常免疫反应中生成的 ABCs 是记忆 B 细胞子集的新概念一致 65,66。还值得注意的是,滑膜 ABCs、浆母细胞和浆细胞相比其血液对应物具有非常不同的 IgH 同种型使用,滑膜中的 IgA 更少而 IgG 更多(图 5H)。
滑膜 B 细胞中的原位抗原暴露和克隆扩展证据¶
使用我们数据集中恢复的 BCR,我们通过量化其 IgH CDR3 序列之间的相似性识别出克隆相关的 B 细胞组。作为这种分析的第一种方法,我们采用严格的 96.5% 序列同源性来识别克隆。这是为了识别相同的克隆,从而建立细胞状态之间的发展关系。如健康个体血液 B 细胞谱系分析中所报告的那样,高度突变的细胞群体产生了更大的 B 细胞克隆(图 6A、B)67。例如,几乎从所有样本中恢复的浆母细胞和浆细胞(补充图 8A)相比其他群体具有更高比例的大克隆(20-100 个细胞),这与抗原驱动的克隆扩展一致(图 6A、B)。对于浆母细胞/浆细胞,克隆扩展在血液中比在滑膜中更为显著(图 6B)。这表明滑膜中的浆细胞与循环中浆细胞经历不同的选择压力,这也得到了不同的 IgH 同种型表达的支持(图 5H)。在滑膜中,除了浆细胞外的 B 细胞群体主要是单个体或在活化 B 细胞、ABCs 和 MT-high 中较小的克隆(2-5 个细胞)。总体上,克隆扩展和更高的 SHM 的存在与这些更活跃的 B 细胞群体中刺激和 T 细胞帮助的提供一致。此外,与抗原经验丰富的 B 细胞谱系一致,活化 B 细胞和 ABCs 在滑膜和血液中均具有更短的 CDR3 长度和更高的整体电荷(补充图 10A)68。在血液中,克隆主要也是单个体,但在活化、记忆、MT-high、ABCs 和 Naive-HSPA1B+ B 细胞中检测到小型、中型甚至大型克隆的比例(图 6B)。
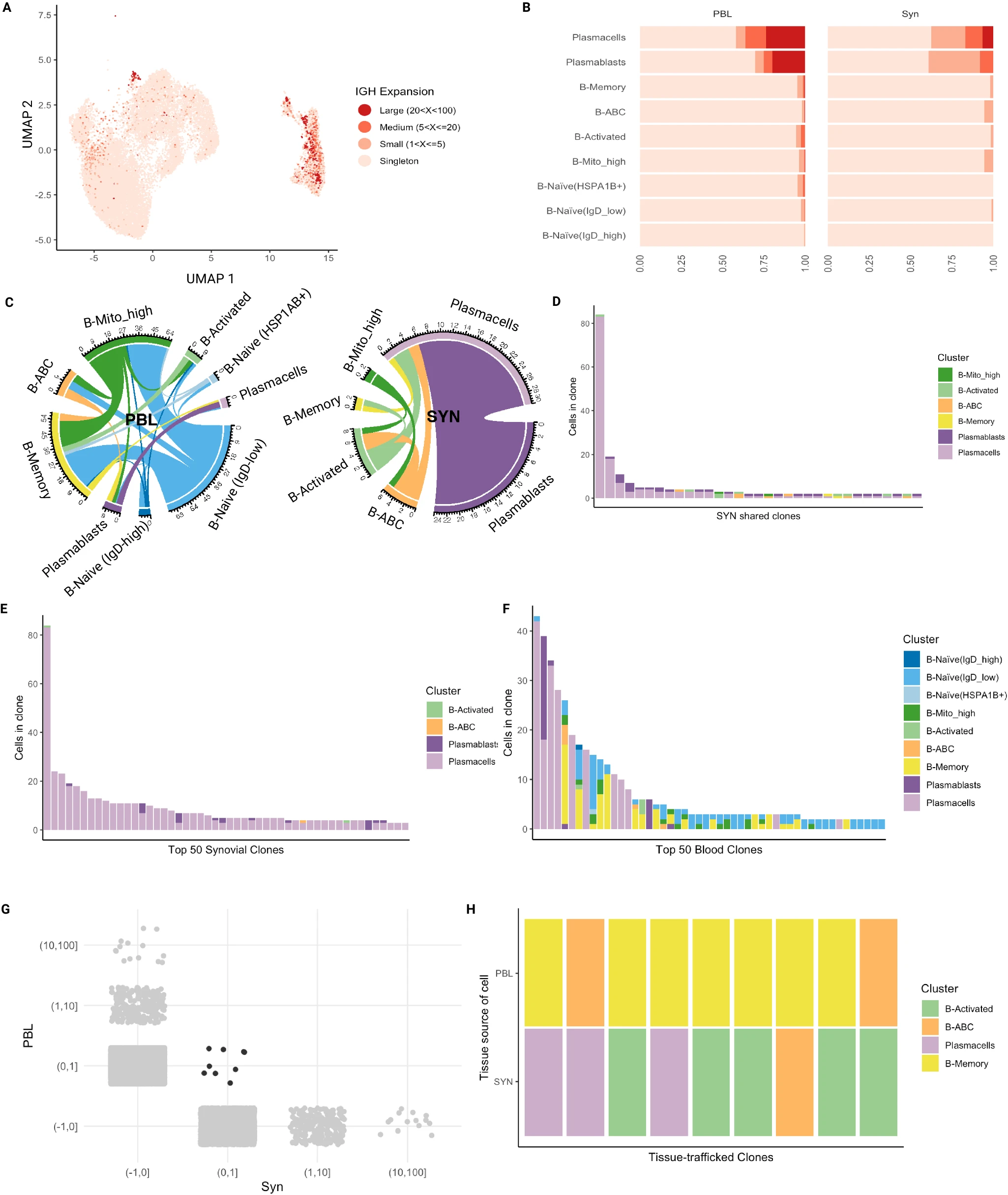
A B 细胞中由 IgH 定义的克隆扩展的 UMAP 投影。没有 BCR 的细胞未包含在此图或本图中的其他图中。B 显示每个簇的克隆大小比例按组织分裂的条形图。C 显示细胞群体之间克隆共享的 Circos 图,按组织区隔分裂。边缘的颜色对应于拟议的起源群体。D 显示由两个或更多 B 细胞状态共享的每个滑膜克隆的细胞身份和克隆大小的条形图。E 显示滑膜中 50 个最大的克隆及其细胞群体组成的条形图。F 显示血液中 50 个最大的克隆及其细胞群体组成的条形图。G 显示每个组织中克隆分布(灰色)和在组织间共享的克隆(黑色)的图。H 组织转移克隆的细胞群体组成图(G 中的黑色克隆)。PBL 外周血淋巴细胞,SYN 滑膜组织。
为了评估不同细胞类型之间的克隆关系,对于包含两个不同细胞类型成员的每个克隆,报告了扩展克隆成员的共现情况。尽管绝大多数克隆包含在特定群体内,但我们确实发现了一些共享于不同群体之间的克隆。图 6C 描绘了每个区隔内群体之间的克隆共享情况。在滑膜内,浆细胞和浆母细胞共享大量克隆(24 个克隆,图 6C),强烈支持新生成的浆母细胞和更成熟的浆细胞之间的发育关系。值得注意的是,我们还观察到 ABCs 和活化 B 细胞之间以及这些 B 细胞状态和浆细胞之间共享的克隆。少量克隆也在 MT-high B 细胞状态和活化 B 细胞及 ABCs 之间共享(图 6C、D)。总体而言,这些数据表明,从 Naive-MT-high(一种已经显示出抗原刺激迹象的初始 B 细胞群体,基于较高的 SHM 速率,相对于静止的初始 B 细胞——图 5F)到 ABCs 和活化 B 细胞途径的发育关系,以及这些细胞状态之间及其向浆细胞的下游发育关系。此外,记忆 B 细胞与活化 B 细胞和浆细胞共享克隆,表明记忆 B 细胞参与滑膜免疫反应(图 6C、D)。在外周血中,多种细胞状态之间有更多的克隆共享(图 6C)。这在比较血液和滑膜中 50 个最主要克隆的细胞群体组成时也很明显(图 6E、F)。例如,第 5 个扩展的血液克隆在 ABCs、浆母细胞、Naive-IgD-low、MT-high 和记忆 B 细胞中都有发现(图 6F)。相比之下,滑膜中 50 个最主要的克隆主要集中在浆细胞上(图 6E)。虽然克隆在滑膜和血液之间共享,但这些克隆没有扩展(图 6G)。组织转移克隆在浆细胞、ABCs 和活化及记忆群体中发现,与这些 B 细胞在两个区隔之间的某些迁移一致(图 6H)。有趣的是,血液和组织之间共享的克隆具有不同的表型(图 6H)。例如,有多个案例显示血液中的记忆 B 细胞在滑膜中成为活化 B 细胞或 ABCs 或浆细胞,再次强烈表明记忆 B 细胞参与滑膜免疫反应。
为了识别滑膜中克隆扩展和未扩展 B 细胞的区别特征,我们进行了 GSEA 分析。我们将这项分析集中在浆母细胞和浆细胞上,因为其他细胞状态的克隆数量有限。克隆扩展的浆母细胞相比未克隆扩展的细胞显示出增加的 BCR 信号、细胞因子介导的信号和对细胞因子的响应特征表达(补充图 11)。
我们使用较低的 IgH CDR3 DNA 序列相似性 80% 重复了克隆相关 B 细胞的分析 69。这里的重点是生成和分析克隆谱系,以开始绘制原位免疫反应。使用这种方法,在血液和滑膜中的多个细胞状态中检测到更多的小克隆(比较图 6B 和补充图 12A、B)。滑膜中更多的细胞状态间也检测到更多的共享克隆,现在从 Naive-IgD-low 开始并频繁跨越三个或更多群体(比较图 6D 和补充图 12C)。与 96.5% 同源性分析一样,滑膜中扩展最多的克隆在浆母细胞和浆细胞区隔(比较图 6E 和补充图 12D)。在 80% 同源性下定义的克隆谱系中,识别出更多的组织转移克隆(比较图 6G、H 和补充图 12E、F),再次显示血液和组织克隆之间的细胞状态转变的例子。B 细胞谱系树的例子突显了从 Naive-IgD-low 到 ABCs、活化和浆细胞的发育关系(补充图 12G、H)。
识别滑膜中 T 细胞和 B 细胞通信模式的变化¶
鉴于 BCR 信号、B 细胞激活和细胞因子响应与滑膜分析中富集和克隆扩展的 B 细胞的关联,我们接着系统地调查潜在的 T 细胞 -B 细胞相互作用。我们使用 CellChat70 构建细胞 - 细胞通信网络,初步重点是评估 CD4+ T 细胞亚群与总 B 细胞之间的通信差异,以评估首先解读已知互动的技术的可行性。增殖、Tph 和 Tfh/Tph 亚群与 B 细胞的显著相互作用数最多(图 7A)。检测到的 Tph-B 细胞和 Tfh/Tph-B 细胞对之间的显著 CXCL13-CXCR5 相互作用与先前报告一致,并支持分析方法的性能 16。进一步检测到 Tph-B 对之间的显著 IFNG-IFNGR 相互作用,而不是 Tfh/Tph-B 对之间的相互作用,这与 Tph 簇相比 Tfh/Tph 簇中 IFNG 的增加表达一致(补充图 13A、B)。然后我们生成了使用 CD4+ T 细胞亚群和 B 细胞亚群的推断通信网络。检查每个群体的累计输入和输出互动,确定 Tph 群体在两个方向上都有较高的信号,而 ABC 群体有任何簇中最强的输出信号(补充图 13B)。对这些 CD4+ T 细胞和 B 细胞群体之间显著互动的成对分析发现,增殖簇与所有 B 细胞亚群的预测互动最多,尽管这可能反映了增殖细胞的异质性。除了增殖簇外,Tph 细胞与 ABC、浆母细胞、记忆和克隆 B 细胞群体之间的互动显著增加。每对的显著互动数比任何其他 CD4+ 群体都高,表明 Tph 簇的信号潜力增加(图 7B)。
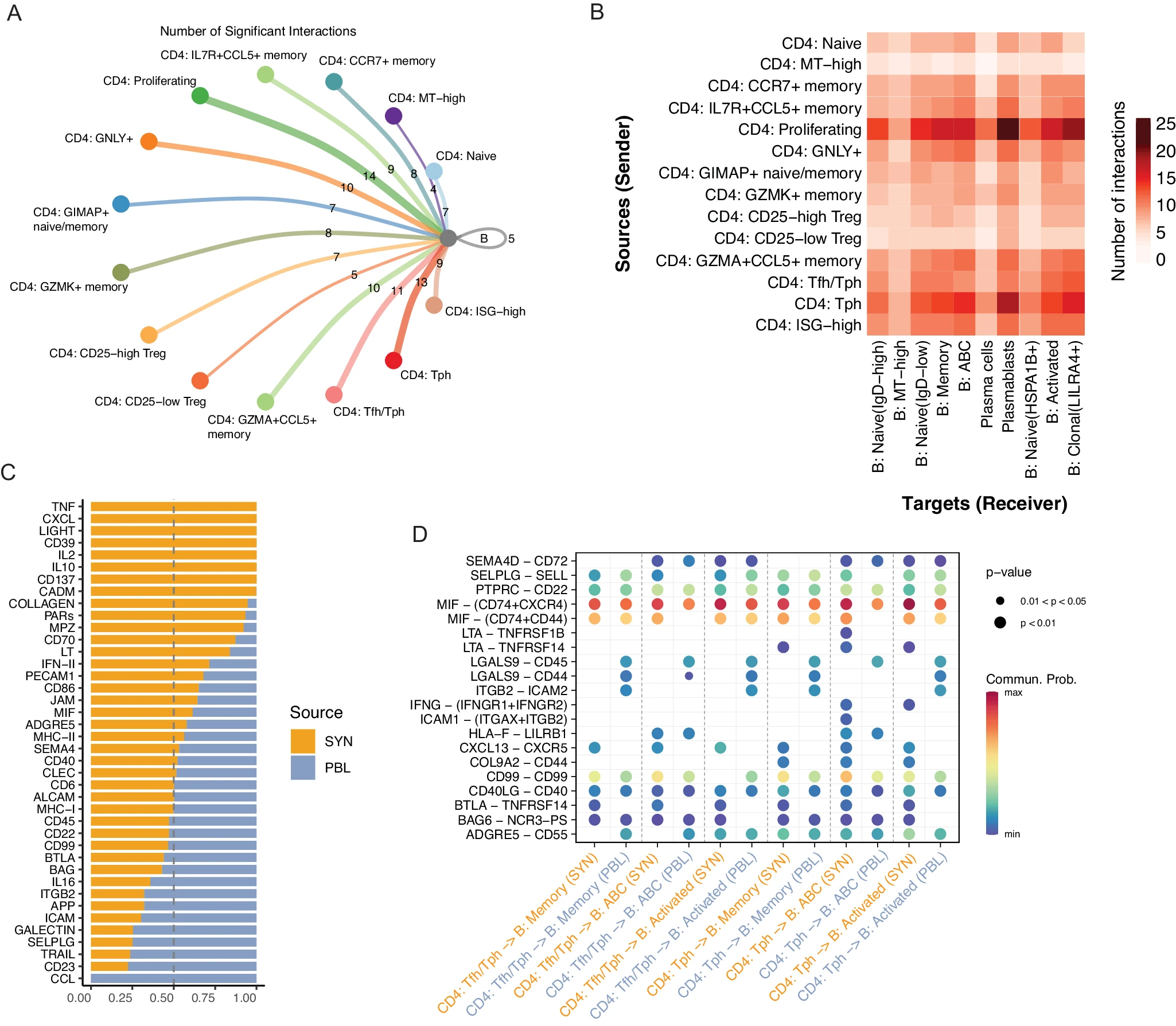
A 圆圈图显示了在 CD4+ T 细胞亚群和 B 细胞之间识别的显著细胞 - 细胞相互作用的数量。B 热图显示了识别的显著细胞 - 细胞相互作用数量,CD4+ T 细胞亚群作为发送者,B 细胞亚群作为接收者。C 条形图显示了在滑膜组织或血液中检测到的信号通路比例。D 点图显示了通过置换测试(n = 100 次置换)评估的 Tph 或 Tfh/Tph 细胞与 ABC、记忆或活化 B 细胞之间的显著相互作用,按组织分裂。
接下来,我们利用数据集的跨组织特性比较了滑膜组织和血液中 T 细胞 -B 细胞信号传导的差异。我们为每个组织生成了一个单独的通信网络,两者都返回了大致相似数量的显著相互作用,但滑膜组织中稍微高一些(补充图 13D)。在滑膜组织中,TNF、CXCL 趋化因子、IL-2 和 IFN II 型信号通路家族的水平较高,这些共同突显了组织的炎症和免疫激活状态。与血液中的信号相比,滑膜组织中表达较少的信号通路包括 CCL、SELPLG、ICAM 和 ITGB 通路家族,这些通常在血液中迁移的细胞中表达(图 7C)。最后,我们试图识别滑膜组织中 Tph 或 Tfh/Tph 细胞与 ABC、记忆或活化 B 细胞之间升高的细胞 - 细胞相互作用。在所有分析的配对中,BTLA-TNFRSF14(HVEM)和 CXCL13-CXCR5 相互作用在滑膜中相比血液中均显著升高。相比之下,ITGB2-ICAM2 和 LGALS9-CD44/45 相互作用在大多数血液配对中较高。在比较 Tph-B 亚群和 Tfh/Tph-B 亚群之间的不同相互作用时,LTA-TNFRSF14(HVEM)在所有滑膜 Tph-B 细胞配对中均有发现,但在 Tfh/Tph-B 细胞配对中没有。在滑膜中,IFNG-IFNGR 是 Tph/ABC 和 Tph/活化 B 细胞配对中的显著相互作用,而 LTA-TNFRSF1B(TNFR2)仅在 Tph/ABC 配对中特有(图 7D)。
讨论¶
通过利用配对的单细胞 RNA 和 TCR/BCR 测序以及配对的滑膜和血液样本,本研究提供了对 RA 滑膜中免疫谱系与细胞状态组成、基因表达、血液和滑膜淋巴细胞迁移以及细胞 - 细胞相互作用之间关系的详细评估。这些数据提供了对特定滑膜淋巴细胞群体之间发育关系的洞察,例如,展示了将 ABC 和活化 B 细胞与浆细胞连接的克隆关系,同时分离了克隆上不同的 Tph/Tfh 与 CCL5+ CD4 T 细胞以及 GZMK+ 与 GZMB+ CD8+ T 细胞(图 8)。

RA 滑膜中富集了多种 B 细胞和 T 细胞亚群,包括自身免疫相关 B 细胞(ABC)和 Tph 细胞。B 细胞谱系的克隆分析表明,记忆、活化和 ABC B 细胞与滑膜中的浆细胞之间存在关系。此外,记忆 B 细胞和 ABCs 具有高比例的类交换克隆(分别为 75% 和 65%),相比之下,初始 B 细胞为 0%,活化 B 细胞为 40%,浆细胞为>95%。特定的 CD4 和 CD8 T 细胞亚群在 RA 滑膜中富集。滑膜 Tfh 细胞和 Tph 细胞显示出显著的克隆关系。Tph 细胞独特地产生 IFNγ 和 CXCL13。这些细胞因子对于与各种 B 细胞状态(包括 ABC、活化和记忆 B 细胞)的相互作用非常重要。此外,受体 - 配体分析表明滑膜中的 B 细胞和 T 细胞可能通过 BTLA-HVEM 结合进行互动,促进滑膜免疫反应。图 8 由 BioRender.com 创建,依据 Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International 许可发布。
在 CD4 T 细胞群体中,Tph 细胞相比其他亚群表现出最高的效应和激活特征,并在滑膜中相比血液显著富集,这与先前的观察一致 16,71。我们利用该群体的配对谱系信息,发现其是克隆扩展最多的 CD4 T 细胞群体之一,并且在克隆上与增殖细胞和 Tfh 细胞相关联。我们承认我们的方法可能存在一个潜在的局限性,即从不同样本中分离和分析的滑膜 T 细胞(和 B 细胞)的数量存在差异,这可能会影响检测到的克隆大小。然而,我们观察到多个滑膜组织样本中的 Tph 细胞是克隆扩展的,并且与 CXCR5+ Tfh 细胞相关,这与最近追踪滑液中 Tph 细胞克隆关系的研究一致 29。这里进行的滑膜组织分析表明,Tfh 细胞(包含在 Tfh/Tph 簇中)在滑膜组织中可能比在滑液中更为丰富,其中 PD-1hi CD4+ T 细胞主要是 CXCR5- Tph 细胞。此外,即使分析的总 T 细胞数量较少,我们在滑膜和血液中的 Tph 细胞之间识别到一些共享克隆,这支持了血液中部分 Tph 细胞在转录组和克隆上与滑膜中的 Tph 细胞相关的观点。
克隆扩展的 Tph 细胞的基因表达模式结合预测的细胞 - 细胞相互作用,表明 Tph 细胞的额外作用,在 T 细胞激活和克隆扩展时,它们上调与效应功能和细胞毒性相关的因素,如 GZMB、IFNG 和 CCL5。这一结果可能表明该群体除了其广为人知的 B 细胞帮助功能外,还通过细胞毒活性直接促进组织炎症或损伤(图 8)。此外,活化和克隆扩展的 Tph 细胞产生的 IFNG 可能驱动 ABC 的生成,而 CCL5 的产生可能吸引其他效应 T 细胞和髓系细胞。
尽管 CD8 T 细胞分析主要集中在颗粒酶 B 等细胞毒特征的表达上,最近的观察突显了 RA 滑膜中显著的 CD8 T 细胞群体,其具有颗粒酶 K 的独特表达 22。我们的分析进一步强调了 RA 滑膜和血液中 GZMK+ 和 GZMB+ CD8+ T 细胞之间的关键区别。在血液中,表达 GZMB 的细胞毒性细胞形成了最大的克隆,而在滑膜组织中,表达 GZMK 的 CD8+ 细胞构成了大多数扩展的细胞。当前和之前的分析的一个显著发现是,GZMK+ 细胞和 GZMB+ 细胞在各组织之间的克隆重叠几乎不存在,表明 GZMK+ 细胞不是以 GZMB 表达的细胞毒性细胞的形式到达滑膜的,而是可能在本地接收抗原刺激,驱动克隆扩展和细胞因子产生等功能 22。
病毒与自身免疫之间的交叉反应性 T 细胞的存在以前被认为具有驱动自身免疫的潜力,包括在 RA 中,但病毒反应性 T 细胞对滑膜炎症的潜在贡献仍不确定 72,73,74,75。我们的分析识别了多个滑膜 T 细胞克隆,这些克隆与之前被鉴定为病毒反应性的克隆相匹配,这一结果与最近展示 RA 滑膜 CD4 T 细胞中的 TCR 病毒反应性一致 33。我们的配对 RNA-seq/TCR 分析使我们能够调查潜在病毒反应性 CD8 T 细胞的表型,但在这些细胞的簇组成或克隆特征中没有明显的广泛差异。由于我们的方法依赖于使用在已定义的 HLA 等位基因上先前被鉴定的病毒特异性克隆,因此数据集中可能存在一些“假阴性”克隆,这些克隆可能是病毒反应性的,但在所检查的数据库中没有匹配。未来的工作可能依赖于使用与病毒肽结合的四聚体分离病毒特异性细胞,并评估它们对滑膜抗原的交叉反应性。然而,这项工作展示了滑膜中可能存在交叉反应性 T 细胞,但没有特定活化或效应表型的富集。
先天性 T 细胞群体被认为对 RA 有贡献 76,77。在这里,我们定义了滑膜中的先天性 T 细胞亚群,包括 γδ T 细胞和 MAIT 细胞群体,滑膜中 Vdelta1 γδ T 细胞的选择性富集与它们在其他组织如肠道和皮肤中的富集一致 78,79。利用配对的 TCR 信息,这是第一个通过分析 VDJ 基因重排确认 RA 中存在 MAIT 细胞的单细胞 RNA 测序研究。我们检测到滑膜和血液中共享的 MAIT 细胞克隆,这表明这些细胞可能在滑膜中进出。滑膜 MAIT 细胞显示出较高的活化特征,与血液中的 MAIT 细胞一样,γδ T 细胞也显示出这一特征,这表明这些细胞在炎症性关节炎中的活跃作用。
我们的研究中一个显著的发现是滑膜中活化 B 细胞群体的富集,具有克隆扩展和不同 B 细胞状态之间的克隆共享证据。我们实现了对离散 B 细胞状态的前所未有的分辨率,与之前的一项研究 36 相比,我们的数据展示了多个 B 细胞状态之间的克隆共享,超出了记忆 B 细胞和浆细胞池。我们进一步扩展了先前研究的观察 34,36,滑膜浆细胞是由局部活化的 B 细胞生成的,包括活化 B 细胞、ABCs 和记忆 B 细胞。发现 ABCs 是滑膜浆细胞的前体,与最近的一份报告一致 80。此外,我们的工作强调了促进滑膜 B 细胞活化和选择的可能重要信号,包括抗原(反映在 BCR 信号上调中)、细胞因子(特别是 IFNG)以及主要涉及 Tph/Tfh 细胞的直接细胞 - 细胞相互作用。
我们的研究突显了滑膜中特有的 B 细胞激活谱系。我们识别了多个类似初始的 B 细胞状态,基于较高的突变率,出乎意料地发现抗原遇到/激活的证据。我们研究中的大多数滑膜 B 细胞是非初始的,以表达 NR4A17 的 B- 活化簇、ABCs 和浆母细胞/浆细胞为主。这些滑膜富集的 B 细胞亚群相比其血液对应物的较高突变率表明这些细胞受到不同的选择压力。尽管更活化的体细胞突变 B 细胞可能优先归巢至滑膜,我们更支持激活和 SHM 在原位发生的假设,这也得到了滑膜克隆扩展和跨细胞状态的克隆共享的支持。值得注意的是,滑膜 B 细胞 SHM 低于扁桃体生发中心 B 细胞,类似于其他炎症组织中报告的 B 细胞突变率 81,82,83。我们假设活化 B 细胞参与启动异位淋巴结构(ELS),其更高表达 ELS 诱导细胞因子如 LT 和 IL67 的证据支持这一点。这里展示的数据进一步突显了 NR4A1+ 活化 B 细胞可能走向一个外滤泡途径,因为它们与 ABCs 共享克隆,并且突变率低于扁桃体生发中心 B 细胞。首次对来自相同滑膜样本的 T 和 B 细胞进行配对分析,使我们能够直接将克隆扩展的 T 细胞群体与滑膜组织扩展的 B 细胞联系起来。最显著的预测相互作用是在增殖 T 细胞和 Tph 与活化 B 细胞、ABCs 和浆母细胞之间识别的。值得注意的是,Tph 和 ABCs 有最大数量的输入和输出相互作用,表明这些群体的信号潜力增加。在 Tph-ABC 相互作用中识别的滑膜中富集的信号通路包括细胞因子(例如,Tph 产生的 IFNG 和 ABCs 上的 IFNGR,LTA-TNFRSF14(HVEM)和 BTLA-TNFRSF14(HVEM)相互作用)和趋化因子(见图 8 中的示意图)。值得注意的是,GSEA 还在克隆扩展的滑膜 B 细胞中识别了细胞因子介导的信号,包括 ABC 群体内。这一 B 细胞亚群之前已被报道在自身免疫疾病中扩展 63,并在炎症组织中积累 24,26,但促进滑膜中 ABCs 的信号仍不清楚。我们的数据强烈表明 Tph 细胞是一个关键驱动因素。这与最近一份关于幼年特发性关节炎的报告一致,该报告表明克隆扩展的 IL21 和 IFNG 共表达的 Tph 促进 CD11c+ 双阴性 B 细胞分化 84。
总之,这些跨 T 和 B 细胞的发现突显了可能共同作用于维持 RA 炎症的细胞状态组成和克隆特征的改变。我们的研究利用了统一的高疾病活动度的横断面队列,但在治疗历史、疾病持续时间和细胞类型丰度表型(CTAP)方面存在异质性。进一步的研究需要更大队列的患者来将这里确定的克隆特征与患者分层联系起来,这可能有助于增加我们对疾病固有细胞和分子异质性的了解。定义克隆扩展的 B 和 T 细胞的特异性,包括它们对瓜氨酸化抗原的反应性也将是感兴趣的。瓜氨酸化肽可能是滑膜中的主要抗原驱动因素,如其他研究所建议的那样 6,85。随着对 RA 中 B 和 T 细胞亚群致病作用的理解不断发展,这个数据集将是一个有用的资源,用于生成或测试与滑膜淋巴细胞抗原受体谱系相关的见解。该工作进一步突显了特定的淋巴细胞群体,包括 Tph 细胞、ABC 和活化 B 细胞,这些群体显示出抗原激活和克隆扩展的转录组特征,将这些细胞群体标记为有前景的治疗靶点,可能选择性地靶向以减缓 RA 中的病理性适应性免疫反应。
数据可用性¶
本研究生成的单细胞 RNA 和 TCR/BCR 测序数据可通过 ARK Portal 获取(https://doi.org/10.7303/syn47217489.1)。由于数据隐私法的限制,这些数据在受控访问下提供。要访问数据,用户需要完成并提交签署的数据使用证书(DUC)到 ARK Portal,网址为:https://arkportal.synapse.org/Data%20Access。额外的数据在补充信息和源数据文件中提供。源数据与本文一起提供。
代码可用性¶
用于重现本研究中分析的源代码可在以下网址获取:https://github.com/dunlapg/amp2repertoire/tree/main。