Interferon stimulated neutrophils as a predictor of immunotherapy response
总结¶
尽管抗癌免疫疗法取得了显著成功,其效果仍局限于部分患者,这突显了预测性生物标志物在临床决策和进一步理解治疗反应机制中的重要性。然而,目前的生物标志物缺乏准确区分患者所需的能力。在这项研究中,我们确定了干扰素刺激的、Ly6Ehi 中性粒细胞作为小鼠基线抗 PD1 反应的血液生物标志物。Ly6Ehi 中性粒细胞由肿瘤内在的 STING(干扰素基因刺激因子)信号通路激活诱导,并具有通过 IL12b 依赖的细胞毒性 T 细胞激活部分地直接使原本对抗 PD1 治疗无反应的肿瘤产生反应的能力。通过将我们的临床前发现转化为非小细胞肺癌和黑色素瘤患者(n = 109)以及公共数据(n = 1440)的队列中,我们证明了 Ly6Ehi 中性粒细胞在预测人类免疫疗法反应方面的高准确性(平均 AUC ≈ 0.9)。总的来说,我们的研究确定了一个在小鼠和人类中均功能活跃的生物标志物。
引言¶
在个性化医学时代,预测性生物标志物通过识别针对每位患者和特定肿瘤特征优化的治疗方法,在临床决策过程中发挥着关键作用。在癌症治疗中,将生物标志物整合到抗癌临床试验中显著提高了响应率。然而,对于新兴的一线癌症治疗,强有力的预测性生物标志物仍未充分发展或难以捉摸。免疫检查点抑制剂(ICIs)(如抗 PD1 和抗 CTLA4)作为一种革命性的免疫疗法,极大地提高了晚期转移性疾病患者的 5 年生存率;然而,只有一小部分患者表现出持久的反应。现有的用于 ICIs 结果的生物标志物,包括在临床实践中使用的 PDL1 免疫组化(IHC)、肿瘤突变负荷或各种基因特征,其预测能力有限(AUC ≈ 0.6–0.75),并且通常需要难以获取的组织活检来进行分析。值得注意的是,这些生物标志物都是肿瘤内在的,但免疫疗法的反应依赖于肿瘤与宿主之间复杂、动态的相互作用。因此,新的生物标志物定义努力集中在免疫系统的不同方面,例如肿瘤浸润 T 细胞的比例或髓源性抑制细胞(MDSCs)的水平。然而,适用于多种癌症类型的 ICIs 结果的准确生物标志物在临床肿瘤学中仍然是一个重要但尚未实现的需求。
理论上,整合肿瘤和宿主依赖因素的生物标志物可能优于现有的标志物。因此,在此研究中,我们结合单细胞 RNA 测序(scRNA-seq)和通过诱变产生的具有内在低和高免疫原性克隆的临床前肿瘤模型,以识别反应预测的细胞状态,这些状态也反映了宿主细胞的肿瘤内在模式。具体而言,我们确定了由肿瘤内在 STING 信号激活诱导的干扰素刺激的 Ly6Ehi 中性粒细胞,作为一种肿瘤浸润和血液中的预测性生物标志物,在小鼠和人类中(AUC ≈ 0.9,人类)跨多种额外模型和癌症类型中均有效。此外,我们得出了一个 15 基因的 Ly6Ehi 特征,能够在人体大规模 RNA 测序数据中准确区分反应者和非反应者(平均 AUC > 0.9)。最后,我们进一步扩展了这种中性粒细胞亚型的功能特征,揭示了其部分通过调节细胞毒性 CD8+ T 细胞活性直接使原本对抗 PD1 无反应的肿瘤产生反应的能力。
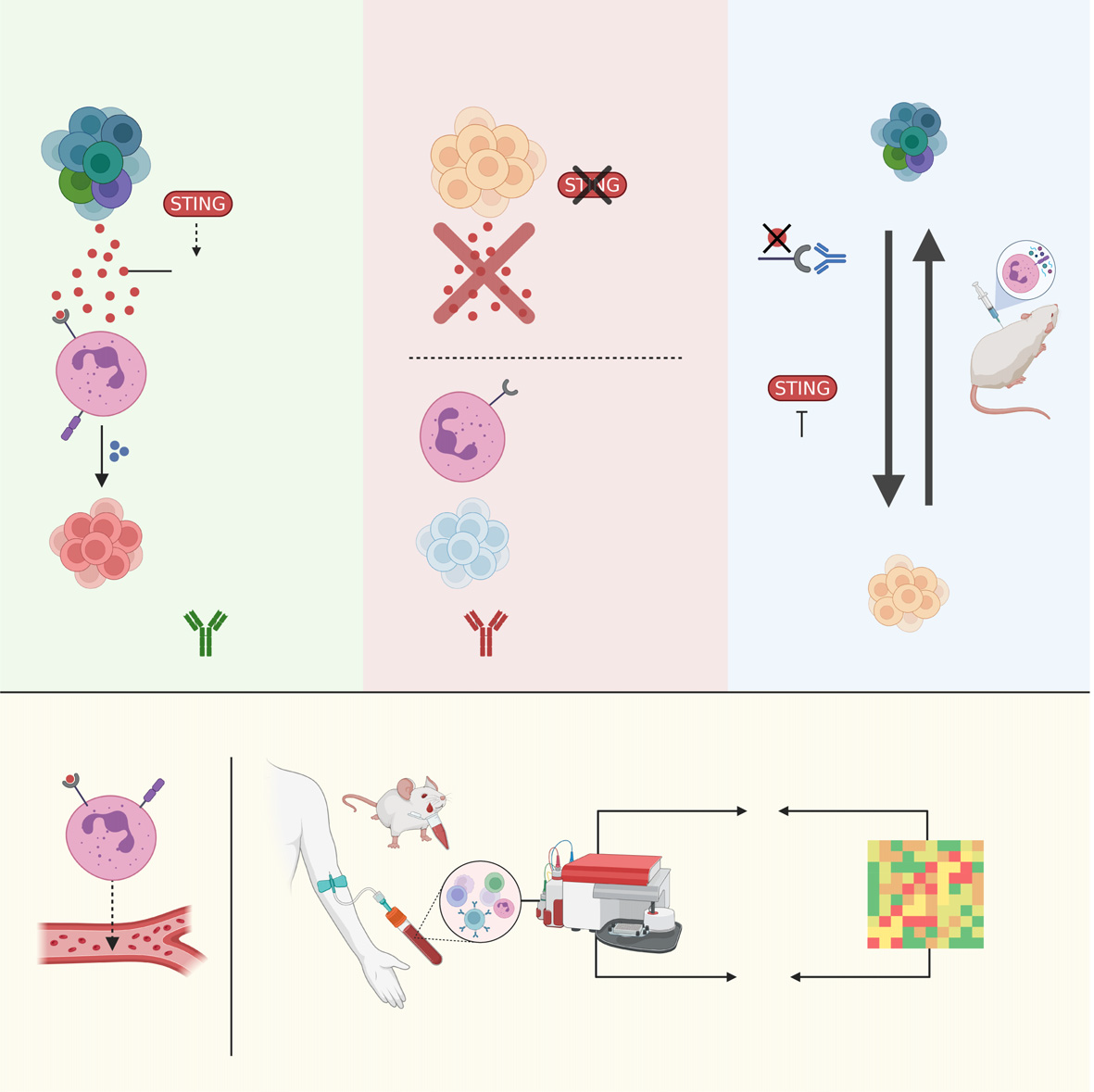
图 1A 多模型方法以识别与免疫治疗反应相关的临床生物标志物
paper 的概述。简而言之,几种小鼠品系结合多种癌细胞系和克隆最初用于筛选,并随后在小鼠中交叉验证免疫治疗反应的生物标志物。为了临床转化我们的发现,使用了公共数据以及来自非小细胞肺癌(NSCLC)和皮肤黑色素瘤(SKCM)患者队列的数据,以评估所识别的生物标志物在人体中的准确性和实用性(有关详细的逐步步骤,请参阅 STAR Methods 和引言)。小鼠品系包括:BALB/c,C57BL/6,以及 C57BL/6 与 CBA 的回交品系。癌细胞系包括:4T1 乳腺癌、路易斯肺癌(LLC)、肾细胞癌(RENCA)和 EMT6 乳腺癌。P 表示亲代细胞系,M 表示诱变克隆。
结果¶
干扰素刺激的中性粒细胞亚型标志着 4T1 乳腺癌模型对抗 PD1 治疗的反应¶
基线生物标志物发现的前提条件(即治疗前)是使用其反应结果已知的稳定且可预测的模型——这一要求在人类中尤其难以且耗时地实现。为了寻找预测免疫治疗反应的生物标志物,我们因此将最初的努力集中在临床前模型上。具体来说,我们生成了 4T1 乳腺癌细胞系,包括从不响应的亲代细胞系(4T1P)中衍生出的对抗 PD1 有反应的诱变克隆(4T1M),从而便于对这两个相关克隆进行生物学上相关的比较(图 2A,参见 STAR 方法和图 S1A)。肿瘤细胞暴露于致癌物质后总肿瘤突变负荷(tTMB)增加,如先前所示,模拟了免疫治疗反应的至少一个潜在肿瘤依赖方面。使用该模型,并结合质谱流式细胞术(CyTOF)和流式细胞术,我们确认诱变导致了具有更高免疫原性程度的肿瘤,其特征是免疫抑制细胞(如 G- 和 M-MDSCs 以及 PDL1+ 细胞)的数量减少,抗肿瘤免疫细胞(如活化的 B 细胞和 T 细胞)的数量增加,以及颗粒酶 B 水平升高(图 2B-2D 和图 S1B-S1I)。因此,4T1M 和 4T1P 构成了初步研究免疫治疗反应的合适模型。
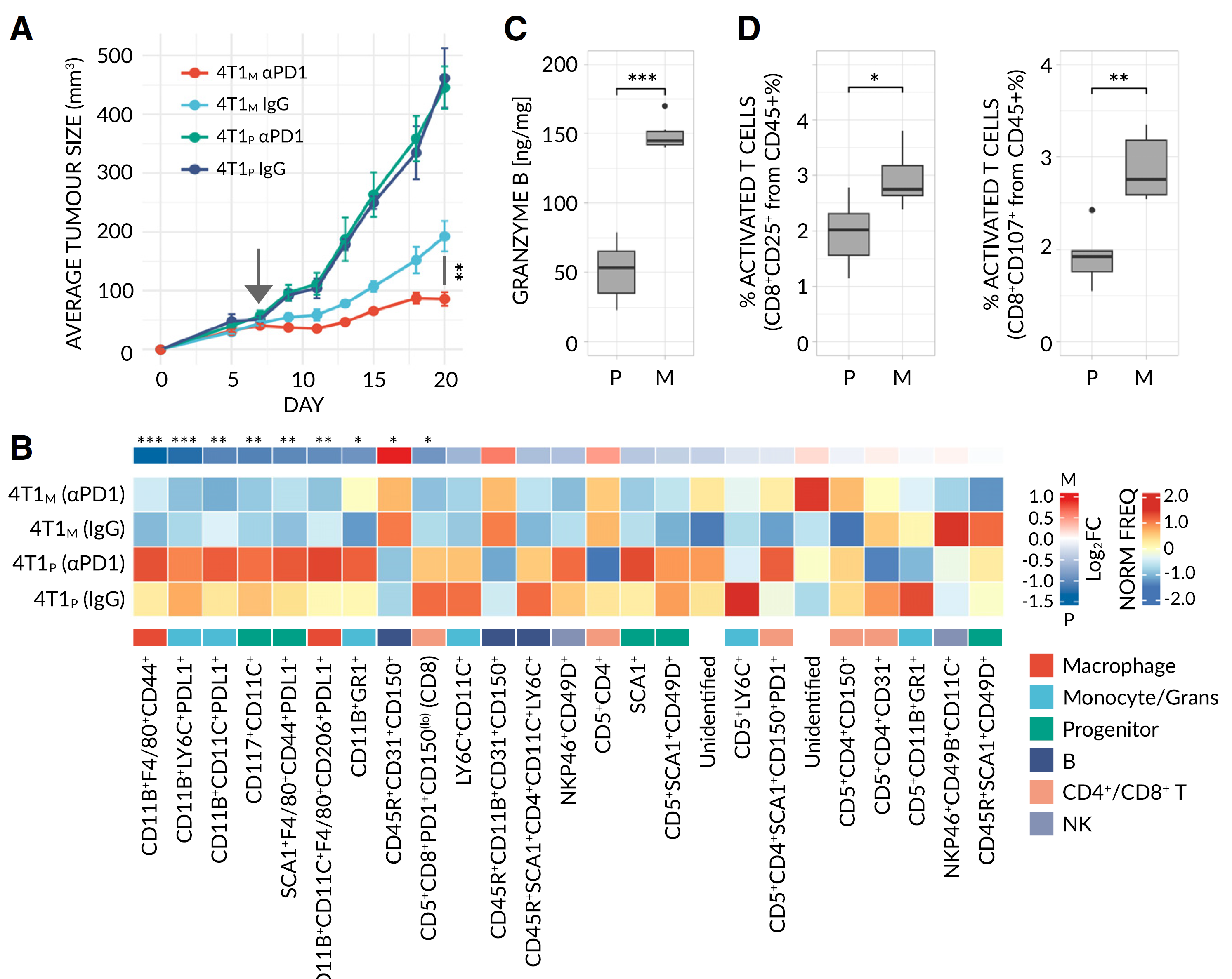
图 2A 诱变的 4T1 乳腺癌模型显示出免疫原性表型
(A)植入亲代(无反应)或诱变(有反应)4T1 乳腺癌(分别为 4T1P - (P) 和 4T1M - (M))的 BALB/c 小鼠的平均肿瘤生长曲线,并用αPD1 或对照 IgG 抗体治疗(每组 n = 5 只小鼠)。原始数据见图 S1A。显著性通过两样本 KS 检验评估(∗∗, p < 0.001)。
(B)将 4T1P(205,678 个细胞)和 4T1M(236,251 个细胞)肿瘤微环境(TME)中的 CD45+ 细胞分成 25 个不同的无监督聚类。显示每个样本规范化、缩放的聚类频率热图。根据所有标记物的表达并行检查,注释了聚类基因型和亲代细胞类型(见图 S1B)。通过广义线性模型(GLMs)检测差异丰富的(4T1P vs. 4T1M,组合处理)聚类。治疗在肿瘤大小约为 50 mm³时开始(箭头所示)。显著性通过 FDR 校正的贝叶斯调节 t 检验评估(∗, FDR < 0.01; ∗∗, FDR < 0.001; ∗∗∗, FDR < 0.0001)。
(C)未处理肿瘤裂解物中颗粒酶 B 的浓度,通过 ELISA 测量(每组 n = 6 只小鼠)。
(D)通过流式细胞术测定在 4T1 肿瘤中的活化(CD25+ 或 CD107+)细胞毒性 T 细胞的频率(每组 n = 6 只小鼠)。所有 CyTOF 样本、肿瘤和裂解物在终点时取样(肿瘤大小约为 200-500 mm³)。在(C 和 D)中,显著性通过单向曼 - 惠特尼检验评估(∗, p < 0.01; ∗∗, p < 0.001; ∗∗∗, p < 0.0001)。
到目前为止,临床前和临床研究已经重点研究了多种免疫细胞作为免疫治疗的潜在生物标志物——最显著且主要是 T 细胞,但也包括 MDSCs。MDSCs 包括粒细胞和单核细胞亚型,构成了一个广泛可变的异质细胞群,与癌症患者的不良结局密切相关。然而,相反的报告表明,不同的髓系亚群与抗肿瘤活性相关。鉴于髓系细胞在肿瘤生物学中显然发挥的多效性作用,以及社区先前对基于 T 细胞的生物标志物的表征努力,我们将搜索重点放在髓系细胞上。为此,我们从无反应和有反应的 4T1 肿瘤中分离了代表小鼠中单核和粒细胞免疫细胞的 GR1+ 细胞,随后进行了 scRNA-seq 以详细绘制 GR1+ 亚群的图谱。从这些肿瘤中分离的所有 GR1+ 细胞的 UMAP 分析显示出两个主要的、一致的群体,分别代表单核和粒细胞表型,这与以前的文献一致。在单核细胞区室中,我们观察到与先前发现一致的巨噬细胞亚群的显著差异。即,无反应的小鼠富集了免疫抑制的 M2 巨噬细胞样细胞,而对抗 PD1 有反应的小鼠富集了炎症性的 M1 巨噬细胞样细胞。没有观察到进一步的差异,这促使我们在粒细胞群体中寻找生物标志物。与已知的髓系细胞包括粒细胞 MDSCs 的免疫抑制作用相反,我们鉴定出一个中性粒细胞亚群,其丰度显著增加,作为抗 PD1 反应的函数。此外,该亚群表现出 192 个不同基因的上调表达(>1.5 log2 倍变化),其中包括 30 个基因的>2 log2 倍变化——提供了一个与此细胞亚群相关的大量候选生物标志物库,用于在表型稳定的 4T1 模型中预测免疫治疗反应。
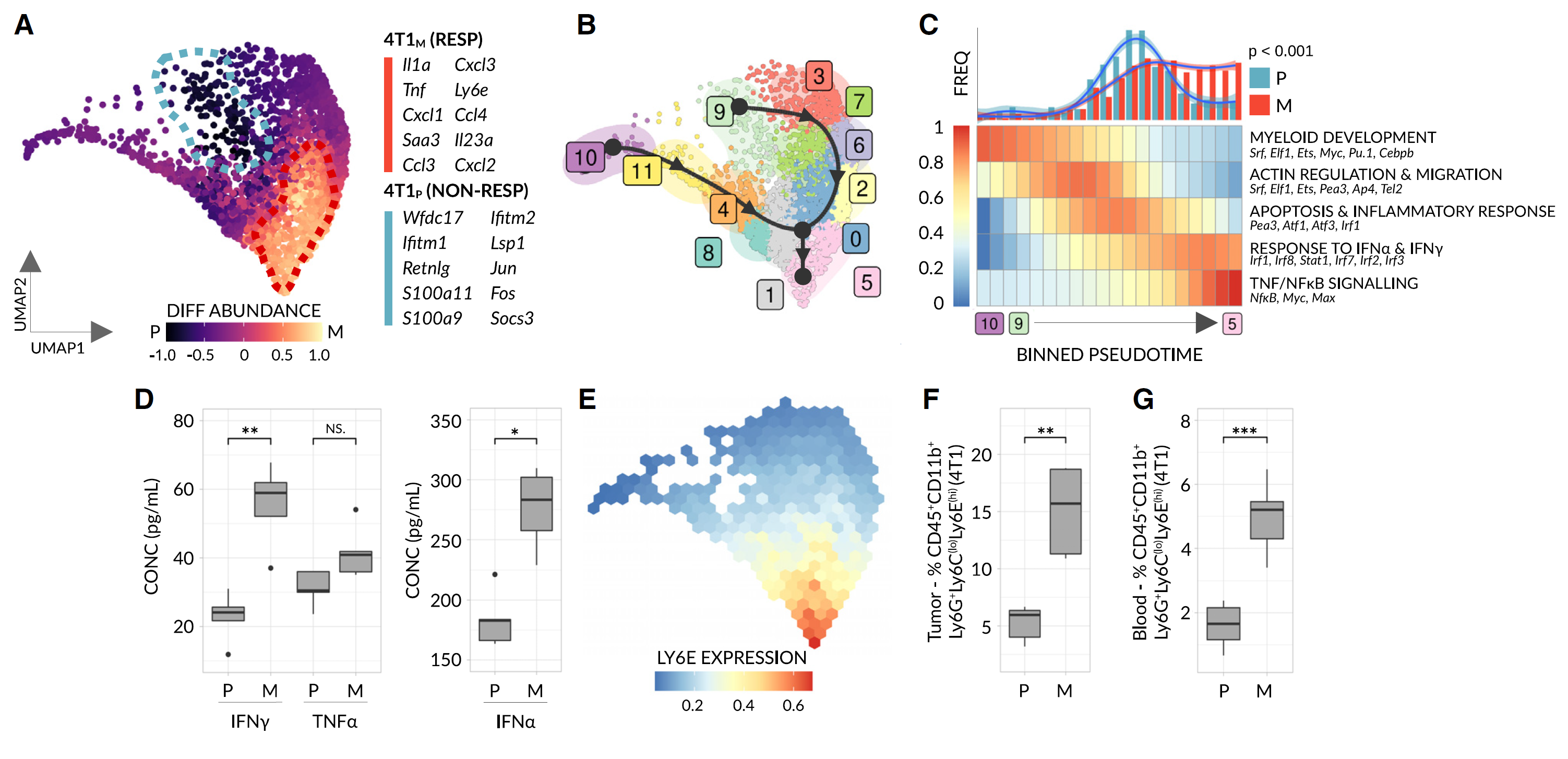
图 3 干扰素刺激的 Ly6E(hi) 中性粒细胞标志着 4T1 乳腺癌对αPD1 的反应
对从亲代(4T1P)(无反应) 和诱变(4T1M)(有反应) 的 4T1 乳腺癌肿瘤中获得的 GR1+ 细胞进行了 10X scRNA-seq(每组 n = 3 只小鼠合并)。
(A)UMAP 图显示了 2886 个过滤后的 GR1+ 中性粒细胞(4T1P = 681 个细胞,4T1M = 2185 个细胞),细胞根据差异丰度评分进行着色。突出显示了两个显著富集的细胞邻域(虚线)(另见图 S2C)。每个邻域的前 10 个最显著的标志基因列出(FDR < 0.001,log2 倍变化 > 1.5)。单核细胞(未显示)从分析中剔除(见:图 S2)。
(B)12 个不同的 GR1+ 粒细胞簇的轨迹分析。实心黑线=轨迹谱系,构成基于分区图抽象(PAGA)推断的伪时间排序的基础。黑色箭头=简化的 RNA 速度(原始数据见图 S2D)。
(C)上:按对齐的伪时间分档的细胞频率直方图。通过 loess 回归生成的平滑分布叠加在一起。显著性通过两样本 KS 检验评估。下:显示与伪时间显著相关的所有基因模块的规范化分档富集得分热图。仅显示两条谱系共有的基因模块。
(D)箱线图显示未处理的 4T1 肿瘤裂解物中 IFNγ、TNFα和 IFNα的浓度(每组 n = 4-5 只小鼠)。
(E)Ly6E 的分档规范化表达。为视觉清晰而插补数据。
(F 和 G)通过流式细胞术确定的 4T1 肿瘤中(F)和携带 4T1 的小鼠血液中(G)的 Ly6E(hi) 中性粒细胞的频率(每组 n = 5-10 只小鼠);有关门控策略,请参见图 S3A。在(D,F 和 G)中,显著性通过单向曼 - 惠特尼检验评估(NS,p > 0.01;∗,p < 0.01;∗∗,p < 0.001;∗∗∗,p < 0.0001)。
为了缩小选择范围并促进临床转化,我们推理成功的生物标志物必须符合以下标准:(1)该标志物的机制已被理解,例如,它由数据中可识别或在肿瘤微环境中活跃的信号通路或一系列信号通路诱导;(2)该标志物存在于宿主细胞(例如中性粒细胞)上,但由肿瘤内在活动诱导(见引言的理由);(3)该标志物的表达主要存在于亚稳态或高度分化的细胞状态,而不是可能难以在体内一致检测的瞬态状态;最后,为了实用性,(4)该标志物基因编码一个细胞表面标志物,允许通过简单的流式细胞术进行成本效益高的分析。
按照这个逻辑,我们最初对所有中性粒细胞进行轨迹分析,并通过计算 RNA 速度向量推断轨迹的方向性(图 3B 和 S2D)(详情见 STAR 方法)。这种方法不仅确定细胞分化的终点,还通过揭示随着分化进行而定期激活的生物过程和转录因子提供机械见解。有趣的是,我们观察到一个分支的双谱系轨迹在早期阶段(即在祖细胞水平)分叉,但最终汇聚到一个单一细胞状态(图 3B)。重要的是,与 RNA 速度推断的方向一致,已知的祖细胞基因在早期伪时间值上表达(图 S2E-S2I),这表明这个轨迹捕捉了合法的细胞发育途径。我们假设两个谱系趋向相同细胞状态的汇聚可能反映了一个共同的基础分化程序。因此,我们使用轨迹对齐算法来匹配每个谱系的“同源”段落,并确定多个基因模块——在两个分支中都存在——其表达随着伪时间的变化而变化(图 3C)。通过按样本计算所得对齐轨迹上的细胞密度(图 3C 顶部)并表征每个共享模块(图 3C 底部),我们观察到无反应小鼠的中性粒细胞通常无法进展到祖细胞样的凋亡状态。相比之下,有反应小鼠的中性粒细胞进一步分化为响应干扰素α/γ(IFNα/γ)和 NFkB/TNFα信号传导的终末状态,表明暴露于 IFN 是这种差异进展的主要驱动力。与此一致,以前的研究已显示 IFNα/γ水平与免疫治疗反应之间存在联系。在蛋白水平上检查 4T1 肿瘤时,我们观察到 IFNα/IFNγ/TNFα水平与反应之间的类似相关性,验证了我们的 scRNA-seq 结果(图 3D,见 STAR 方法)。因此,为了选择符合我们标准的候选生物标志物(见前文),我们筛选了所有 192 个差异表达基因(表 S1A),寻找位于细胞表面的 IFN 刺激基因(ISGs)。Ly6E 是已知的 ISG,也是唯一符合我们标准的细胞表面标志物,具有高表达加权伪时间值,是检测这种中性粒细胞亚群的主要候选生物标志物(图 3E)。具体而言,肿瘤中 Ly6Ehi 中性粒细胞的高频率与 4T1 模型中的免疫治疗反应显著相关(图 3F,见图 S3A;门控策略)。尽管在肿瘤样本中发现了 Ly6Ehi 中性粒细胞,但我们假设这些细胞可能还在血液中形成或循环回血液中。确实,当在携带 4T1 肿瘤的小鼠血液中检测时,Ly6Ehi 中性粒细胞同样标志着反应,并且重要的是,Ly6Ehi 中性粒细胞在肿瘤生长早期阶段(约 50 mm³)就能区分有反应和无反应的小鼠——总体上表明 Ly6Ehi 中性粒细胞可能在该模型中作为抗 PD1 反应的预测性血液生物标志物。
Ly6Ehi 中性粒细胞克服了对抗 PD1 治疗的耐药性¶
生物标志物可以是替代的——即作为免疫治疗反应主要生物机制的副产物被动产生的旁观者(例如,在有反应肿瘤的微环境中存在 IFNα/γ)——或者它们可能在反应本身中起功能作用。我们推测功能活跃的生物标志物可能具有更广泛的适用性,超越单一的临床前模型或癌症类型。因此,为了区分这两种可能性,我们通过将 GR1+ 细胞暴露于 IFNα/γ混合物来人工生成 Ly6Ehi 中性粒细胞,基于 scRNA-seq 分析的信息。为了确保生成的细胞类似于我们 scRNA-seq 数据中观察到的 Ly6Ehi 表型,我们分析了 Ly6E 在蛋白水平上的诱导以及根据我们的 scRNA-seq 数据通过 RT-qPCR 测量的选定差异表达的分泌因子的 mRNA 表达水平。首先,我们观察到在 IFN 处理后中性粒细胞表面 Ly6E 的强烈诱导。其次,我们观察到 RT-qPCR(处理与未处理)和 scRNA-seq(反应与无反应)的 log2 倍变化之间的显著相关性,总体上表明这些细胞是类似的。
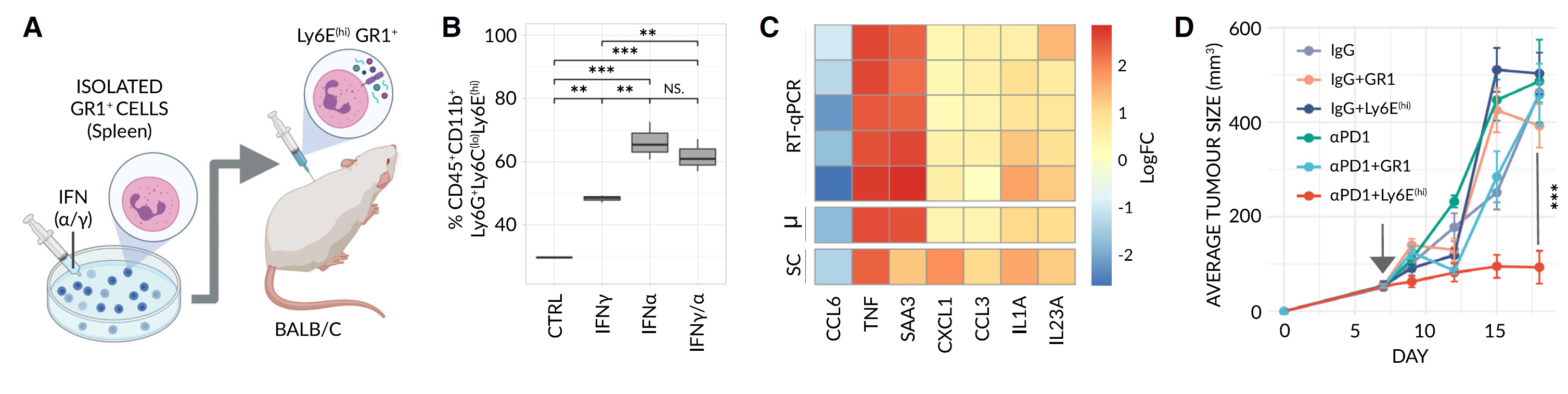
图 4 Ly6E(hi) 中性粒细胞使无反应的 4T1 肿瘤对αPD1 治疗敏感
(A)采用性转移的示意图。分离的 GR1+ 细胞在体外用 IFNγ/α处理,诱导出 Ly6E(hi)- 样状态,特征是分泌效应分子,并注射到携带亲代无反应 4T1 乳腺肿瘤的 BALB/c 小鼠体内。
(B)通过流式细胞术确定的 GR1+ 细胞暴露于 IFNγ、IFNα或两者后 Ly6E(hi) 中性粒细胞的频率(每组 n = 3 只小鼠)。显著性通过单因素方差分析(ANOVA)和 Tukey 事后 HSD 检验评估(NS, p > 0.01;∗∗, p < 0.001;∗∗∗, p < 0.0001)。
(C)热图比较 RT-qPCR(处理 [+IFNγ/α] 与未处理对照 GR1+ 细胞)和 scRNA-seq(Ly6E(hi) 中性粒细胞与所有剩余中性粒细胞)的规范化 log2 倍变化(每组 n = 7 次生物重复)。SC = scRNA-seq。μm =平均 RT-qPCR 值。
(D)携带亲代无反应 4T1 乳腺肿瘤的小鼠在接受单一疗法(对照 IgG 或αPD1)或联合疗法(GR1+ 或 Ly6E(hi) 中性粒细胞,如图所示)治疗后的平均肿瘤生长曲线(每组 n = 6 只小鼠)。采用性转移的时间进程显示在图 S4A。原始数据见图 S4B。治疗在肿瘤大小约为 50 mm³时开始(箭头所示)。显著性通过两样本 KS 检验评估(∗∗∗, p < 0.0001)。
随后,我们在体内测试了这些生成的细胞对抗 PD1 耐药肿瘤的效果。因此,我们通过采用性转移(见图 S4A 的治疗方案)将 Ly6Ehi 中性粒细胞注入携带无反应 4T1 肿瘤的小鼠体内,并观察到在抗 PD1 治疗后肿瘤生长显著减少,但这些细胞作为单一疗法没有疗效(图 4D 和 S4B)。与这些结果一致,我们在一项独立实验中检查了各种免疫细胞的水平,发现与单独接受任何一种单一疗法的小鼠相比,接受抗 PD1 和 Ly6Ehi 中性粒细胞联合治疗的小鼠血液和肿瘤浸润的活化细胞毒性 CD8+ T 细胞的频率显著更高(图 S4D–S4F)。在测量肿瘤内颗粒酶 B 水平时,这一趋势进一步得到验证(图 S4G)。值得注意的是,我们在处理过的肿瘤中发现了荧光标记的 Ly6Ehi 中性粒细胞(图 S4H),进一步表明 Ly6Ehi 中性粒细胞成功浸润并在响应的肿瘤微环境中发挥作用。
鉴于 Ly6Ehi 中性粒细胞的干扰素刺激表型,我们接下来评估了单独使用 IFN-γ和 IFN-α(IFNγ/α)是否可以在同样程度上使耐药肿瘤敏感。虽然接受 IFNγ/α和抗 PD1 联合治疗的小鼠显示出肿瘤生长的边际减少,但并不显著(图 S4C 和 S4I),并且在血液或肿瘤中都没有观察到活化 CD8+ T 细胞水平的变化(图 S4J 和 S4K)。尽管如此,尽管缺乏反应,IFNγ/α处理显著提高了肿瘤中 Ly6Ehi 中性粒细胞的水平,进一步证实 IFN 在体内和体外都能诱导 Ly6Ehi 中性粒细胞(分别见图 S4L 和 S4M 及 4B)。这种明显的矛盾表明系统给药的 IFN-γ和/或 IFN-α介导了超出生成 Ly6Ehi 中性粒细胞的其他多效性影响——这些影响抑制了免疫治疗反应并覆盖了 Ly6Ehi 中性粒细胞克服无反应能力。此外,我们的结果表明 Ly6Ehi 中性粒细胞本身代表了 IFN 的一个独立的、显著的抗肿瘤效应。这些发现与系统性 IFN 治疗在增强人类 ICI 疗法中的明显无效性一致,但可能进一步扩展了这一认识。
STING 信号通路解释了 IFN 诱导的 Ly6Ehi 中性粒细胞,后者反过来直接支持抗肿瘤免疫¶
在细胞应激、缺氧或染色体不稳定的条件下生成的细胞质双链 DNA(dsDNA)已知会诱导肿瘤内在的 STING 通路活动,随后癌细胞分泌 IFNs(如 IFNα)。鉴于 Ly6Ehi 中性粒细胞的干扰素刺激表型、使用具有高突变负荷的模型,以及我们希望识别由肿瘤内在特性模式化的生物标志物,我们询问 STING 信号是否负责在肿瘤微环境中生成这些细胞。为此,我们量化了无反应的 4T1P 和有反应的 4T1M 克隆中与 STING 通路相关的因素的水平。我们观察到 4T1M 相对于 4T1P 显著更高的细胞质 dsDNA 水平和显著上调的 STING 及其下游信号成分(IRF3、NF-κB 和本地 ISG15 [15 kDa])(图 5A、5B 和 S5A)。与此一致,4T1M 细胞分泌更高水平的 IL-6,上调细胞表面 MHCI,下调 PDL1——所有这些都是 STING 活性的已知读取指标(图 S5B-S5D)。重要的是,这些趋势在使用 STING 抑制剂 H151 时逆转(图 S5B-S5D)。有趣的是,4T1M 肿瘤显示出降低的 ISG 化蛋白水平(图 5B),这表明这些肿瘤中的 ISG 化机制受到抑制或异常,尽管 STING 和 ISG15 诱导强劲。尽管如此,并且关键的是,4T1M 细胞的条件培养基在体外强烈诱导 Ly6Ehi 中性粒细胞表型,这种诱导在阻断 IFN 受体(IFNRα/γ)时逆转(图 5C)。相比之下,从 4T1P 衍生的培养基没有这种动态。与这些结果一致,IFNRα/γ在 GR1+ 细胞上高水平表达(图 S6A)——确认了它们对 IFN 的响应能力。有趣的是,受体表达在 Ly6Ehi 细胞上保持(图 S6A),我们进一步显示以前在 4T1M 肿瘤中观察到的较高的 IFNα/γ水平(见:图 3D)完全依赖于 STING(图 S6B 和 S6C)。为了扩展这些观察,我们评估了体内抑制 IFNR-α/γ的效果。携带有反应 4T1M 肿瘤的小鼠接受αIFNR-α/γ治疗后,再也无法对抗 PD1 产生有效反应(图 S6D 和 S6E),这种无反应的特征是 Ly6Ehi 中性粒细胞水平较低(图 S6F)。重要的是,即使在阻断 IFNR-α/γ的情况下,Ly6Ehi 中性粒细胞的采用性转移仍然能够恢复免疫治疗反应(图 S6D–S6F)。综合来看,我们的结果强烈表明,STING 激活——内在于有反应的 4T1M 癌细胞——解释了 Ly6Ehi 中性粒细胞的诱导,这种诱导是由 IFN 介导的,并反过来这些细胞能够预测但也能够诱导免疫治疗反应。
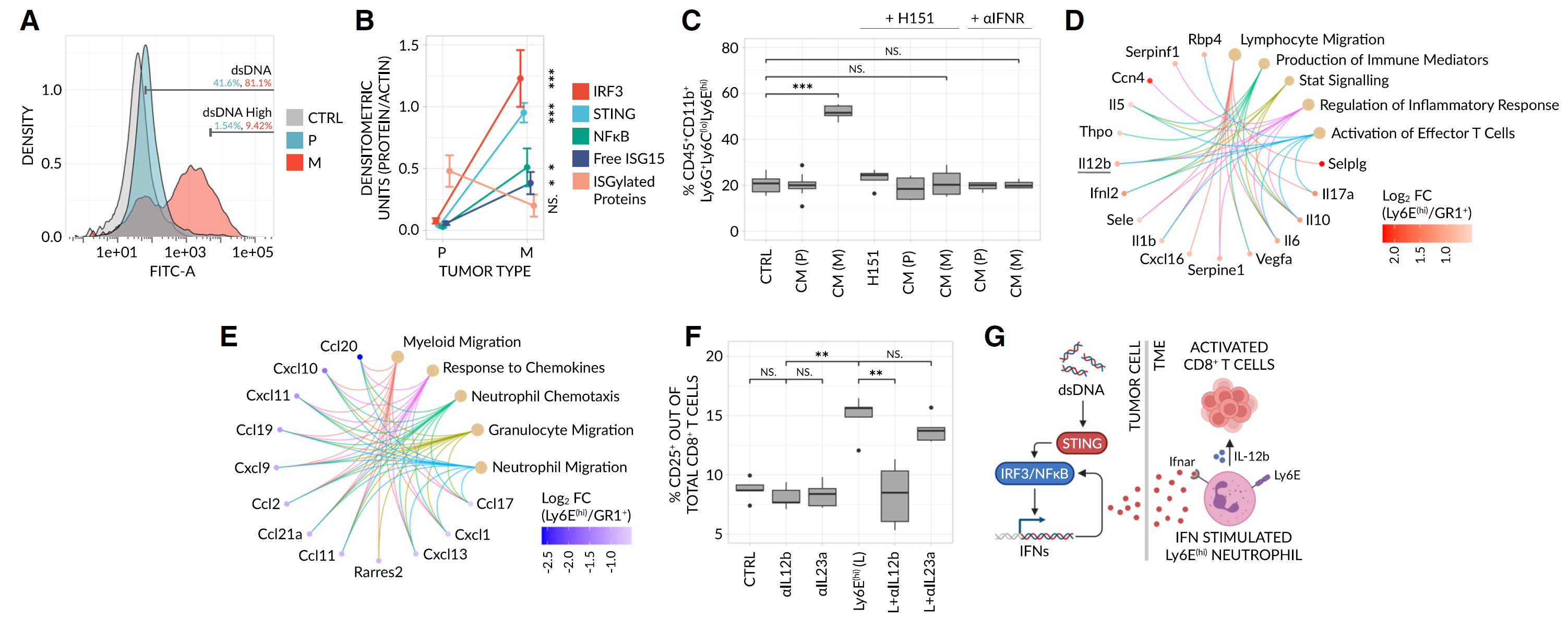
图 5 肿瘤内在 STING 活性诱导 Ly6E(hi) 表型并反过来支持效应 T 细胞的激活
(A)通过α-dsDNA 染色和流式细胞术确定的培养的 4T1P 和 4T1M 细胞系中的 dsDNA 水平密度图。dsDNA 水平相对于未染色的 IgG2a 同型对照(CTRL)进行量化(每组 n = 5 次生物重复)。
(B)通过 WB 印迹(见图 S5A)对 4T1P 和 4T1M 肿瘤裂解物中与 STING 通路相关蛋白的密度定量(每组 n = 3-4 次生物重复)。每个蛋白相对于肌动蛋白对照进行标准化。
(C)分离的 GR1+ 细胞在体外培养,使用来自 4T1P(P)或 4T1M(M)肿瘤的条件培养基,在存在或不存在 STING 抑制剂 H151 或αIFNR-α/γ的情况下,并通过流式细胞术确定 Ly6E(hi) 中性粒细胞的频率(每组 n = 6 次生物重复)。CTRL = 仅 GR1+ 细胞。
(D 和 E)条件培养基由 GR1+ 细胞或 IFNαγ诱导的 Ly6E(hi) 中性粒细胞生成,并随后在细胞因子阵列上检测(每组 n = 3 只小鼠合并)。使用超几何过度表示检验和基因本体(GO)数据库确定 Ly6E(hi) 中性粒细胞(D)和 GR1+ 细胞(E)的富集通路。仅包括 log2FC > 0.35 的差异表达蛋白,并且仅显示显著通路(FDR < 0.01)。
(F)分离的 CD8+ T 细胞在体外培养,使用α-IL-12b 或α-IL23a 中和抗体,在有或没有来自 IFNα/γ诱导的 Ly6E(hi) 中性粒细胞(L)的条件培养基的情况下,并通过流式细胞术确定活化的 CD25+CD8+ T 细胞的水平(每组 n = 5 只小鼠)。CTRL = 仅 CD8+ T 细胞。在(B、C 和 F)中,通过单因素方差分析(ANOVA)和 Tukey 事后 HSD 检验评估显著性(NS, p > 0.01;∗, p < 0.01;∗∗, p < 0.001;∗∗∗, p < 0.0001)。
(G)拟议机制的示意图。肿瘤内在的 STING 活性,由细胞质 dsDNA 在缺氧、基因组不稳定和/或细胞应激的结果诱导,转录激活 IFN 反应。肿瘤分泌的 IFNα,例如,随后结合在 TME 中表达 Ifnar 的中性粒细胞,诱导 Ly6E(hi) 表型,并通过 IL-12b 激活和增殖 CD8+ T 细胞。总体上,这支持免疫治疗反应和抗肿瘤活性。重要的是要注意到,这种机制是 STING 特异性的,但其他来源或机制的 II 型干扰素(例如,IFNγ)也能够引起等效的效果,正如我们的研究所示。
鉴于 Ly6Ehi 中性粒细胞在携带 4T1 的小鼠中介导免疫治疗反应的能力(见图 4D、S4 和 S6D-S6F),我们试图揭示 Ly6Ehi 依赖的分子机制,这些机制对此负责。由于将 Ly6Ehi 中性粒细胞转移到携带 4T1P 小鼠体内会诱导细胞毒性 CD8+ T 细胞活性(见图 S4E 和 S4F),我们探讨了 Ly6Ehi 中性粒细胞是否直接介导这种激活以及这种活性是否依赖于 Ly6E 本身,或者通过 IFN 刺激后诱导的分泌因子来实现。为了解答这两个问题,我们首先将 Ly6Ehi 中性粒细胞或未刺激的 GR1+ 细胞与 CD8+ T 细胞共同培养。Ly6Ehi 中性粒细胞促进了细胞毒性 CD8+ T 细胞的增殖和活化,而 GR1+ 细胞显著抑制了这些活动(图 S7A-S7D)。与此一致,Ly6Ehi 中性粒细胞显著促进了体外 T 细胞介导的肿瘤细胞杀伤,相对于对照培养物(图 S7E)。随后我们在小鼠骨髓中敲低了 Ly6E(图 S8A,参见 STAR 方法),并重复了这些实验。重要的是,在体内没有观察到对抗 PD1 反应的变化,并且无论 Ly6E 状态如何,IFN 诱导的 Ly6Ehi 中性粒细胞对 T 细胞和 T 细胞介导的肿瘤杀伤的所有积极影响都得以保留(图 S8C-S8G)——表明 Ly6E 在反应机制中没有功能性作用,而仅在我们的研究中作为检测该中性粒细胞亚群的方法。
因此,我们接下来比较了 Ly6Ehi 中性粒细胞与所有其他 GR1+ 细胞的分泌组,以确定诱导 T 细胞激活的潜在机制。基于差异表达蛋白的通路分析,Ly6Ehi 中性粒细胞通过如 IL-12b、IL-1β、IL-6 和 IL-10 等细胞因子支持 CD8+ T 细胞的激活和正调控,而未刺激的 GR1+ 细胞通过招募额外的免疫抑制髓系细胞支持免疫抑制肿瘤微环境(图 5D 和 5E)。与此一致,相对于所有其他 GR1+ 中性粒细胞亚群,Ly6Ehi 中性粒细胞在 mRNA 水平上显著下调了免疫抑制因子如 S100A8、S100A9 和 CCL6 的分泌,而上调了促炎因子如 TNF-α、IL23a、IL-12b 和 IL-1α(表 S1B)。为了进一步验证这一点,我们在有或没有针对 IL-12b 和 IL23a 的中和抗体的情况下,将 Ly6Ehi 中性粒细胞与 CD8+ T 细胞共同培养,这两者在 Ly6Ehi 中性粒细胞中相对于 GR1+ 细胞上调。有趣的是,与最近一篇出版物一致,我们发现 IL-12b 而非 IL23a 诱导了 CD8+ T 细胞的活性(图 5F)。这些结果表明 Ly6Ehi 中性粒细胞可能通过分泌 IL-12b 来增强细胞毒性 CD8+ T 细胞的活性。
为了建立一个清晰的事件顺序,我们进一步测试了 Ly6Ehi 中性粒细胞的水平是否依赖于 T 细胞活性,利用缺乏适应性免疫系统的 SCID 小鼠,发现情况并非如此。相反,我们观察到血源性的 Ly6Ehi 中性粒细胞在免疫正常小鼠中区分有反应和无反应 4T1 肿瘤的能力在 SCID 小鼠中保持不变(图 S7F-S7G)。综合来看,我们的结果表明,Ly6Ehi 中性粒细胞不仅在携带 4T1 肿瘤的小鼠中作为免疫治疗反应的预测性生物标志物,还:(1)在反应机制中发挥功能作用;(2)在 T 细胞上游起作用;(3)可以由适应性免疫系统或宿主以外的实体(如肿瘤内在 STING 信号,通过 IFNα或通过 IFNγ通过尚未表征的机制)诱导;并且(4)通过 IL-12b 直接激活细胞毒性 CD8+ T 细胞,从而促进抗肿瘤免疫(图 5G)。
在各种临床前肿瘤模型中对 Ly6Ehi 中性粒细胞作为反应生物标志物的交叉验证 大多数转化研究在很大程度上仍然采用仅涉及单一小鼠品系或癌症类型的简单方法,因此在一个临床前模型中鉴定到 Ly6Ehi 中性粒细胞促使我们在捕捉肿瘤和宿主依赖变异的多种额外模型中验证它们作为血源性生物标志物的效果,因为这两个方面在药物疗效中都起关键作用。因此,我们使用基于细胞系的肿瘤模型,包括:(1)在两种小鼠品系(RENCA 肾细胞癌和 Lewis 肺癌(LLC))中有或没有诱变的克隆,如我们以前的 4T1 方法;(2)自发响应免疫治疗的细胞系(EMT6 乳腺癌);以及(3)混合背景小鼠,包含可变的基线免疫状态,植入 LLC 肿瘤(图 S9)。在所有情况下,我们观察到 Ly6Ehi 中性粒细胞的频率在治疗前预测抗 PD1 反应——在显著程度和模型无关的方式下(图 S9A-S9D)。综合来看,我们的数据表明,IFN 刺激的 Ly6Ehi 中性粒细胞是小鼠治疗结果的潜在“泛机制”标志物,无论反应是由肿瘤、宿主依赖性或品系特异性差异驱动的,这表明 IFN 分泌到肿瘤微环境中可能是反应机制中的一个共同步骤。
Ly6Ehi 中性粒细胞预测人类的免疫治疗反应¶
物种特异性差异通常会阻碍将发现从小鼠转化到人类,例如生物标志物。为了克服这一问题,我们使用了一套临床前模型(见图 1)以更大信心地识别 Ly6Ehi 中性粒细胞作为小鼠中的潜在“泛机制”生物标志物,认为该标志物可能在人类中保守。然而,Ly6E 是否是人类中相同 IFN 刺激细胞状态的标志物仍不清楚。为了解决这一限制并进一步弥合跨物种差距,我们首先基于在小鼠中标记反应的生物过程建立了一个功能特征,即 IFNα/γ反应和 NF-κB/TNFα信号传导。随后,我们分析了 8 名非小细胞肺癌(NSCLC)患者治疗前从血液中获得的公共 scRNA-seq 数据,并将小鼠衍生的特征应用于所有 6607 个可识别人类中性粒细胞。我们观察到一个细胞群高度富集我们的特征,由 IFN 诱导的基因标记。值得注意的是,这个群体显示出高水平的 Ly6E 表达,表明 Ly6E 是检测这些人类细胞的适当标志物。随后,为了测试 Ly6Ehi 中性粒细胞是否能预测人类免疫治疗反应,我们从接受 ICI 为主治疗的高级转移性 NSCLC(n = 50)和恶性黑色素瘤(n = 59)患者的一个独立混合队列中获得了治疗前的外周血单个核细胞(PBMCs),并量化了 Ly6Ehi 中性粒细胞的水平。为了清晰起见,重要的是要注意到在慢性疾病状态下发现的低密度中性粒细胞存在于 PBMC 部分。与小鼠一样,Ly6Ehi 中性粒细胞的高水平与反应和积极的临床结果强烈相关。显著的是,Ly6Ehi 中性粒细胞在两种癌症类型中将非反应者和反应者群体区分开(AUC ≈ 0.9),而在同一组 NSCLC 患者中测量的现有生物标志物(即 PDL1 IHC 和总中性粒细胞计数)表现不佳(分别为 AUC ≈ 0.6 和 0.75)。为了进一步加强和扩大这些发现,我们使用细胞特异性去卷积和表达插补方法,估算从六种不同癌症类型在免疫治疗前获得的 1237 个公开的、大规模 RNA-seq 样本中 Ly6Ehi 中性粒细胞的水平。在所有数据集中,除了一个数据集外,相对于非反应者,反应者中的中性粒细胞高度富集 Ly6Ehi 中性粒细胞衍生的 IFN 刺激特征(NeutIFN-15,基因:IFIT1、MX1、HERC5、IFI6、ISG15、IFIT3、RSAD2、GBP1、IFIT2、XAF1、PARP9、UBE2L6、IRF7、PARP14 和 APOL6)——包括在尿路上皮膀胱癌、胶质母细胞瘤、NSCLC、肾细胞癌、黑色素瘤和胃腺癌数据集中,在治疗前阶段。相反,先前发布的 IFN-γ 6 特征在这些数据集上的表现较差(平均 AUC 0.62 vs. AUC 0.88,分别为)(图 7A 底部和 S10 的原始数据)。此外,在一个数据集中,测量的现有生物标志物(PDL-1 IHC、tTMB 和 STK11/KEAP1 状态),NeutIFN-15 以显著更高的准确性预测结果。值得注意的是,在 203 个免疫治疗后采集的样本中,Ly6Ehi 中性粒细胞区分反应者和非反应者的能力减弱。综合来看,这些结果表明,无论是在血液中还是在肿瘤中测量,Ly6Ehi 中性粒细胞的水平在跨多种不同肿瘤类型的小鼠和人类中作为免疫治疗反应的预测性生物标志物。
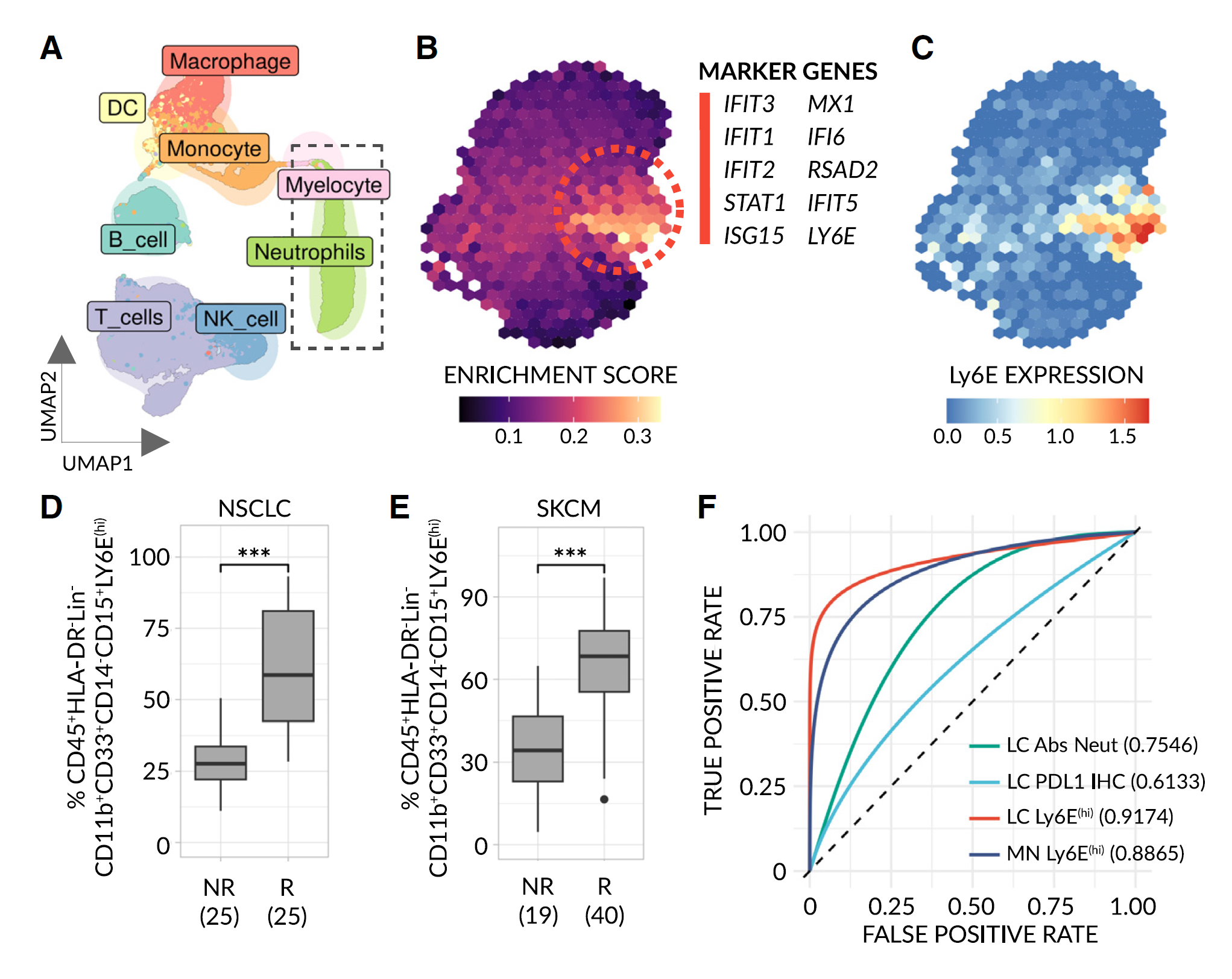
图 6 Ly6E(hi) 中性粒细胞在人体中作为免疫治疗反应的预测性生物标志物
(A)11702 个从公开可获得的非小细胞肺癌(NSCLC)scRNA-seq 数据(患者基线血样,n = 8)中提取的 CD45+ 细胞的 UMAP 图,细胞按细胞类型着色。
(B)分档 UMAP 图显示从(A)中分离的中性粒细胞(虚线框),细胞根据其 Ly6E(hi) 功能特征的富集程度着色。富集群体(虚线)的前 10 个最显著的标志基因列出(FDR < 0.001,log2 倍变化 > 1.5)。
(C)Ly6E 的分档规范化表达。为视觉清晰而插补数据。
(D 和 E)通过流式细胞术确定的独立 NSCLC 患者队列(n = 50)(D)和皮肤黑色素瘤(SKCM)患者队列(n = 59)(E)血液中 Ly6E(hi) 中性粒细胞的频率。有关门控策略,请参见图 S3B。数据按 RECIST 类别在 3 个月和/或 6 个月时分类(NR = 进展性疾病(PD),R = 稳定疾病(SD),部分或完全反应(P/CR))。每个单独组的样本量均注明。显著性通过单向曼 - 惠特尼检验评估(∗∗∗, p < 0.0001)。
(F)Ly6E(hi) 中性粒细胞(95% 置信区间:0.855–0.9705(NSCLC - LC),0.7913–0.9606(黑色素瘤 - MN))、绝对中性粒细胞计数(Abs Neut)(95% 置信区间:0.534–0.9328(在 NSCLC 中))和肿瘤 PDL1 IHC(95% 置信区间:0.3554–0.9338(在 NSCLC 中))在我们患者队列中的光滑面积(AUC)- 受试者工作特征(ROC)图(NR vs. R)。置信区间使用 1000 次分层引导复制确定。
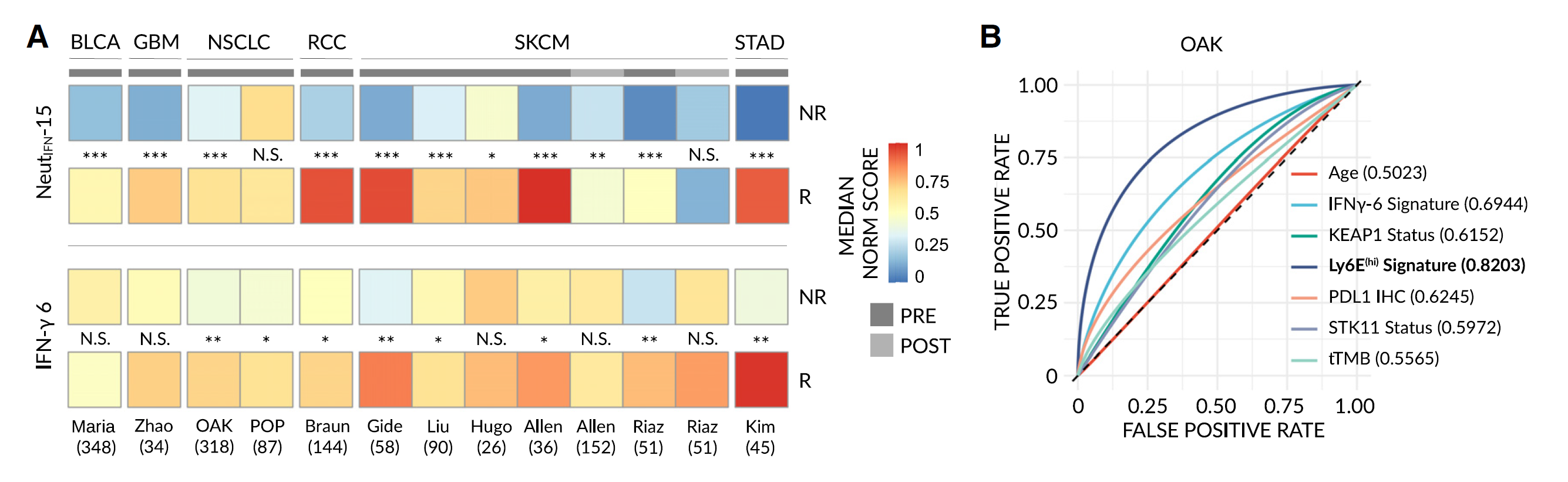
图 7A Ly6E(hi) 中性粒细胞衍生的基因特征在预测免疫治疗反应中优于现有生物标志物
(A)从 6 种癌症类型的 11 个数据集中的 1440 个公开样本中获得大规模 RNA-seq 表达谱,并对 15 基因 Ly6E(hi) 特征(NeutIFN-15)(顶部)或先前发布的 6 基因 IFNγ特征(底部)进行评分。显示每个数据集的中位数规范化富集得分热图,并测试组间显著差异(NR vs. R)。样本在治疗前(PRE)或治疗后(POST)采集。原始数据见图 S10。BLCA = 尿路上皮膀胱癌;GBM = 多形性胶质母细胞瘤;NSCLC = 非小细胞肺癌;RCC = 肾细胞癌;SKCM = 皮肤黑色素瘤;STAD = 胃腺癌。显著性通过单向曼 - 惠特尼检验评估(NS, p > 0.01;∗, p < 0.01;∗∗, p < 0.001;∗∗∗, p < 0.0001)。
(B)总肿瘤突变负荷(tTMB)(95% 置信区间:0.4865-0.6722)、年龄(95% 置信区间:0.4374-0.5766)、PDL1 免疫组织化学(IHC)(95% 置信区间:0.5534-0.7172)、STK11 突变状态(95% 置信区间:0.5246-0.6874)、KEAP1 突变状态(95% 置信区间:0.5334-0.7085)、IFNγ-6 特征得分(95% 置信区间:0.6253-0.7561)和 Ly6E(hi) NeutIFN-15 特征得分(95% 置信区间:0.7714-0.9105)在 OAK NSCLC 研究数据中的平滑曲线下面积(AUC)- 受试者工作特征(ROC)图(NR vs. R)。置信区间使用 1000 次分层引导复制确定。
讨论¶
免疫治疗的疗效受宿主(如免疫系统)与恶性细胞相互作用的复杂机制支配。通过将搜索范围缩小到预测反应的宿主细胞生物标志物,并且我们也拥有一个肿瘤依赖的机制,我们发现干扰素刺激的Ly6Ehi中性粒细胞作为一种血源性预测生物标志物,在小鼠和人类中具有潜在的高预测能力(在人类中AUC ≈ 0.9)。重要的是,Ly6Ehi中性粒细胞在各种癌症类型中似乎保持预测性。因此,我们的方法可能揭示了一种“泛癌”生物标志物,可以通过液体活检以成本效益高的方式进行检测,但需要进一步的临床验证。
中性粒细胞GR1+细胞或MDSCs通常具有强烈的促肿瘤性,作用是抑制抗肿瘤免疫。然而,Ly6Ehi中性粒细胞表现出抗肿瘤性,在小鼠中诱导免疫治疗反应并增强对肿瘤的免疫力,进一步凸显了髓系细胞状态在肿瘤微环境中的可塑性和重要性。在高度突变的小鼠4T1肿瘤中,肿瘤内在STING活性诱导IFN分泌并在肿瘤微环境中生成Ly6Ehi中性粒细胞,主要由IFNα/γ介导。由于技术限制,目前尚不清楚STING活性是否是所有情况下和所有癌症中Ly6Ehi表型的驱动因素。然而,鉴于我们的生物标志物具有广泛的预测能力,并且Ly6Ehi表型是由IFN诱导的,肿瘤微环境中局部IFN活性可能是免疫治疗反应机制中的一个关键且共同的步骤,无论具体的IFN来源或涉及的具体IFN类型(IFNα或IFNγ)。与此一致,研究表明IFNγ或其相关通路是免疫治疗反应的预测因子,尽管其预测能力低于Ly6Ehi中性粒细胞。此外,MHCI和PDL1分别的上调和下调,部分由于IFN刺激,也可以区分有反应和无反应的肿瘤,目前IFNs正在临床评估中作为与ICIs联合治疗的一部分。然而,IFN也被证明具有反常的促肿瘤作用并促进对抗PD1治疗的耐药性。确实,我们的研究表明,系统性IFNγ/α治疗与抗PD1结合,导致肿瘤生长的非显著减少,并且没有观察到细胞毒性CD8+ T细胞活性的变化。这可能是因为IFN部分通过Ly6Ehi中性粒细胞增强免疫治疗结果,但IFN的其他负面效应——或慢性、系统性IFN治疗——抵消了这一作用。无论如何,我们的研究进一步提供了关于IFNs在癌症生物学中复杂作用的机制性见解,通过“放大”并识别IFN的特定抗肿瘤效应(即生成Ly6Ehi中性粒细胞),可能有可能开发出缺乏IFN负面方面的治疗方法——正如我们的采用性转移结果所示。
我们显示Ly6Ehi中性粒细胞不仅作为一种生物标志物,还作为一种免疫调节剂——通过分泌已知的激活因子如IL-12b,创造有利于CD8+ T细胞活化的环境,从而使原本耐药的肿瘤对抗PD1治疗敏感。重要的是,Ly6Ehi中性粒细胞似乎在中心抗肿瘤T细胞反应的上游起作用,可能“准备”肿瘤做出反应。与此一致,治疗引发的中性粒细胞在抗PD1治疗后获得IFN基因特征,并且在人的反应过程中是必需的。因此,我们的工作扩展了这项研究,展示了治疗前存在预测性、IFN刺激的中性粒细胞。
重要的是要注意,虽然我们的临床前工作完全集中在抗PD1上,但我们的临床队列是混合的——包括接受ICI单药治疗(抗PD1、抗CLTA4或抗PDL1)或ICIs与其他治疗方式(如化疗)联合治疗的转移性NSCLC和黑色素瘤患者(n = 109)。因此,虽然在所有情况下Ly6Ehi中性粒细胞都保持高度预测性,但应设计进一步的前瞻性临床研究,包括新辅助治疗相关的研究,以验证这些结果在每个治疗组中的稳健性,以及Ly6Ehi中性粒细胞在各种治疗方案和肿瘤背景下(如特定突变)区分非反应者和反应者的能力。尽管如此,通过分析从接受ICI治疗的1237名癌症患者治疗前获得的公开的大规模RNA-seq数据集,我们的主要结论得到了进一步支持。在分析的所有样本中,除了一个数据集外,Ly6Ehi中性粒细胞衍生的基因特征(NeutIFN-15)的富集与对免疫治疗有反应的患者强烈相关(平均AUC > 0.9)——表明Ly6Ehi中性粒细胞作为生物标志物具有广泛的适用性。
此外,本研究还存在其他局限性。首先,我们的临床前模型基于癌细胞系,不包括基因工程小鼠模型或患者来源的异种移植模型。虽然这是临床前的局限性,但在临床上,我们证明了Ly6Ehi中性粒细胞作为潜在生物标志物的有效性,无论这些限制如何。此外,与之前的出版物一致,我们证明了高突变负荷有助于ICI反应性肿瘤,因为诱变引起了高度的免疫原性。值得一提的是,高突变负荷不一定与ICI结果相关;然而,对于我们的临床前方法,使用这种人工模型有助于ICI治疗结果的前瞻性预测。其次,在临床样本中检测Ly6Ehi中性粒细胞时,缺乏清晰、明确的细胞群体,而是相对于其他样本定义Ly6Ehi表型,Ly6E的表达本身占据一个连续体,而不是离散的阳性或阴性状态。因此,未来的临床研究应专注于通过使用这些细胞表达的内部标志物、CITE-seq或细胞表面标志物筛选来改进Ly6Ehi中性粒细胞的识别,以便使用预定义的绝对阈值充分区分反应者和非反应者。或者,机器学习分类器可能能够确定适当的基于流式细胞术的阈值——前提是有足够大的测试队列。第三,由于其在外周血中的短半衰期和脆弱性,中性粒细胞通常被忽视或丢弃,作为潜在生物标志物或生物学的来源,并且在人类中收集PBMCs的方法通常由于其高密度而排除中性粒细胞。然而,在癌症等疾病状态下,一部分中性粒细胞采用低密度状态,使其在临床上可获得,值得进一步研究。我们的研究本身进一步表明,中性粒细胞可以在从人类样本获得的冷冻PBMCs中可靠地检测到。
总体而言,尽管我们的研究有许多需要进一步探索和临床验证的局限性,但我们仍然提供了强有力的证据,表明IFN刺激的Ly6Ehi中性粒细胞预测ICI结果,并在反应的生成中发挥功能作用。