PR SET7 epigenetically restrains uterine interferon response and cell death governing proper postnatal stromal development
摘要¶
基质分化是出生后子宫发育过程中的标志性事件。然而,这一过程中发生的时空变化及其潜在的调控机制仍然不明。我们在这里全面描述了新生子宫的单细胞分辨率动态发育过程,并表征了两种不同的基质亚群:内基质和外基质。此外,单细胞 RNA 测序显示,子宫中唯一催化 H4K20me1 的甲基转移酶 Pr-set7 被消除后,由于大量细胞死亡,内基质的比例减少,从而阻碍了子宫发育。通过结合 RNA 测序和 H4K20me1 的表观遗传分析,我们证明了 PR-SET7-H4K20me1 直接抑制干扰素刺激基因的转录,或通过沉默内源性逆转录病毒间接限制干扰素反应。H4K20me1 水平下降导致基质细胞中病毒模拟反应和 ZBP1 介导的细胞凋亡和程序性坏死。总的来说,我们的研究揭示了由 PR-SET7 介导的表观遗传机制在出生后子宫基质发育中的重要作用。
引言¶
子宫源自米勒管,是哺乳动物生殖过程中至关重要的器官。在子宫发育过程中发生的干扰会对成年期的子宫结构和功能产生连锁反应,并导致不孕症。
在小鼠中,子宫在出生时(出生后第 1 天,PND1)相对未发育完善,仅由一层腔上皮和未分化的间充质组成。从 PND5 到 PND12,通过内陷和分支形成子宫内膜腺体,以及间充质协调分化为子宫内膜基质和子宫肌层,是小鼠出生后子宫发育中的两个里程碑事件。小鼠的子宫基本结构在 PND15 时建立起来。虽然各种研究已经确定了许多参与子宫腺体形成的重要基因,但出生后子宫基质发育的动态过程及其潜在的调控机制仍然很模糊。此前有报告提出,Misr2(米勒抑制物受体 2)阳性的次腔下细胞群作为祖细胞,根据单细胞 RNA 测序(scRNA-seq)进一步分化为两个基质亚群。然而,这项研究中的 scRNA-seq 分析仅在一个时间点进行,无法提供全面的基质发育景观。
表观遗传机制,包括 DNA 甲基化、组蛋白修饰和其他影响染色质可及性和三维染色质组织的修饰,通过控制基因表达在发育和疾病中发挥重要作用。PR-SET7 是一种进化上保守的组蛋白甲基转移酶,是已知唯一催化 H4K20me1 的酶,H4K20me1 是 H4K20me2/3 的底物。除了在细胞周期进程、DNA 损伤修复和基因转录调控中的经典功能外,最近研究表明,PR-SET7 介导的 H4K20me1 抑制内源性逆转录病毒(ERVs)的固有表达,有助于维持基因组稳定。越来越多的证据揭示了 PR-SET7 和 H4K20me1 在多个器官和组织的发育和稳态过程中不可或缺的作用。
PR-SET7 介导的 H4K20me1 在女性生殖中的病理生理学意义已有报道。滋养层特异性删除 Pr-set7 导致 ERV 去抑制、病毒模拟反应和程序性坏死,揭示了复发性流产的潜在病因和发病机制。同时,子宫 PR-SET7 缺失由于 DNA 损伤修复受损和严重的上皮细胞凋亡,限制了子宫上皮细胞的生长,阻碍了新生小鼠的腺体形成。然而,PR-SET7 介导的 H4K20me1 对子宫基质发育的潜在贡献被忽视了,仍不明确。
在本研究中,我们利用 scRNA-seq 生成了小鼠出生后前两周子宫发育的动态转录组图谱,描述了新生儿子宫中两种基质亚群(内基质和外基质细胞)的空间定位、发育轨迹和独特特征。此外,我们发现子宫 PR-SET7 缺失破坏了内基质细胞的发育,导致大量细胞死亡,进而导致子宫萎缩。通过结合大规模 RNA 测序(RNA-seq)和目标切割与标签法(CUT&Tag)的方法,我们阐明了 PR-SET7 介导的 H4K20me1 在表观遗传上限制干扰素反应的异常激活,并防止基质细胞中的 ZBP1 介导的细胞凋亡和程序性坏死,这揭示了 PR-SET7 介导的 H4K20me1 在校准干扰素信号传导以确保子宫内膜基质正常发育中的关键作用。
结果¶
scRNA-seq 揭示的出生后子宫发育的动态转录组景观¶
高度异质的子宫由多种细胞类型组成,在发育过程中经历巨大变化。为了全面理解出生后子宫发育的动态过程,收集了 PND1、PND5、PND10 和 PND15 的子宫组织,并进行了 scRNA-seq。在质量控制和批次效应校正后,识别出 13 个不同的细胞群,通过统一流形近似和投影(UMAP)可视化,包括三种基质(Str)亚群、三种上皮(Epi)亚群、两种子宫肌层(Myo)亚群、周皮细胞(Peri)、间皮细胞(Meso)、内皮细胞(Endo)、T 细胞和巨噬细胞(Mac),根据有据可查的标志基因。基质、上皮和子宫肌层细胞的比例波动变化。同时,周皮细胞、内皮细胞和白细胞的比例在整个出生后期间逐渐增加,反映了子宫血管的成熟和局部免疫微环境的建立。
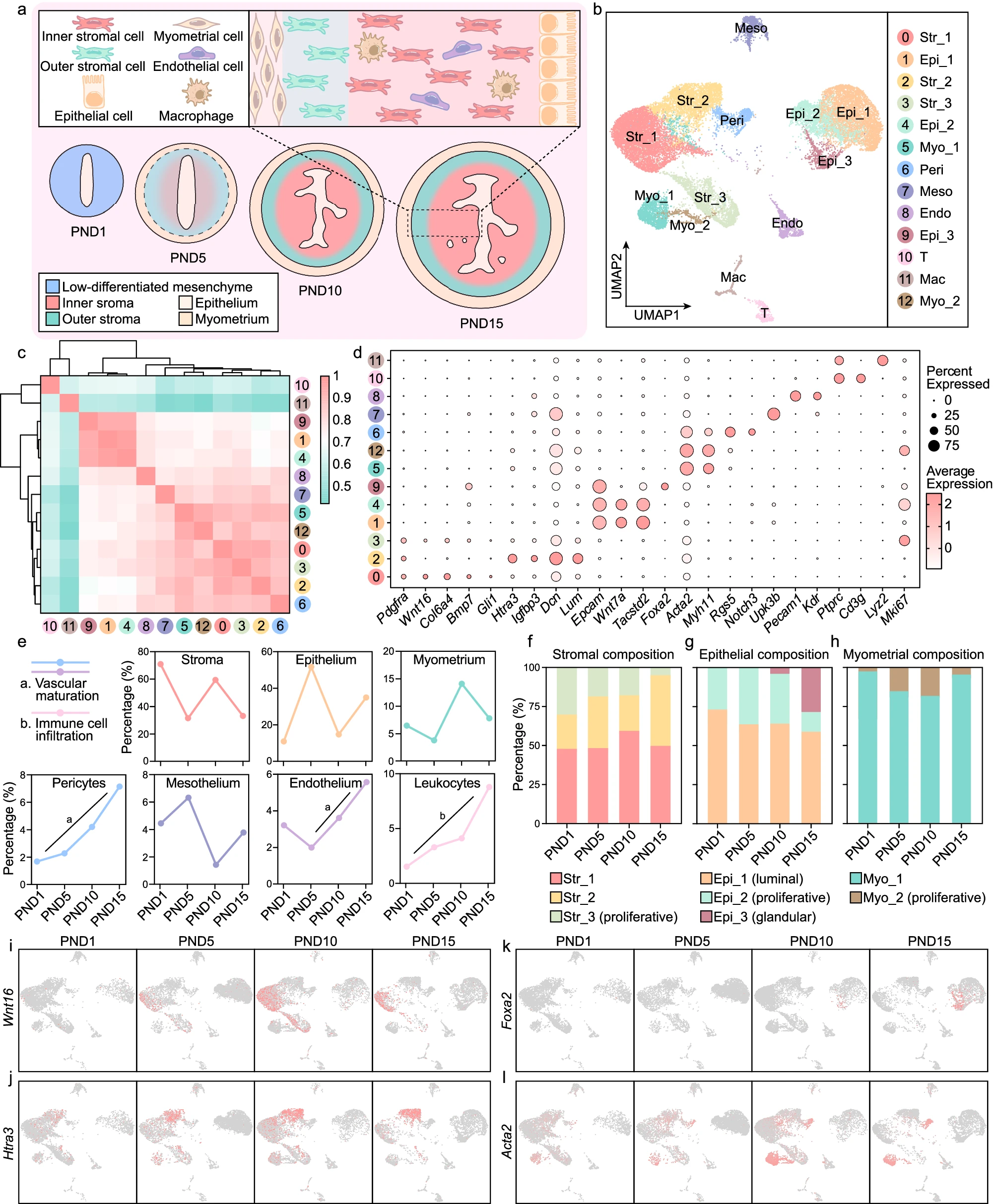
a. 动态示意图,说明了出生后子宫发育的过程。 b. UMAP 图,显示了新生子宫中的细胞群。 c. 不同细胞群转录组特征的斯皮尔曼相关性。 d. 气泡图,显示了不同细胞类型标志基因的表达情况。 e. 折线图,显示了不同时间点主要细胞类型的比例。 f–h. 柱状图,显示了 PND1、PND5、PND10 和 PND15 基质(f)、上皮(g)和子宫肌层(h)亚群的组成。 i–l. UMAP 可视化,显示了不同时间点 Wnt16(i)、Htra3(j)、Foxa2(k)和 Acta2(l)的表达情况。
基质细胞是新生子宫中最丰富的细胞类型(图 1b,e),包括特异性表达 Wnt 家族成员 16(Wnt16)的 Str_1,特征为高水平表达 HtrA 丝氨酸肽酶 3(Htra3)的 Str_2 和一个增殖性亚群 Str_3(图 1d)。增殖性基质细胞的比例逐渐减少,在 PND15 时显著下降,这与子宫发育的完成相吻合。在后续的研究中,我们主要关注 Str_1 和 Str_2。Str_1 和 Str_2 在出生时已经存在,但由于它们的标志基因表达水平在这一时间点几乎不可检测,因此它们似乎分化程度较低。在接下来的两周内,这两个亚群的标志基因表达水平增加,并且表达模式变得更加特异(图 1i,j),表明基质亚群的分化。
三种上皮亚群分别定义为腔上皮细胞(Epi_1)、一组增殖性上皮细胞(Epi_2)和腺上皮细胞(Epi_3),根据分别表达肿瘤相关钙信号转导子 2(Tacstd2)、增殖标志物 Ki67(Mki67)和叉头框 A2(Foxa2)(图 1d)。从 PND5 到 PND12 子宫内膜腺体的形成是子宫发育中的一个里程碑事件。与此一致,Foxa2 阳性的腺上皮细胞在 PND10 时出现,并且在 PND15 时这些细胞的数量显著增加(图 1g,k)。
α- 平滑肌肌动蛋白(Acta2)阳性的子宫肌层细胞根据 Mki67 的表达水平,进一步分为非增殖性(Myo_1)和增殖性(Myo_2)子宫肌层细胞(图 1d)。增殖性子宫肌层细胞的比例从 PND1 到 PND10 趋向增加,这与子宫肌层发育的进程一致。我们还注意到在 PND1 时子宫肌层形态出现之前,子宫肌层细胞的 Acta2 表达水平较低,暗示这些细胞的命运在出生时已经确定,并且它们保持在较低分化状态,直到子宫肌层的出现。
综上所述,我们在单细胞分辨率上描述了出生后子宫发育的动态过程,表明虽然子宫间充质在出生时看似均质,但较少分化的基质和子宫肌层细胞的命运早于先前的预期已经确定。
新生子宫中不同基质亚群的特征¶
为了阐明 Str_1 和 Str_2 的定位,使用特定探针对其标志基因 Wnt16 和 Htra3 进行了单细胞分辨率原位杂交(SCRINSHOT)。Wnt16 阳性的 Str_1 主要分布在腔上皮旁,这一亚群被定义为内基质细胞(图 2a)。同时,Str_2 高表达 Htra3,定位于子宫内膜的外围,这些细胞被定义为外基质细胞(图 2b)。
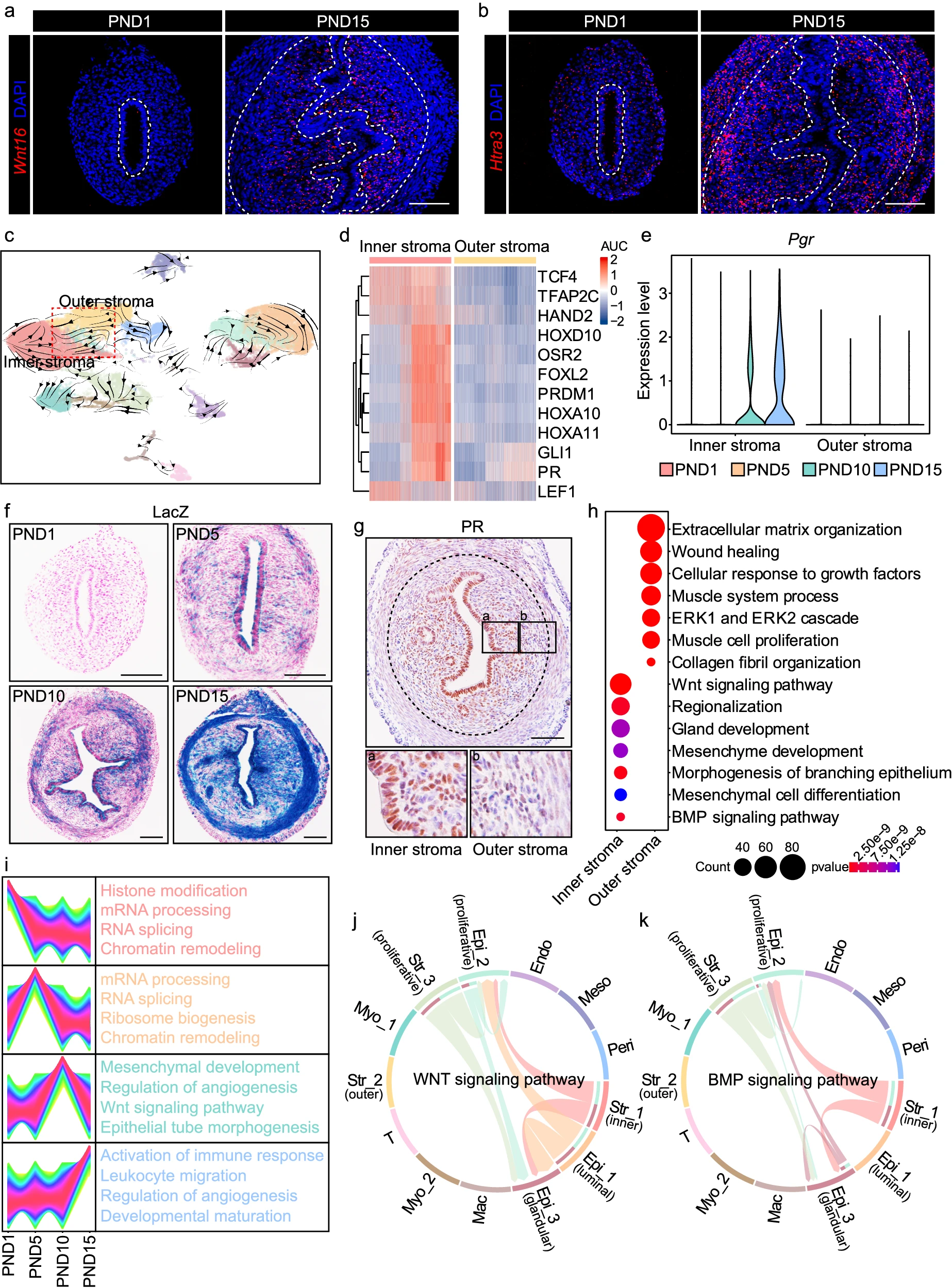
a, b SCRINSHOT 分析显示了 PND1 和 PND15 时子宫中 Wnt16(a)和 Htra3(b)的表达情况。虚线表示上皮和基质之间以及基质和子宫肌层之间的边界。比例尺:100 μm。 c RNA velocity 分析的可视化图。 d 热图显示了根据 SCENIC 分析在内基质细胞中排名靠前的调控子。 e 小提琴图显示了在出生后子宫发育过程中内基质和外基质中 Pgr 的表达水平。 f LacZ 染色显示了在 PND1、PND5、PND10 和 PND15 时子宫中 Pgr 的表达模式。比例尺:100 μm。 g PND15 时子宫中 PR 的 IHC 分析。虚线表示基质和子宫肌层之间的边界。比例尺:100 μm。 h 内基质和外基质中高表达基因的 GO 富集分析。显著性基于 clusterProfiler 的过度代表性分析。 i 不同时间点内基质细胞的基因表达聚类分析和 GO 分析。 j, k CellChat 分析显示了基质细胞和上皮细胞之间的 WNT(j)和 BMP(k)信号通路。
内基质和外基质在全局基因表达上显示出显著差异(补充图 2a)。为了系统解码这些基质亚群的发育轨迹,我们应用了 RNA velocity 分析,观察到从外基质细胞向内基质细胞的潜在分化方向(图 2c)。此外,我们进行了单细胞调控网络推断和聚类(SCENIC)分析,以解码调控内基质细胞分化的潜在转录因子(图 2d 和补充图 2b)。我们发现内基质细胞逐渐获得孕酮受体(PR)表达,而外基质细胞中的 PR 表达水平相对较低(图 2e–g),这表明内基质细胞在成年后对孕酮的反应能力更强。
为了更好地描绘内基质和外基质细胞的独特特征,我们选择了在这两个亚群中特异性高表达的基因,并进行了基因本体论(GO)富集分析。外基质细胞参与了与细胞外基质结构和胶原纤维组织相关的通路(图 2h),这与 RNA velocity 结果一致,即这一基质亚群表现出较低的分化状态。另一方面,内基质细胞特异性表达与 WNT 信号、BMP 信号以及间充质和腺体发育相关的基因(图 2h),这暗示了它们在调节子宫腺体形成中的潜在作用,正如之前报道的那样。我们注意到内基质细胞在 PND1 和 PND5 时高表达参与染色质重塑和 RNA 处理的基因。在 PND10,WNT 信号和上皮管状结构形态发生相关的通路表现出富集(图 2i),与子宫腺体的出现同步(图 1g)。与此一致,CellChat 分析显示内基质细胞与腺上皮细胞之间通过 WNT 和 BMP 信号通路进行密切相互作用(图 2j, k 和补充图 2c)。在 PND10 和 PND15 时,参与血管生成和白细胞趋化的基因表达显著增加,揭示了内基质细胞在促进这些关键事件中的作用(图 2i 和补充图 2d)。
总体而言,我们的 scRNA-seq 数据提供了关于不同基质亚群的空间定位、发育轨迹和独特特征的详细见解。
子宫特异性删除 Pr-set7 导致基质细胞大量死亡,从而阻碍基质生长¶
我们之前的研究主要关注 PR-SET7 对腺体生成的贡献;然而,我们注意到在缺乏 PR-SET7 的情况下,子宫内膜基质的生长也受到阻碍。因此,在本研究中,我们打算阐明 PR-SET7 介导的 H4K20me1 在子宫基质发育中的生理意义。我们首先使用原位杂交(ISH)、免疫荧光(IF)和蛋白质印迹(WB)评估了新生儿子宫中 Pr-set7 表达和 H4K20me1 修饰的时空模式(图 3a–c)。在出生后的前两周内,在所有子宫细胞类型中均检测到 Pr-set7 和 H4K20me1 信号(图 3a, b)。通过与基质细胞标志物 Wilms 肿瘤基因 1(WT1)的共染色,进一步确认了 H4K20me1 在基质区间的存在(图 3d)。
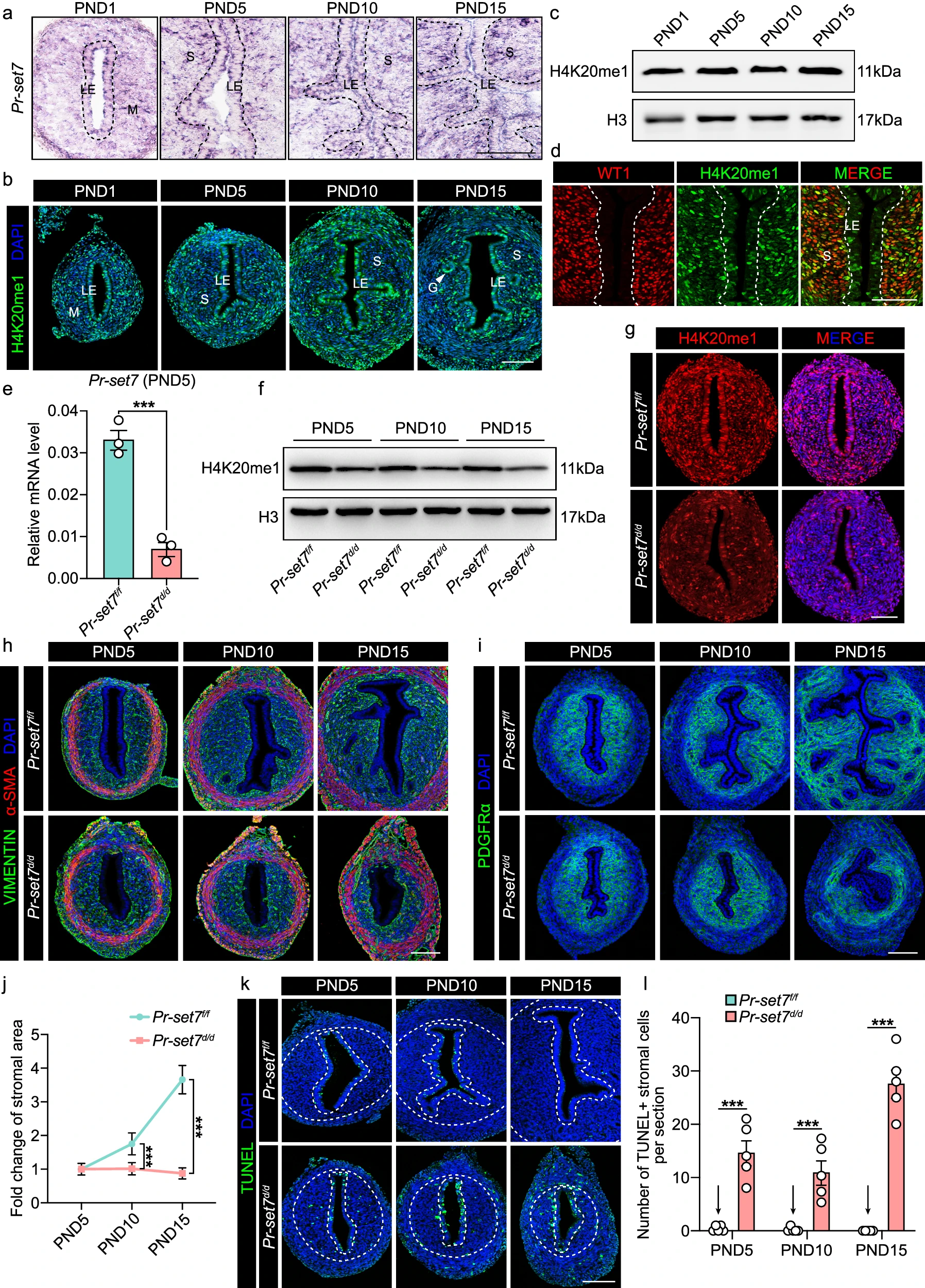
a. PND1、PND5、PND10 和 PND15 时子宫中 Pr-set7 的 ISH 分析。虚线表示上皮和基质之间的边界。LE 表示腔上皮,M 表示间充质,S 表示基质。比例尺:100 μm。 b. PND1、PND5、PND10 和 PND15 时子宫中 H4K20me1 的 IF 分析。LE 表示腔上皮,M 表示间充质,S 表示基质,GE 表示腺上皮。比例尺:100 μm。 c. PND1、PND5、PND10 和 PND15 时子宫中 H4K20me1 的 WB 分析。H3 用作装载对照。 d. 子宫中 H4K20me1 和 WT1 的共染色分析。LE 表示腔上皮,S 表示基质。虚线表示上皮和基质之间的边界。比例尺:100 μm。 e. PND5 时 Pr-set7f/f(n=3 只小鼠)和 Pr-set7d/d(n=3 只小鼠)子宫中 Pr-set7 mRNA 水平的 QRT-PCR 分析。值以 Gapdh 水平为标准化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=0.0008。 f. PND5、PND10 和 PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 H4K20me1 的 WB 分析。H3 用作装载对照。 g. PND5 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 H4K20me1 的 IF 分析。比例尺:100 μm。 h. PND5、PND10 和 PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 VIMENTIN 和α-SMA 的 IF 分析。比例尺:100 μm。 i. PND5、PND10 和 PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 PDGFRα的 IF 分析。比例尺:100 μm。 j. PND5、PND10 和 PND15 时 Pr-set7f/f(n=5 只小鼠)和 Pr-set7d/d(n=5 只小鼠)子宫中基质面积的倍数变化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=0.0001(PND10),p=4e-15(PND15)。 k. PND5、PND10 和 PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 TUNEL 分析。虚线表示上皮和基质之间,以及基质和子宫肌层之间的边界。比例尺:100 μm。 l. PND5、PND10 和 PND15 时 Pr-set7f/f(n=5 只小鼠)和 Pr-set7d/d(n=5 只小鼠)子宫中每个切片的 TUNEL+ 基质细胞数量。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=4e-6(PND5),p=0.0002(PND10),p=5e-11(PND15)。数据来源文件中提供了源数据。
为了揭示 PR-SET7 在出生后子宫发育中的潜在作用,通过将 Pr-set7 floxed 小鼠(以下简称 Pr-set7f/f)与 Pgr-IRES-Cre 小鼠交配,生成了子宫特异性缺失 Pr-set7 的小鼠(以下简称 Pr-set7d/d)。具体来说,删除了编码 PR-SET7 甲基转移酶活性的 SET 结构域的第 7 外显子。根据 LacZ 染色,Cre 重组酶在 PND5 时在子宫中表现出活性(图 2f)。在 PND5 时,定量逆转录聚合酶链反应(qRT-PCR)显示 Pr-set7 mRNA 在子宫中被有效删除(图 3e)。此外,WB(图 3f)和 IF(图 3g)显示,Pr-set7 删除后 H4K20me1 的水平明显下降。
考虑到小鼠子宫在出生后两周内发育,我们在这一关键时期内监测了子宫内膜基质的生长。IF 染色显示,VIMENTIN 和血小板源性生长因子受体α(PDGFRα)表明,在 Pr-set7f/f 雌性小鼠中,子宫基质面积从 PND5 到 PND15 增加了三倍以上。相比之下,Pr-set7d/d 组的基质面积甚至有所减少(图 3h–j)。
众所周知,PR-SET7 作为细胞周期和细胞生存的多功能开关。因此,我们推测 Pr-set7d/d 子宫中子宫内膜基质发育受阻是由异常的细胞增殖或死亡引起的。我们检测了几种细胞周期蛋白和细胞周期依赖性激酶抑制剂(CKIs)的表达,其中 p21 和 p16 由于 Pr-set7 删除而显著上调(补充图 3a,b)。然而,上调的 p21 仅在上皮细胞中检测到(补充图 3c),这表明 Pr-set7d/d 基质中的细胞周期进程受影响较小。一致地,通过 Ki67、增殖细胞核抗原(PCNA)和磷酸化组蛋白 H3(p-H3)的免疫组织化学(IHC)分析,显示 Pr-set7d/d 子宫中基质细胞的增殖与 Pr-set7f/f 组相当(补充图 3d-f)。随后,我们使用末端脱氧核苷酸转移酶介导的 dUTP 缺口末端标记(TUNEL)评估基质细胞死亡。几乎没有 Pr-set7f/f 子宫中的基质细胞表现出 TUNEL 信号,而大量 Pr-set7d/d 基质细胞发生了细胞死亡(图 3k,l)。
这些发现证明,PR-SET7 丧失后子宫内膜基质的有限生长是由于大量基质细胞死亡,而不是增殖受损。
子宫 PR-SET7 缺失导致内基质细胞数量减少和分化偏离¶
为了进一步描述由于 Pr-set7 缺失引起的子宫基质发育缺陷,我们使用 scRNA-seq 比较了 Pr-set7f/f 和 Pr-set7d/d 组之间的基质细胞组成和基因表达(图 4a,b)。在 Pr-set7d/d 组中观察到上皮细胞,尤其是腺上皮细胞(Epi_3)的比例显著减少(图 4b),这与之前的研究一致。此外,在 Pr-set7f/f 子宫中约占总基质细胞 60% 的内基质细胞比例在 PR-SET7 丧失后显著减少至 40%(图 4b,c)。
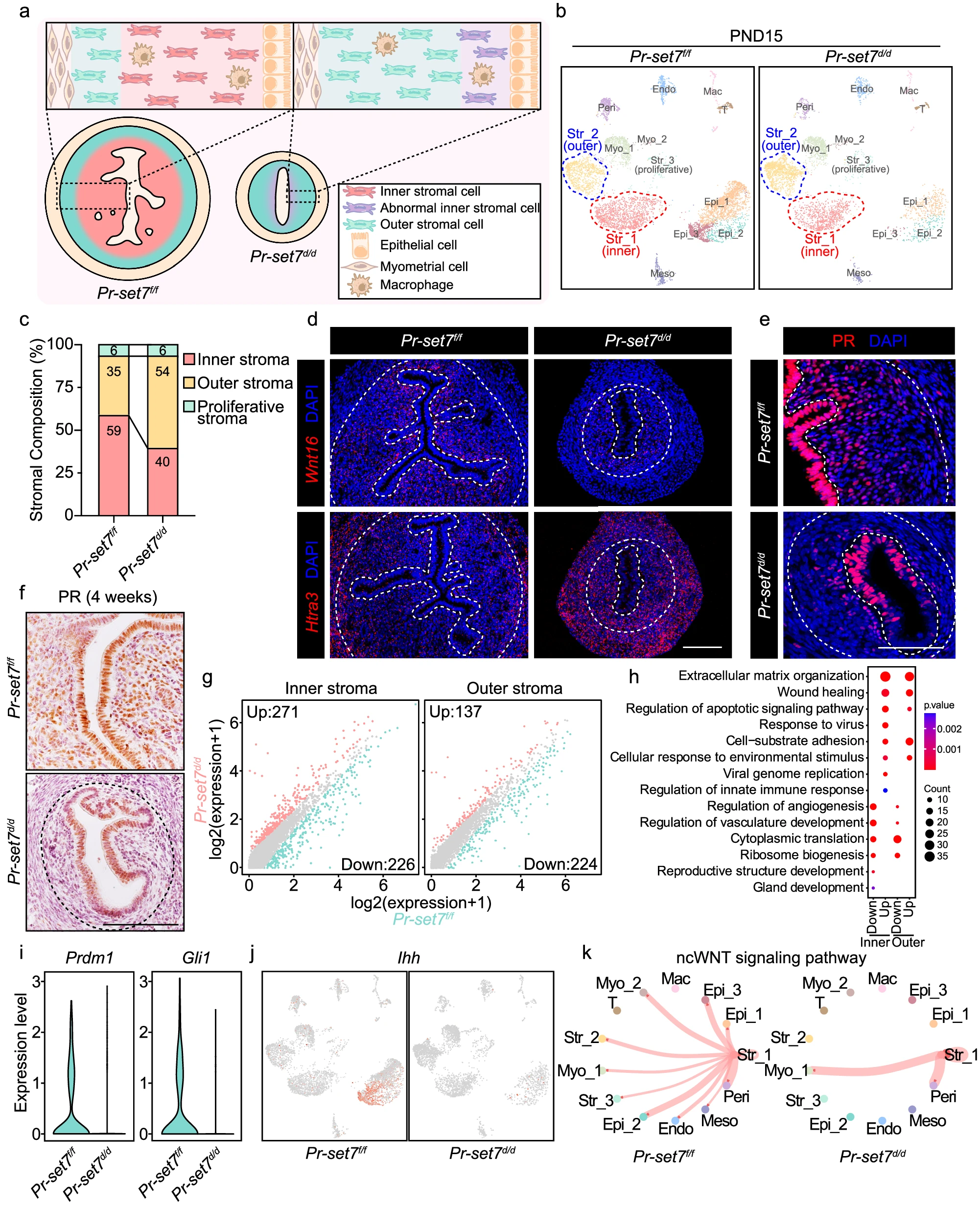
a. 示意图说明了 PND15 时 Pr-set7f/f 和 Pr-set7d/d 小鼠子宫的异质性。 b. UMAP 图显示了 PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中的细胞群。 c. PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中的基质亚群百分比。 d. PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 Wnt16 和 Htra3 的 SCRINSHOT 分析。虚线表示上皮和基质之间以及基质和子宫肌层之间的边界。比例尺:100 μm。 e. PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 PR 的 IF 分析。虚线表示上皮和基质之间以及基质和子宫肌层之间的边界。比例尺:100 μm。 f. 4 周龄 Pr-set7f/f 和 Pr-set7d/d 子宫中 PR 的 IHC 染色。虚线表示基质和子宫肌层之间的边界。比例尺:100 μm。 g. 散点图显示了 Pr-set7f/f 和 Pr-set7d/d 内基质和外基质中差异表达的基因。 h. PR-SET7 缺失引起的内基质和外基质细胞中上调和下调基因的 GO 功能分析。显著性基于 clusterProfiler 的过度代表性分析。 i. 小提琴图显示了 Pr-set7f/f 和 Pr-set7d/d 内基质中 Prdm1 和 Gli1 的表达。 j. UMAP 可视化显示了 Pr-set7f/f 和 Pr-set7d/d 子宫中 Ihh 的表达。 k. CellChat 分析显示了 Pr-set7f/f 和 Pr-set7d/d 子宫中不同细胞群之间的 ncWNT 信号通路。
一致地,我们在 Pr-set7d/d 子宫中观察到显著减少的 Wnt16 阳性内基质细胞和更多表达 Htra3 的外基质细胞(图 4d)。由于 PR 在内基质细胞中的表达较高(图 2e-g),PR 染色进一步验证了内基质细胞数量的减少(图 4e)。此外,我们意外地发现,4 周龄的 Pr-set7d/d 小鼠子宫中 PR 阳性内基质细胞完全消失(图 4f)。由于在缺乏 PR-SET7 的情况下,内基质中腔上皮下方观察到更多死亡细胞(图 3k),我们推测 Pr-set7d/d 子宫中异常减少的内基质亚群是由于大量细胞死亡,导致青春期前内基质细胞的完全消失。
除了基质亚群组成的改变,Pr-set7f/f 和 Pr-set7d/d 组内基质和外基质细胞的转录谱也显示出明显差异(图 4g)。内基质细胞相比于外基质细胞,Pr-set7 删除后,控制内基质分化和生殖结构发育的基因,如转录因子 Prdm1 和 Gli1 显著下调(图 4h, i)。此外,内基质细胞的促血管生成潜力也明显受到抑制(图 4h),表现为血管内皮生长因子 a(Vegfa)和肾上腺髓质素(Adm)的表达下调(补充图 4a)。同时,Pr-set7d/d 内基质中上调的基因特别富集于病毒防御反应和先天免疫反应(图 4h)。这些结果表明,子宫中 Pr-set7 的缺失干扰了内基质细胞的分化和稳态。
出生后子宫发育依赖于上皮和基质之间的复杂通讯。随着 Pr-set7d/d 内基质细胞中 Gli1 的下调,其上游的 Hedgehog 信号配体 Ihh 在上皮中完全消失(图 4j)。此外,CellChat 分析揭示了 Pr-set7f/f 和 Pr-set7d/d 新生儿子宫中不同细胞类型之间的复杂相互作用。Pr-set7d/d 子宫中细胞 - 细胞相互作用的数量和强度都显著减少(补充图 4b-c)。在 Pr-set7d/d 子宫中,潜在参与腺体形成的 WNT 和 BMP 信号通路(图 2j, k)在内基质和上皮之间完全消失(补充图 4c)。已有报道表明,基质来源的 WNT5A 通过激活非经典 WNT(ncWNT)信号通路参与腺体形成。我们确实观察到 Pr-set7d/d 组内基质细胞和上皮细胞之间的 ncWNT 信号通路受损(图 4k)。
总之,PR-SET7 的缺失导致内基质细胞数量减少和分化受损,进而影响子宫发育过程中上皮 - 基质的正确相互作用。
PR-SET7 缺失导致子宫中干扰素反应异常激. $¶
我们注意到 Pr-set7d/d 内基质细胞中上调的许多基因富集于免疫激活和凋亡信号通路(图 4h);因此,我们推测 Pr-set7d/d 内基质中大量细胞死亡与异常激活的免疫反应有关。事实上,Pr-set7d/d 子宫内基质中干扰素刺激基因(ISGs)的表达显著增加(图 5a 和补充图 5a)。此外,CellChat 分析显示,Pr-set7 删除后,几条与免疫相关的信号通路显著激活(补充图 5b)。
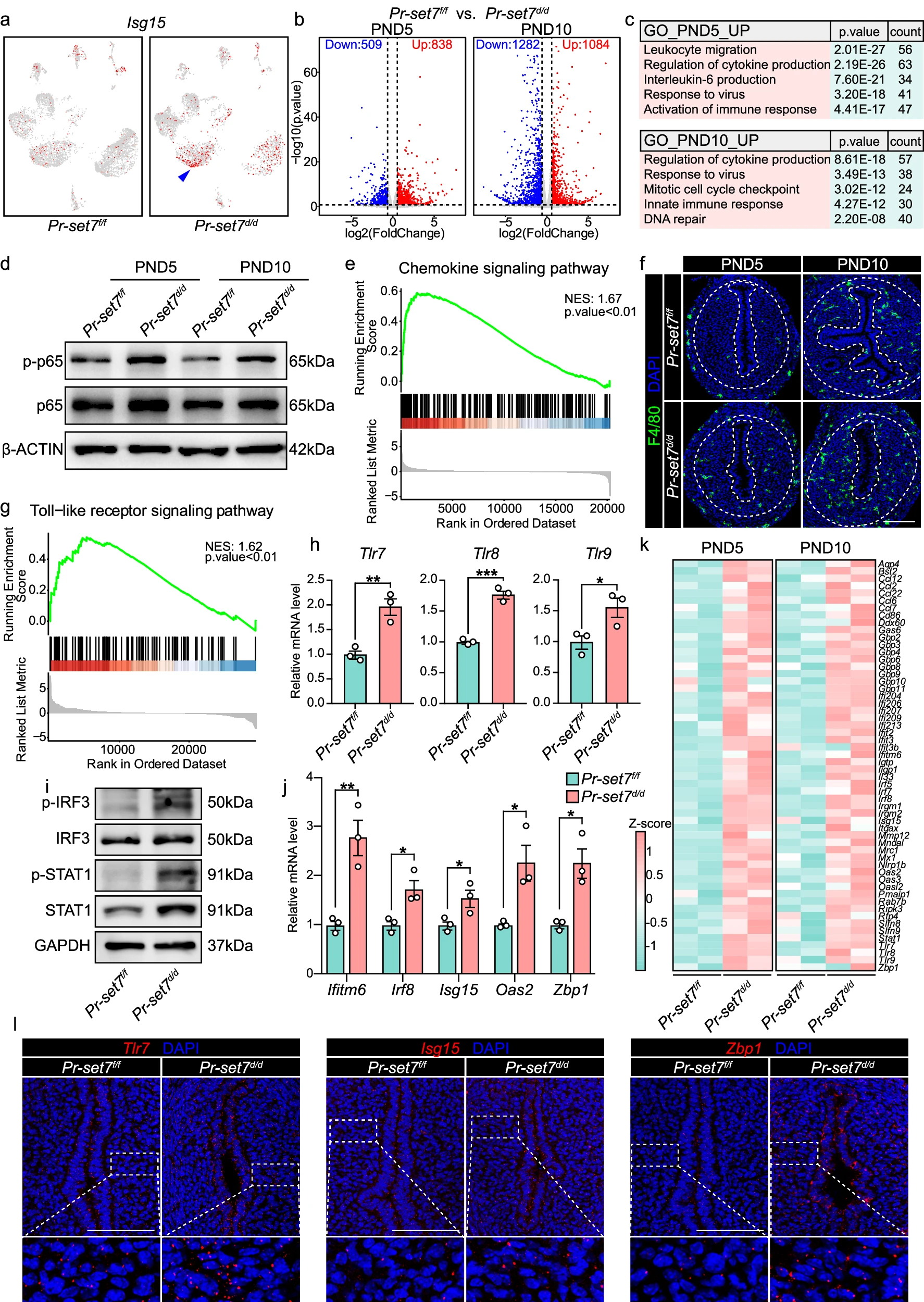
a. UMAP 可视化显示 PND15 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 Isg15 的表达。箭头表示 Pr-set7d/d 子宫内基质中的 Isg15 表达。
b. 火山图显示 PND5 和 PND10 时 Pr-set7 删除后子宫中差异表达的基因。显著性基于 DESeq2 的负二项检验。蓝点和红点分别代表下调和上调基因,而灰色表示未显著差异表达的基因。
c. PR-SET7 缺失引起的上调基因的 GO 功能分析。显著性基于 clusterProfiler 的过度代表性分析。
d. WB 分析显示 PND5 和 PND10 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 p-p65 和 t-p65 的水平。β-ACTIN 作为装载对照。
e. GSEA 分析显示 Pr-set7d/d 子宫中趋化因子信号通路相关基因的富集。显著性基于 clusterProfiler 的功能类评分。NES,标准化富集分数。
f. IF 分析显示 PND5 和 PND10 时 Pr-set7f/f 和 Pr-set7d/d 子宫中 F4/80 的表达。虚线表示上皮和基质之间以及基质和子宫肌层之间的边界。比例尺:100 μm。
g. GSEA 分析显示 Pr-set7d/d 子宫中与 Toll 样受体信号通路相关基因的富集。显著性基于 clusterProfiler 的功能类评分。NES,标准化富集分数。
h. QRT-PCR 分析显示 PND5 时 Pr-set7f/f(n=3 只小鼠)和 Pr-set7d/d(n=3 只小鼠)子宫中 Tlr7, Tlr8 和 Tlr9 的 mRNA 水平。值以 Gapdh 水平标准化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=0.0063(Tlr7),p=0.0004(Tlr8),p=0.0421(Tlr9)。
i. 免疫印迹分析显示 Pr-set7f/f 和 Pr-set7d/d 子宫中 p-IRF3、IRF3、p-STAT1 和 STAT1 的表达。GAPDH 作为装载对照。
j. QRT-PCR 分析显示 PND5 时 Pr-set7f/f(n=3 只小鼠)和 Pr-set7d/d(n=3 只小鼠)子宫中 ISGs 的表达水平。值以 Gapdh 水平标准化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=0.0085(Ifitm6),p=0.0254(Irf8),p=0.0461(Isg15),p=0.0252(Oas2),p=0.0139(Zbp1)。
k. 热图显示 PND5 和 PND10 时 Pr-set7f/f 和 Pr-set7d/d 组之间差异表达的 ISGs。
l. Pr-set7f/f 和 Pr-set7d/d 子宫中 Tlr7, Isg15 和 Zbp1 的 SCRINSHOT 分析。放大的图像表示基质区的 SCRINSHOT 信号。比例尺:100 μm。提供了源数据文件作为源数据。
为了进一步确认这些发现,我们对 Pr-set7f/f 和 Pr-set7d/d 小鼠的子宫进行了全转录组测序。在 PND5 和 PND10 分别鉴定出 1347 和 2366 个差异表达基因(fold change >=1.5, p < 0.05)(图 5b)。具体来说,在 PND5 时,Pr-set7d/d 子宫中 838 个基因上调,509 个基因下调。在 PND10 时,1084 个基因上调,而 1282 个基因下调。GO 富集分析显示,Pr-set7 删除后上调的基因主要富集于与先天免疫反应激活密切相关的条款,包括对病毒的反应、细胞因子生成和白细胞迁移(图 5c)。
涉及 NF-κB 信号传导的基因在 Pr-set7d/d 子宫中显著增加,NF-κB 信号传导是先天免疫的关键调节器,促进促炎性细胞因子和趋化因子的分泌(补充图 6a)。WB 分析进一步证明了 PR-SET7 缺失导致的 NF-κB 通路激活,表现为磷酸化 p65 水平升高(图 5d)。此外,PR-SET7 缺失导致白细胞趋化相关基因表达增加(补充图 6a)。基因集富集分析(GSEA)表明趋化因子信号通路的激活(图 5e)。此外,通过 CD45 和 F4/80 染色观察到 Pr-set7d/d 子宫基质区明显的白细胞,尤其是巨噬细胞的浸润和聚集(图 5f 和补充图 6b),暗示基质区存在炎症环境。
正如前文所述,子宫中 PR-SET7 缺失导致对病毒感染的免疫反应夸大(图 5c)。一旦病毒感染发生,宿主的先天免疫系统会促使某些模式识别受体(PRRs)识别来源于微生物的病原体相关分子模式(PAMPs,保守的微生物结构)或内源性损伤相关分子模式(DAMPs,组织损伤标志物)。这些 PRRs 包括 Toll 样受体(TLRs)、核苷酸寡聚化结构域(NOD)样受体(NLRs)、RIG-I 样受体(RLRs)等。事实上,与抗病毒通路相关的基因集,包括 TLR 信号、NLR 信号和细胞质 DNA 感应信号,显著富集于 Pr-set7d/d 子宫上调的基因中(图 5g 和补充图 6c),qRT-PCR 分析进一步确认了若干 TLRs 水平的升高(图 5h)。
在识别病毒后,PRRs 激活下游转录因子,如干扰素调节因子 3(IRF3)和 7(IRF7),导致干扰素的产生,干扰素是一组负责抗病毒防御的细胞因子。通过与特定受体结合,干扰素进一步驱动信号转导和转录激活因子 1(STAT1)和 2(STAT2)的磷酸化,最终导致 ISGs 的产生和抗病毒反应的放大。我们观察到 p-IRF3 和 p-STAT1 水平显著增加,表明干扰素信号通路的激活(图 5i)。此外,在 Pr-set7 删除后,56 个 ISGs,包括干扰素诱导跨膜蛋白 6(Ifitm6)、干扰素调节因子 8(Irf8)、干扰素刺激基因 15(Isg15)、2'-5' 寡腺苷酸合成酶 2(Oas2)和 Z-DNA 结合蛋白 1(Zbp1)的表达显著增加(fold change >= 1.2, p < 0.05)(图 5j, k)。
由于上述研究是在整个子宫上进行的,我们随后旨在调查在缺乏 PR-SET7 的情况下基质细胞是否经历了抗病毒防御的过度激活。SCRINSHOT 用于检测上调的 TLRs 和 ISGs 的定位。实际上,在上皮和内基质区观察到显著更多的 Tlr7、Isg15 和 Zbp1 信号(图 5l),证实在缺乏 PR-SET7 的情况下内基质细胞经历了过度的抗病毒免疫激活。
H4K20me1 在 DNA 损伤修复中起着不可或缺的作用。与此一致,Pr-set7 的删除也导致子宫中 DNA 损伤的显著累积。p53 信号通路在对 DNA 损伤的反应中显著激活(补充图 6d)。同时,与对照小鼠相比,Pr-set7d/d 突变体的子宫基质区中γH2A.X 染色显示更多的 DNA 双链断裂细胞(补充图 6e, f),这与 TUNEL 分析的结果一致(图 3k, l)。
H4K20me1 通过直接和间接方式抑制 ISGs 的表达¶
根据已发表的文献,H4K20me1 对基因转录产生促进或抑制作用。为了挖掘 Pr-set7 缺失后内基质分化受损和抗病毒反应过度的潜在原因,对 PND5 和 PND10 的子宫组织进行了 CUT&Tag 分析,发现 H4K20me1 修饰主要分布在基因启动子和内含子上(图 6a-c)。
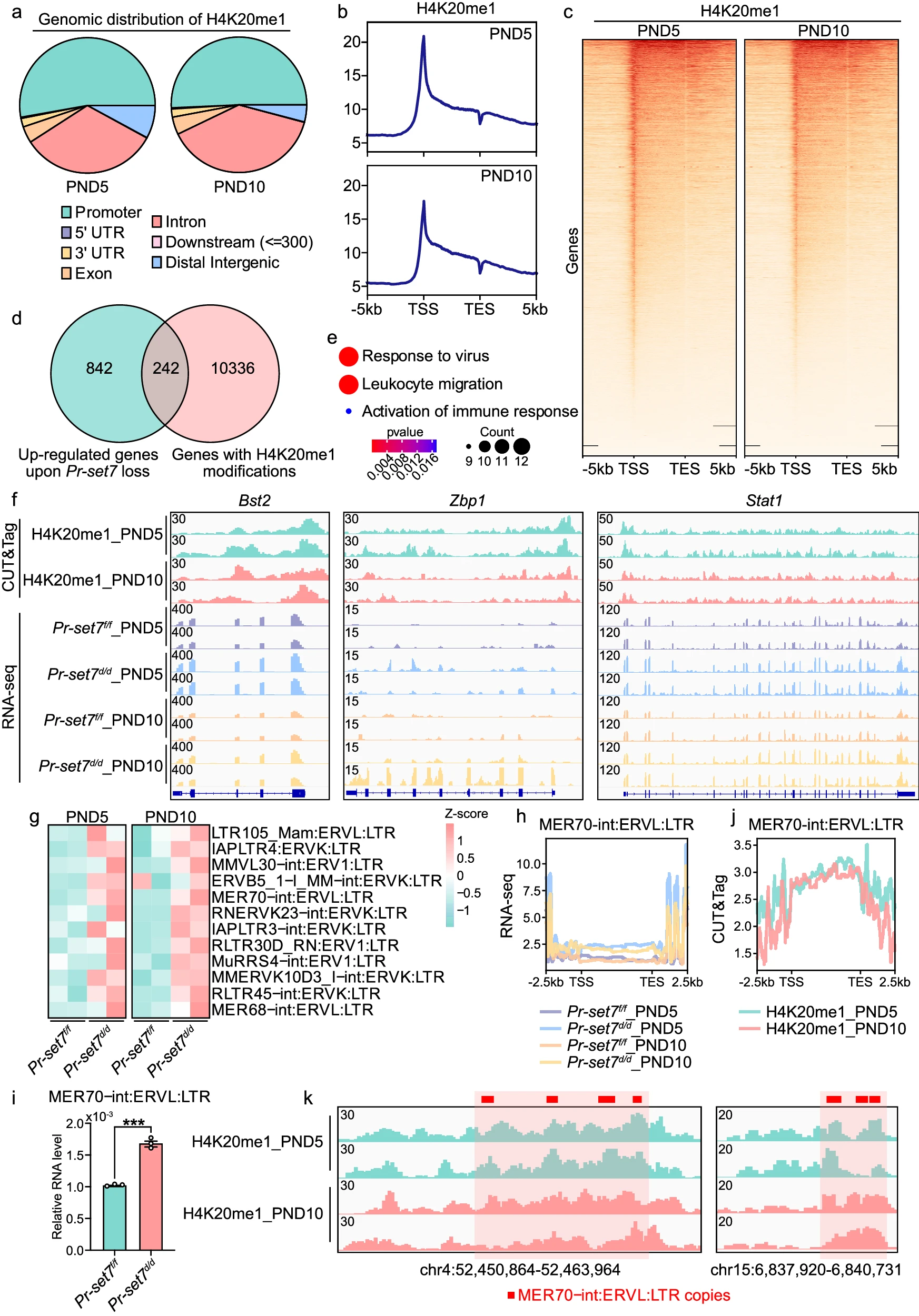
a. 显示 H4K20me1 基因组分布的饼图。
b. 分布图显示标准化 H4K20me1 CUT&Tag 信号的分布情况。TSS 表示转录起始位点,TES 表示转录终止位点。
c. 热图显示标准化 H4K20me1 CUT&Tag 信号的分布情况。TSS 表示转录起始位点,TES 表示转录终止位点。
d. 韦恩图显示 PR-SET7 缺失后上调的基因(n=1084)和具有 H4K20me1 修饰的基因(n=10578)。
e. 直接受 H4K20me1 抑制的基因的 GO 富集分析。显著性基于 clusterProfiler 的过度代表性分析。
f. 基因组浏览器视图显示标准化 H4K20me1 CUT&Tag 信号以及 Pr-set7f/f 和 Pr-set7d/d RNA-seq 信号在 Pr-set7 缺失后上调且具有 H4K20me1 占据的部分 ISGs 上的分布。
g. 热图显示 PND5 和 PND10 时 PR-SET7 缺失导致的异常上调的 ERVs。
h. 分布图显示 Pr-set7f/f 和 Pr-set7d/d RNA-seq 信号在 MER70-int:ERVL:LTR 的主体区域上的分布情况。TSS 表示转录起始位点,TES 表示转录终止位点。
i. QRT-PCR 分析显示 PND5 时 Pr-set7f/f(n=3 只小鼠)和 Pr-set7d/d(n=3 只小鼠)子宫中 MER70-int:ERVL:LTR 的水平。值以 Gapdh 水平标准化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。*p=0.0002。
j. 分布图显示标准化 H4K20me1 CUT&Tag 信号在 MER70-int:ERVL:LTR 主体区域上的分布情况。TSS 表示转录起始位点,TES 表示转录终止位点。
k. 基因组浏览器视图显示 MER70-int:ERVL:LTR 拷贝上的标准化 H4K20me1 CUT&Tag 信号。提供了源数据文件作为源数据。
Motif 分析表明,带有 H4K20me1 修饰的基因启动子具有同源盒 A10(HOXA10)的结合基序(补充图 7a),HOXA10 是涉及女性生殖道模式和内基质特异性的关键间充质转录因子(图 2d),这表明 H4K20me1 在内基质发育相关基因的转录调控中的作用。此外,在 Pr-set7d/d 内基质细胞中显著下调的 Prdm1 和 Gli1 基因体上也检测到 H4K20me1 修饰(补充图 7b)(图 4i)。
与此同时,H4K20me1 占据的启动子上高概率出现干扰素调节因子 4(IRF4)、网状内皮瘤癌基因(REL,NF-κB 亚基)和 IRF3 的基序(补充图 7a),这表明 H4K20me1 可能参与调控先天免疫相关基因的转录。通过结合 CUT&Tag 和 RNA-seq 数据,我们发现 PR-SET7 缺失上调的基因与带有 H4K20me1 修饰的基因重叠,并识别出 242 个直接被 H4K20me1 抑制的基因(图 6d)。这些基因被用于 GO 分析,结果显示许多基因与对病毒的反应、白细胞迁移和免疫反应的激活有关(图 6e)。因此,我们合理推测,Pr-set7 删除上调的 ISGs 可能直接受到 H4K20me1 修饰的抑制。事实上,结合 CUT&Tag 结果与 RNA-seq 数据,我们观察到部分在 PR-SET7 缺失后上调的 ISGs 在启动子和基因体上带有 H4K20me1 修饰,包括骨髓基质细胞抗原 2(Bst2)、Zbp1 和 Stat1(图 6f),表明这些基因的表达直接受到 H4K20me1 的抑制。然而,我们注意到部分上调的 ISGs 没有明显的 H4K20me1 占据(补充图 7c),表明 H4K20me1 通过其他机制影响这些基因的转录。
如上所述,Pr-set7d/d 子宫中激活了对病毒的反应。考虑到病毒感染在出生后子宫发育过程中很少发生,我们推测过度激活的抗病毒反应源于内源性逆转录病毒(ERVs)的存在。在正常情况下,ERVs 通过表观遗传机制被沉默以维持基因组稳定。ERVs 的抑制机制包括组蛋白甲基化(如 H3K9me3 和 H4K20me3)、DNA 甲基化和 RNA 甲基化。为了验证 H4K20me1 是否也参与了 ERVs 的沉默,我们对 RNA-seq 数据进行了转座元件分析,发现多个 ERVs,包括 MER70-int:ERVL:LTR,在 PR-SET7 失效后异常升高(图 6g, h),这一结果也通过 qRT-PCR 得到验证(图 6i)。此外,CUT&Tag 显示 H4K20me1 在 MER70 及其他多个 ERVs(如 LTR105_Mam:ERVL:LTR 和 MER68-int:ERVL:LTR)的基因体上沉积(图 6j, k 和补充图 7d)。
考虑到短读测序在处理重复序列方面的潜在困难,我们注意到我们研究的大多数 ERVs 长度都小于 300 bp(补充图 8a),同一家族的不同 ERV 拷贝由于进化过程中插入、删除和替换而高度可变。由于我们进行了配对末端 150 bp 测序,ERV 序列的比对应该是准确的。为了进一步确认这一点,我们选择了几个在 PR-SET7 失效后根据 RNA-seq 数据上调的 ERV 拷贝(补充图 8b),从子宫基质细胞转录本中扩增了每个拷贝的全长并进行了 Sanger 测序。扩增的全长 ERV 拷贝准确地映射到从 UCSC 基因组浏览器的 RepeatMasker 下载的 ERV 序列(补充图 8c),验证了我们读段比对的准确性。
综上所述,这些发现表明 H4K20me1 直接抑制了某些 ISGs 的转录;另一方面,H4K20me1 通过介导 ERVs 的沉默间接防止了失控的抗病毒免疫。
H4K20me1 水平下降导致病毒模拟反应并导致 ZBP1 介导的程序性坏死和凋亡 考虑到新生子宫由多种细胞类型组成,为了强化 PR-SET7 在基质细胞中的特异性作用,从出生后子宫中分离出的小鼠子宫内膜基质细胞在体外培养,并用 DMSO(作为对照)或 UNC0379(PR-SET7 的选择性底物竞争性抑制剂)处理。5 μM UNC0379 的剂量足以降低培养的子宫基质细胞中的 H4K20me1 水平(图 7a)。与体内证据一致,我们观察到 ERVs 水平异常升高(图 7b)。由于 ERVs 之前被报道会导致 dsRNAs 的积累,我们使用 J2 抗体进行了点杂交和 IF 分析,J2 抗体特异性识别 dsRNAs。如预期,损害 PR-SET7 介导的 H4K20me1 导致胞质 dsRNA 积累显著增加(图 7c, d)。
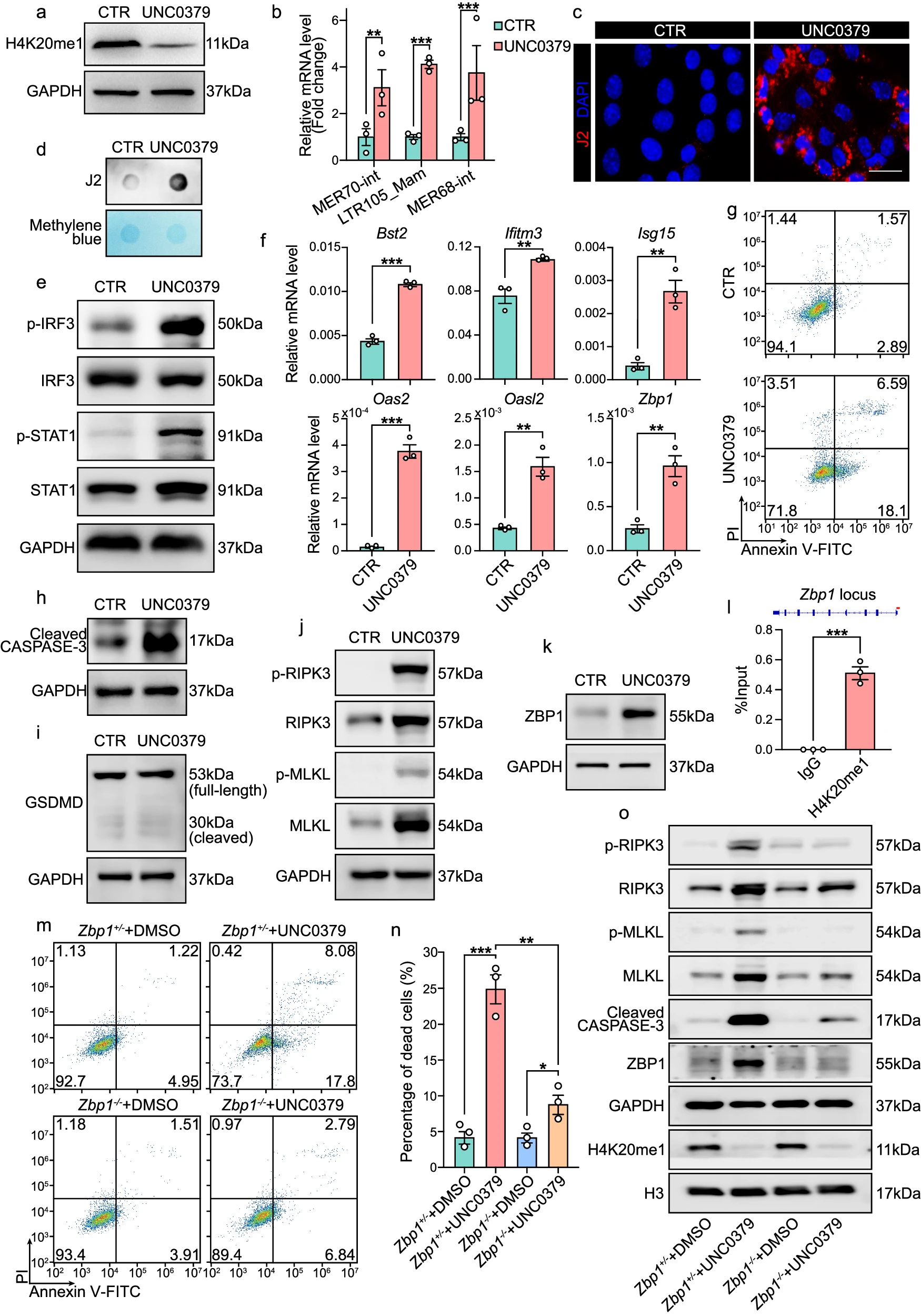
a. WB 分析显示在用 DMSO(CTR)或 UNC0379 处理的培养子宫内膜基质细胞中的 H4K20me1 水平。GAPDH 作为装载对照。
b. QRT-PCR 分析显示在用 DMSO(CTR,n=3 个独立生物重复)或 UNC0379(n=3 个独立生物重复)处理的培养子宫基质细胞中 ERVs 的 mRNA 水平。值以 Gapdh 水平标准化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=0.0064(MER70-int),p=0.0002(LTR105_Mam),**p=0.0008(MER68-int)。
c. IF 分析显示在用 DMSO(CTR)或 UNC0379 处理的培养子宫内膜基质细胞中的 dsRNA 水平。比例尺:50 μm。
d. 点杂交分析显示在用 DMSO(CTR)或 UNC0379 处理的培养子宫内膜基质细胞中的 dsRNA 水平。
e. 免疫印迹分析显示在用 DMSO(CTR)或 UNC0379 处理的培养子宫内膜基质细胞中的 p-IRF3、IRF3、p-STAT1 和 STAT1 水平。GAPDH 作为装载对照。
f. QRT-PCR 分析显示在用 DMSO(CTR,n=3 个独立生物重复)或 UNC0379(n=3 个独立生物重复)处理的培养子宫内膜基质细胞中 ISGs 的 mRNA 水平。值以 Gapdh 水平标准化。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=6e-5(Bst2),p=0.0074(Ifitm3),p=0.0032(Isg15),p=0.0001(Oas2),p=0.0029(Oasl2),**p=0.0050(Zbp1)。
g. Annexin V/PI 凋亡分析显示在用 DMSO(CTR)或 UNC0379 处理的培养子宫内膜基质细胞中的凋亡水平。
h–k. 免疫印迹分析显示在用 DMSO(CTR)或 UNC0379 处理的培养子宫内膜基质细胞中的 Cleaved CASPASE-3(h)、GSDMD(i)、p-RIPK3、RIPK3、p-MLKL 和 MLKL(j)以及 ZBP1(k)水平。GAPDH 作为装载对照。
l. ChIP-qRT-PCR 分析显示在 Zbp1 位点上的 H4K20me1 水平。数据代表 3 个独立的生物重复。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。*p=0.0003。
m. Annexin V/PI 凋亡分析显示在用 DMSO 或 UNC0379 处理的培养 Zbp1+/−基质细胞和用 DMSO 或 UNC0379 处理的培养 Zbp1−/−基质细胞中的凋亡水平。
n. 显示在用 DMSO(n=3 个独立生物重复)或 UNC0379(n=3 个独立生物重复)处理的 Zbp1+/−基质细胞和用 DMSO(n=3 个独立生物重复)或 UNC0379(n=3 个独立生物重复)处理的 Zbp1−/−基质细胞中的细胞死亡百分比。数据以平均值±标准误(SEM)表示。双尾非配对学生 t 检验。p=0.0007,p=0.0023,p=0.0240。
o. 免疫印迹分析显示在用 DMSO 或 UNC0379 处理的 Zbp1+/−基质细胞和用 DMSO 或 UNC0379 处理的 Zbp1−/−基质细胞中的 p-RIPK3、RIPK3、p-MLKL、MLKL、Cleaved CASPASE-3、ZBP1 和 H4K20me1 水平。GAPDH 和 H3 作为装载对照。
与此同时,病毒模拟级联反应被引发,这表现在 p-IRF3 和 p-STAT1 的升高(图 7e)以及包括 Bst2、Isg15、Oas2、Zbp1、Ifitm3 和 Oasl2 在内的 ISGs 水平增加(图 7f)。此外,Annexin V-FITC/PI 共染色显示 UNC0379 处理后细胞死亡比例显著增加(图 7g 和补充图 9)。为了进一步探讨 PR-SET7 抑制导致的细胞死亡模式,我们检查了凋亡(图 7h)、焦亡(图 7i)和坏死性凋亡(图 7j)的标志物,发现凋亡和坏死性凋亡通路显著激活,表现为 Cleaved CASPASE-3、p-RIPK3(受体相互作用蛋白激酶 3)和 p-MLKL(混合谱系激酶结构域样蛋白)水平升高(图 7h, j)。
此外,为了进一步巩固我们的发现,我们从 Pr-set7f/f 小鼠中获取了原代子宫基质细胞,并用携带 Cre 重组酶的质粒进行瞬时转染。尽管原代子宫基质细胞的转染效率相对较低(补充图 10a-c),我们仍观察到干扰素反应和细胞死亡的激活(补充图 10d, e)。
在后续研究中,我们旨在弥合过度激活的免疫反应和细胞死亡之间的差距,最终重点关注 ZBP1。ZBP1 的表达由干扰素信号诱导,能够通过其 Zα结构域检测病毒感染期间产生或由 ERVs 转录产生的 Z 型核酸,并通过共享的受体相互作用蛋白同型相互作用基序(RHIMs)招募 RIPK3,最终导致多种细胞死亡模式,包括凋亡和坏死性凋亡。无论是通过 Pr-set7 删除还是 UNC0379 处理,H4K20me1 的下降显著上调了 ZBP1 的 mRNA 和蛋白水平(图 5j, l 和图 7f, k)。CUT&Tag 显示 H4K20me1 占据了 Zbp1 启动子区域,使用一对靶向 Zbp1 启动子位点的引物进行的染色质免疫沉淀(ChIP)-qRT-PCR 进一步证明 Zbp1 是 H4K20me1 的直接靶点(图 7l)。为了探讨 UNC0379 给药引起的细胞死亡是否由 ZBP1 介导,从 Zbp1+/−和 Zbp1−/−小鼠子宫中获得的子宫内膜基质细胞进行了 UNC0379 处理。根据 Annexin V-FITC/PI 共染色和免疫印迹分析,PR-SET7 抑制引起的细胞凋亡和坏死性凋亡在 ZBP1 缺失后显著减弱(图 7m-o)。
这些发现强调了 ZBP1 在 PR-SET7 抑制引起的异常激活的 ERVs 和病毒模拟反应导致的细胞死亡执行中的关键作用。
讨论¶
由于缺乏先进的方法和适当的遗传模型,出生后子宫基质发育的时空进程和潜在调控机制一直是一个长期的谜团。在此,我们在单细胞分辨率上描绘了新生子宫在出生后发育期间的转录组图谱。与之前的报告一致,定义了两个不同的基质亚群,并剖析了这两个基质亚群的空间分布、发育轨迹和潜在功能。此外,利用子宫特异性删除 Pr-set7 的小鼠模型,我们证明了 PR-SET7 介导的 H4K20me1 通过表观遗传地限制过度的干扰素反应和随后的细胞死亡,促进了内基质亚群的正常发育(图 8)。
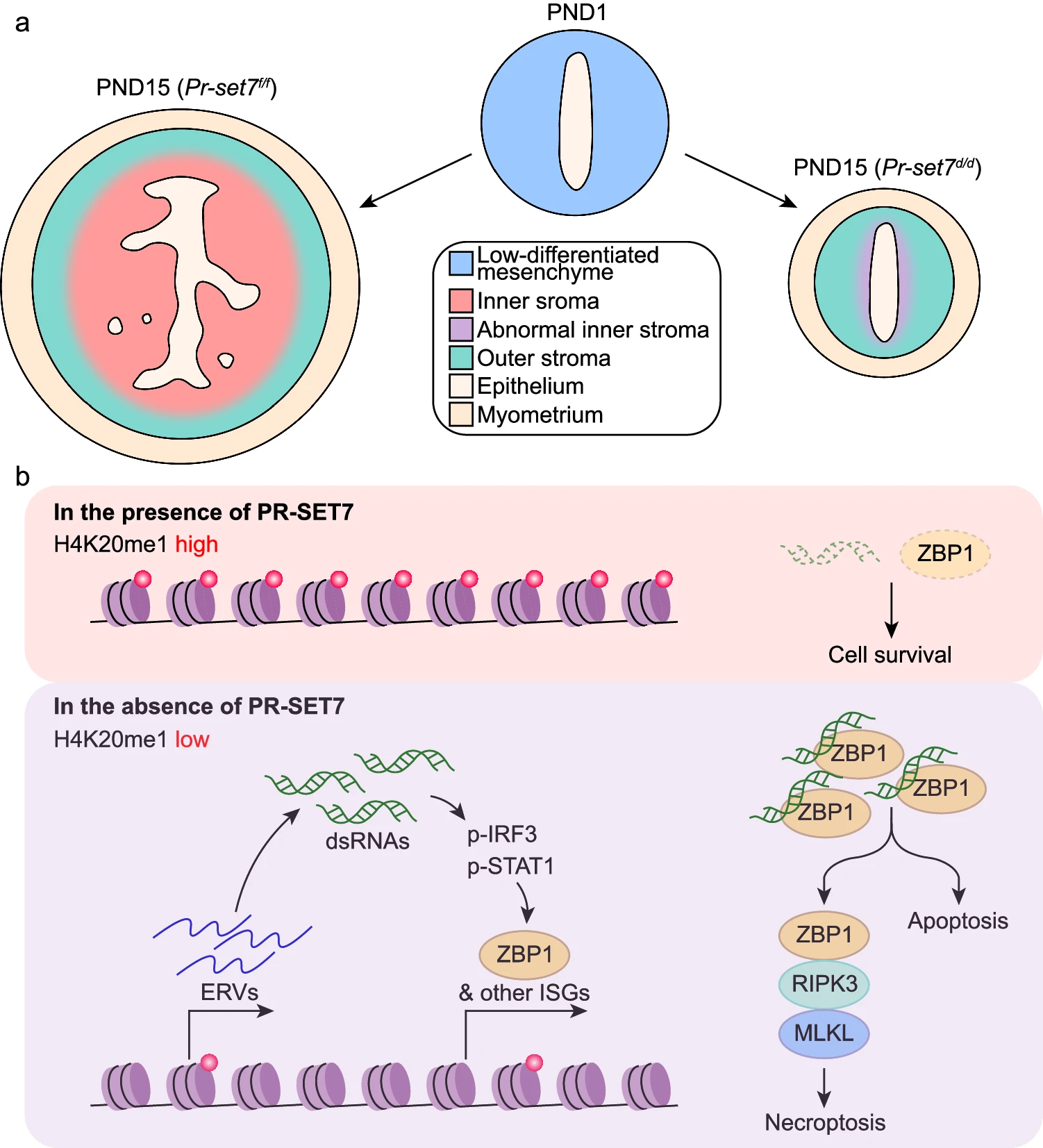
a. 子宫 Pr-set7 删除导致出生后内基质发育受损。
b. PR-SET7 介导的 H4K20me1 通过直接和间接方式表观遗传地限制了过度的干扰素反应,保护基质细胞免受 ZBP1 介导的凋亡和坏死性凋亡。
积累的证据加强了成年子宫内膜基质/蜕膜的异质性。通过 scRNA-seq,Saatcioglu 等人揭示了新生子宫基质的异质性,并假设在出生时(PND2 之前)存在的一群 Misr2+ 细胞代表子宫基质前体细胞,并在 PND6 之前形成两个基质层。由于先前的研究仅在 PND6 进行 scRNA-seq 分析,为了提供全面和动态的出生后子宫基质发育图谱,我们在整个新生期(PND1-15)进行了 scRNA-seq 分析。我们的 scRNA-seq 数据显示,两个基质亚群在 PND1 时已以较低分化状态存在,并在出生后的前两周内进一步分化。因此,我们提出了一种不同的观点,即子宫基质细胞的命运在出生时已经确定,取决于它们沿着腔上皮 - 子宫肌层径向轴的位置代码。先前的研究确定了新生子宫中的两个基质亚群及其分布,但这些两个不同亚群的特征仍不清楚。为填补这一空白,我们描述了基质亚群的发育轨迹、可能指导基质分化的转录因子以及这两个基质亚群的独特特征。
我们观察到内基质和外基质之间 PR 表达的不平等。人类子宫内膜由在每个经周期响应卵巢类固醇激素进行广泛增殖、分化和蜕膜化的功能层以及在周期内相对静止的基底层组成。类似地,在小鼠中,围绕植入胚胎的基质细胞在孕激素的影响下转变为蜕膜细胞,留下紧邻子宫肌层的一薄层未分化基质。因此,内基质中相对较高的 PR 表达水平暗示其对孕激素的反应能力更强,类似于人类的功能层,而外基质更类似于基底层。新生子宫中的内基质和外基质是否确实代表在经周期/妊娠期间因孕激素反应差异而表现出不同途径的功能层和基底层,需要进一步探索。
出生后子宫发育需要上皮和间充质/基质之间的密切交流。组织重组实验清楚地表明,子宫间充质/基质指导和指定上皮增殖和分化,而上皮需要支持基质和子宫肌层的发育。例如,Wnt7a 缺失的小鼠不仅腺体生成失败,还表现出严重的基质缺陷。同时,子宫基质 WNT5A 被证明对腺体的形成至关重要。我们的 scRNA-seq 分析显示,靠近腔上皮的内基质细胞高度表达与腺体形态发生相关的基因。这些腺体生成相关基因的表达水平在 PND10 达到峰值,此时腺体芽经历广泛分支并侵入基质,强调了基质 - 上皮相互作用在子宫腺体发育中的重要性。CellChat 分析进一步揭示了 WNT 和 BMP 信号通路可能介导内基质细胞和腺上皮细胞之间的通信。
尽管先前的研究证明 Pr-set7 缺失导致的子宫腺体生成失败是由于上皮细胞群生长受限,但不能排除功能失调的内基质也对腺体发育受损有贡献,或者从死亡的内基质细胞中释放的某些有害因素阻碍了上皮细胞的存活和维持。另一方面,Pr-set7d/d 子宫中内基质细胞的分化偏离和严重细胞死亡可能部分源于上皮功能受损和异常的上皮细胞丧失。
ERVs 是来源于古代逆转录病毒感染的进化遗迹,在这些感染期间,病毒的遗传物质整合到宿主生殖细胞的基因组中并通过世代传递。尽管长期以来被误认为是没有生物学意义的“垃圾 DNA”,但新兴证据承认其在各种发育事件中,如胚胎发生和胎盘形成,通过作为调控元件(启动子或增强子)和重构转录程序发挥重要作用。然而,ERVs 的异常转录会扰乱基因组稳定性,并与失控的病毒模拟反应甚至细胞死亡有关。因此,ERVs 通过宿主监控机制,包括 DNA 甲基化、组蛋白修饰(如 H3K9me3 和 H4K20me3)和 RNA 修饰(如 m6A),单独或协同紧密调控。除了 H3K9me3 和 H4K20me3,最近的一项研究表明 PR-SET7 介导的 H4K20me1 也参与了滋养层细胞中 ERVs 的转录沉默,我们在本研究中发现了类似的表观遗传调控机制在新生子宫中发挥作用。进一步的研究需要探讨在出生后子宫发育期间,H4K20me1 是单独还是通过与其他表观遗传调控机制的相互作用来介导 ERVs 的抑制。
ZBP1 是一种 ISG,作为双链核酸的细胞质传感器,进一步激活先天免疫系统抵抗病毒感染。先前的研究确认了 ZBP1 在程序性细胞死亡中的关键作用。特别是,ZBP1 通过 RHIM 结构域与 RIPK3 相互作用,导致 RIPK3 的寡聚化和自磷酸化,驱动平行的 CASPASE-8 依赖性凋亡和 MLKL 依赖性坏死性凋亡。此外,ZBP1 还通过激活 NLRP3 诱导焦亡。最近,提出了 PANoptosis 的概念,这是一种涉及凋亡、坏死性凋亡和焦亡之间复杂相互作用的多方面炎性细胞死亡过程,ZBP1 被认为是 PANoptosis 的关键上游执行者。利用从 Zbp1−/−小鼠分离的子宫基质细胞的原代培养和 PR-SET7 抑制剂的给药,我们证明了 PR-SET7 抑制导致大规模凋亡和坏死性凋亡,这些现象在 Zbp1 缺失后大大减弱。然而,ZBP1 的缺失缓解但未消除细胞死亡,表明 PR-SET7 抑制引起的细胞死亡还存在其他机制。
总的来说,我们的研究揭示了 PR-SET7 介导的 H4K20me1 在出生后子宫基质亚群发育调控中的未被充分认识的作用,通过限制过度激活的干扰素信号和防止失控的细胞死亡。
Data Availability¶
本研究中生成的单细胞RNA-seq、整体RNA-seq和CUT&Tag数据已存储在国家生物技术信息中心序列读取档案(NCBI SRA),访问编号为PRJNA1046685。相关的源数据已随本文提供。
Code Availability¶
本研究中使用的代码已存储在以下网址:https://github.com/dwb0211/PRSet7-scRNA。