ScRNA seq of gastric cancer tissues reveals differences in the immune microenvironment of primary tumors and metastases
胃癌(GC)被认为是最致命的癌症之一,其特点是多样性和快速转移,且对原发性和转移性 GC 肿瘤之间的空间变异理解有限。在这个项目中,对 46 个原发性肿瘤组织、邻近非肿瘤组织和转移性 GC 组织进行了转录组分析。结果显示,与原发肿瘤相比,转移性肿瘤组织中的 CD8+ T 细胞显著减少,这种机制归因于先天免疫的差异,尤其是在表示 ApoE 的巨噬细胞之间,转移性和原发肿瘤之间存在显著差异,其丰度与不良预后相关。检查基因表达和相互作用的变化表明了可能的免疫逃逸策略,这阻碍了转移性肿瘤组织中 CD8+ T 细胞的生长。通过描绘有关 GC 生态系统的信息,可以获得更多关于免疫逃逸机制的洞见。
来源:《癌基因》; https://doi.org/10.1038/s41388-024-03012-5
引言¶
胃癌(GC)仍然是医学领域一个重大的未解决问题,全球影响超过一百万人。在中国,这种疾病在男性中排名第三大常见癌症,在女性中排名第五,并且是死亡率第三高的疾病 [1]。亚洲和南美国家每年的新发胃癌病例数量最多 [2]。有相当大的比例(65%)的胃癌患者处于晚期,导致手术结果不理想或癌症扩散,最终导致胃癌的存活率低 [3]。当前研究发现,转移部位的空间免疫微环境存在差异,治疗效果也不同。对胃癌的空间免疫微环境的研究有限,因此确定原发癌和转移癌之间的空间微环境是否存在差异,并调查治疗反应的变化至关重要。
肿瘤免疫微环境(TIM)由一个复杂的群体组成,包括癌细胞、免疫细胞和支持细胞 [4]。恶性细胞、免疫细胞和间充质细胞之间的交流对肿瘤的发展和进展至关重要。过去几年中,免疫检查点抑制剂在多种癌症中显示出治疗优势。尽管多种癌症表现出优势,但在 GC 中的响应率令人失望。免疫检查点抑制剂的有效性受到免疫微环境的重大影响 [5]。因此,理解肿瘤生态系统可能会提供关于免疫逃避机制的见解,这有助于设计更有效的 GC 免疫疗法策略,特别是对于转移性肿瘤的患者。在转移过程中,肿瘤细胞发生了变异,并表现出向特定器官进展的倾向,通过激活特定的基因和通路。同时,原发部位和转移部位的免疫环境也在促进转移的进展中发挥了至关重要的作用 [6]。
探索原发部位与转移部位之间免疫微环境变化的机制对于提高已扩散 GC 的生存率至关重要。通过 scRNA-seq 可以有效地研究肿瘤微环境中细胞成分及其相互作用 [7, 8]。此外,许多研究已经检查了 GC 中免疫细胞的个体细胞全景和肿瘤细胞的多样性 [9]。然而,尚未对转移性胃癌的免疫微环境进行全面检查,尤其是在个体细胞分辨率水平上。
在本研究中,我们检查了总共 46 例来自两个数据集 GSE183904 和 GSE163558 的原发性胃癌、转移性胃癌和邻近非癌性胃组织。在转移性胃癌中,我们注意到 CD8+ T 细胞处于早期阶段且细胞毒性能力有限,而原发性胃癌和正常组织中的 CD8+ T 细胞显示出中等细胞毒性能力。还有在髓系细胞(特别是巨噬细胞)中存在显著差异,这对 T 细胞的发展至关重要。我们识别了一群在转移性胃癌中高表达 ApoE 的巨噬细胞,而在原发性胃癌和正常组织中则表达较少。我们假设巨噬细胞中的 ApoE 表达导致了转移性胃癌的免疫逃逸。我们研究的结果揭示了与 GC 转移相关的免疫反应的独特特征,为针对性免疫疗法的进展提供了宝贵的见解,这些疗法可能对广泛的患者群体有益。
结果¶
通过单细胞 RNA 测序分析原发性和转移性胃癌(GC)的肿瘤环境 为了研究原发肿瘤和胃癌肝转移之间的空间差异,收集了来自 GSE183904 和 GSE163558 数据集的 46 个样本,包括 29 个原发肿瘤(PT)组织、11 个来自邻近区域的非肿瘤(NT)胃组织和 6 个转移性肿瘤(MT)组织(图 1A)。使用 STAR 算法检测了上述组织中的细胞类型和标志基因,随后使用 T-SNE 技术进行随机邻域嵌入,识别并显示了 34 个簇(图 1B)。经过质量控制评估,共识别出 136798 个细胞,平均每个细胞表达 1428 个基因,其中 PT、NT 和 MT 分别贡献了 96963、17769 和 21624 个细胞。所有细胞均表达了如 GAPDH、B2M 和 ACTB 等维持基因,而免疫细胞表达了 PTPRC,从而验证了数据的准确性(图 S1A)。
上皮细胞(EPCAM9、CLDN4、KRT1)、间充质细胞(PECAM1、VWF、CLO1A2)、成纤维细胞(DCN)和增殖细胞(STMN1、PCNA、MKI67)是主要的非免疫细胞(图 1C-E)。由于不同的解离效率,免疫细胞比上皮细胞占比更大,如其他单细胞数据中所观察到的 [10-12]。值得一提的是,两个患者具有不同的细胞亚型和 PT、NT、MT 的不同比例(图 1F 和图 S1B)。这些结果表明,转移组织中的上皮细胞较少,而 T 细胞较多。尽管存在这种变化,PT、NT 和 MT 具有相似的主要细胞亚类和相似的淋巴源和髓源细胞比例。然而,转移通常与不利的预后相关,因此,假设转移状态中 T 细胞的激活功能缺乏。
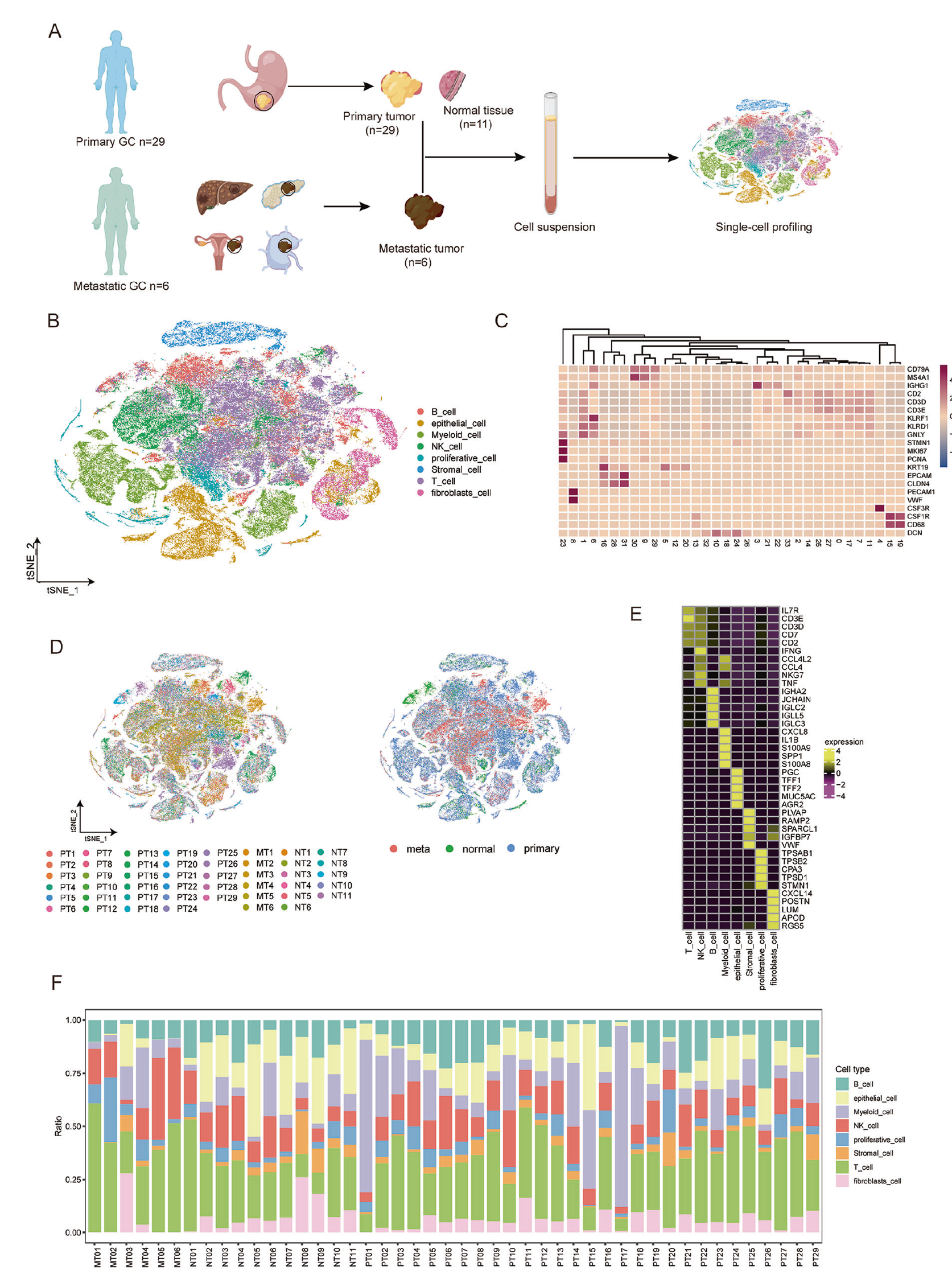
图 1 通过单细胞 RNA 测序描绘原发性和转移性胃癌(GC)的肿瘤生态系统。A 实验策略的示意图。队列显示在(A)中。B 使用 t- 分布随机邻域嵌入(t-SNE)图展示 GC 生态系统中细胞类型的注释和颜色编码。C 在各个 Seurat 簇中展示细胞标记物的表达,用于细胞归类。D t-SNE 图显示细胞起源的颜色,左侧面板显示患者起源,右侧面板显示 PT、NT 或 MT 起源。E 热图显示特定细胞类型中差异表达基因(DEG)的表达。顶部标签指示对应特定细胞类型的簇。F 直方图显示分析中每个样本中细胞的比例。
转移和原发肿瘤组织中 T 细胞的多样性¶
由于 MT 组织中 T 细胞比例较高,进行了无监督的 T 细胞聚类,以确定 MT 和 PT 组织中 T 细胞亚型的差异。共有 45727 个 T 细胞进行了无监督聚类,以揭示不同的亚型,结果识别出 13 个 T 细胞簇,这些亚型在患者中是共有的,并且在转移性、正常和原发样本中观察到(图 2A,B)。共发现了 13 种亚型,每种都具有独特的标志基因,包括七种 CD8+ T 细胞亚型、五种 CD4+ T 细胞亚型和一种独特亚型。CD4+ 亚型包括调节性 T 细胞(Tregs; CTLA4、FOXP3)、耗竭型(CD4+ LAYN、CD4+ MIR155HG)、组织驻留 CD4+ T 细胞(CD4+ CXCR4)和共刺激 T 细胞(CD4+ CD28)。同样,识别出的四种不同的 CD8+ 亚型包括幼稚型(CD8+ CCR7)、细胞性毒型(CD8+ GNLY、CD8+ CD44、CD8+ IL-2)、耗竭型(CD8+ PDCD1)和组织驻留 CD8+ T 细胞(CD8+ CXCR4、CD8+ NR4A1)。对于一种特殊的 T 细胞亚型,自然杀伤 T 细胞(IL32、LAMP2、ITIH2)是主要成分(图 2C)[10, 13-15]。
Tregs 在抑制 T 细胞功能中起着关键作用,并有助于在癌症中对抗 PD1 免疫疗法的抵抗发展 [16, 17]。结果显示,PT 中的 Tregs 略有但不显著增加(图 2D)。尽管如此,T 细胞在原发肿瘤中表现出细胞性毒活动,因此推测 PT 和 MT 中 T 细胞功能的差异并非由 Tregs 引起。此外,PT、邻近 NT 胃组织中免疫细胞的比例没有显著差异,但在 PT 和 MT 样本的组成中观察到显著差异(图 S1C)。此外,MT 样本显示出 CD8+ GNLY 和 CD8+ CCR7 T 细胞的增加(图 2D),表明 CD8+ T 细胞的丰度较高。相反,PT 样本显示出 CD4+ T 细胞的数量较多(图 2F)。考虑到 CD8+ GNLY 表达的 SELL 和 CCR7 幼稚基因较高(细胞性毒基因),可以推断它处于发展的早期阶段,显示出初步的细胞性毒潜力,但缺乏显著的能力。
转移病变主要包含较高比例的 CD8+ GNLY(图 2D、E),表明转移样本中的细胞性毒 T 细胞可能处于发展的早期阶段,无法消除肿瘤细胞。此外,表达 CD8 和 NR4A1 的 T 细胞显示出激活蛋白 1(AP-1;JUN 和 FOSB)的水平升高(图 S1D),NR4A1、CD69 和 CCR4,从而将它们归类为类似组织驻留记忆细胞的 T 细胞。此外,CD8+ T 细胞的比例在各组织中不同,显示出所有组织中的显著肿瘤内异质性(图 S2A、B)。同样,也观察到在诊断为不同恶性肿瘤的个别患者中出现了类似情况 [18]。
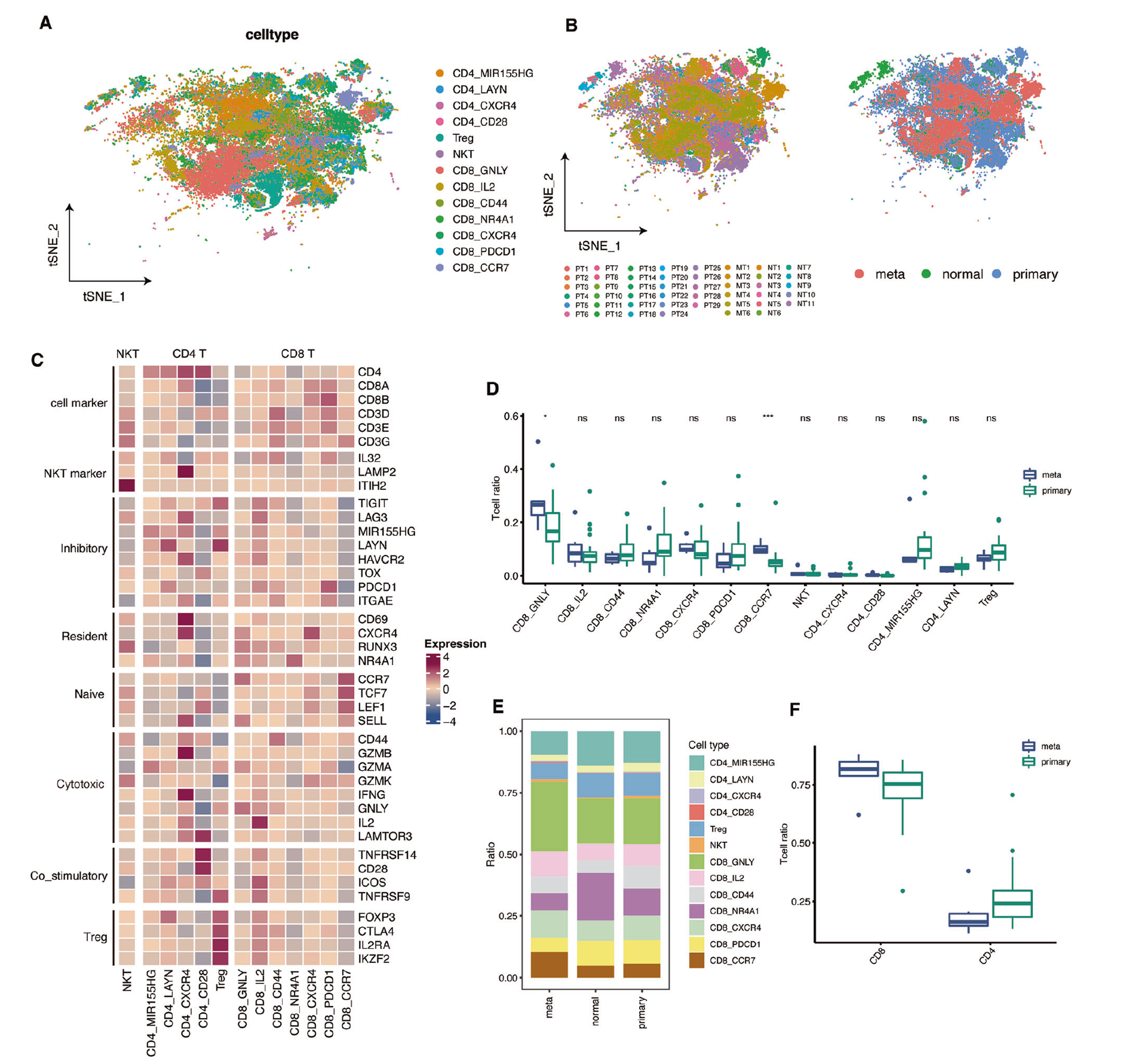
图 2 转移性和原发性肿瘤组织中 T 细胞的异质性。A t-SNE 投影显示 T 细胞亚群,用不同颜色标记。图中提供了细胞类型的注释。B t-SNE 图展示 T 细胞起源的颜色,左侧面板显示患者起源,右侧面板显示 PT、NT 或 MT 起源。C 热图显示 T 细胞亚型中选定基因组的表达,包括幼稚型、驻留型、抑制型、细胞因子型、共刺激型和细胞标记型。D 盒形图描绘 PT(绿色)和 MT(蓝色)中 T 细胞亚型的比例。E 直方图显示 PT、NT 或 MT 中细胞的比例。F 盒形图显示 PT 和 MT 样本中 CD4+ 和 CD8+ T 细胞的比率。
CD8+ T 细胞在原发性和转移性胃癌(GC)中展示出不同的转变轨迹¶
利用 Monocle 分析了渗透的 CD8+ T 细胞的动态免疫状态和细胞转变,通过推断它们状态的轨迹进行研究(图 3A)。为了特定地分析与转移样本中 CD8+ T 细胞相关的转变状态,对转移、正常和原发样本中的 CD8+ T 细胞轨迹进行了单独的分析(图 3B)。这些结果表明,CD8+ T 细胞的成熟阶段在不同的肿瘤组织中有所不同。有趣的是,大多数转移样本中的 CD8+ T 细胞处于其初始阶段,只有少数细胞位于细胞状态转变路径的末端。相比之下,原发和正常样本中的 CD8+ T 细胞在发展过程中均存在,并且在幼稚、耗竭和细胞性毒状态中数量充足。此外,与 CD8+ CD44 和 CD8+ IL-2 细胞相比,CD8+ GNLY 细胞表现出降低的细胞性毒得分,表明这些细胞对应于较少发达的细胞性毒状态(图 3C)。
为了进一步定义与转移样本中 CD8+ T 细胞相关的转变状态,分析了转移、正常和原发组织中 CD8+ T 细胞的路径。结果显示,转移样本中存在早期阶段的 CD8+ T 细胞,而在细胞状态转变路径之后只发现少数。相反,原发样本中的 CD8+ T 细胞主要位于细胞性毒和耗竭状态的终点。在随后的分析中,探讨了与中间阶段相关的基因表达变化,结果显示 CD8+ T 细胞群可以被分类为三个不同的阶段(图 3C)。转移样本中显著为第一阶段的 CD8+ T 细胞所主导,其特点是 CCR6、CCR7、FOXP1、SELL、LEF1、BCL11B 的表达增加,以及 GZMA、GZMB 和 GZMH 的表达减少,这表明转移样本中的 CD8+ T 细胞具有最低的细胞性毒能力。特征基因的富集分析显示,这些细胞主要涉及谷胱甘肽、脂质、丙酮酸、TGF-β和 MAPK 等代谢信号通路(图 3C)。进一步检查能量代谢路径显示,第一阶段细胞在脂肪酸分解、糖酵解和谷氨酰胺代谢方面的表达得分最低,而在三羧酸循环方面的得分相似(图 3D)。代谢分析结果表明,第一阶段细胞的活动依赖于氧化磷酸化,这表明第一阶段的细胞被视为常规幼稚细胞 [19]。检查这些细胞中表达的转录因子(TFs)显示,FOXP1、KLF10、TOX、NFKB1 和 BCL11B 显著增加(图 3E)。
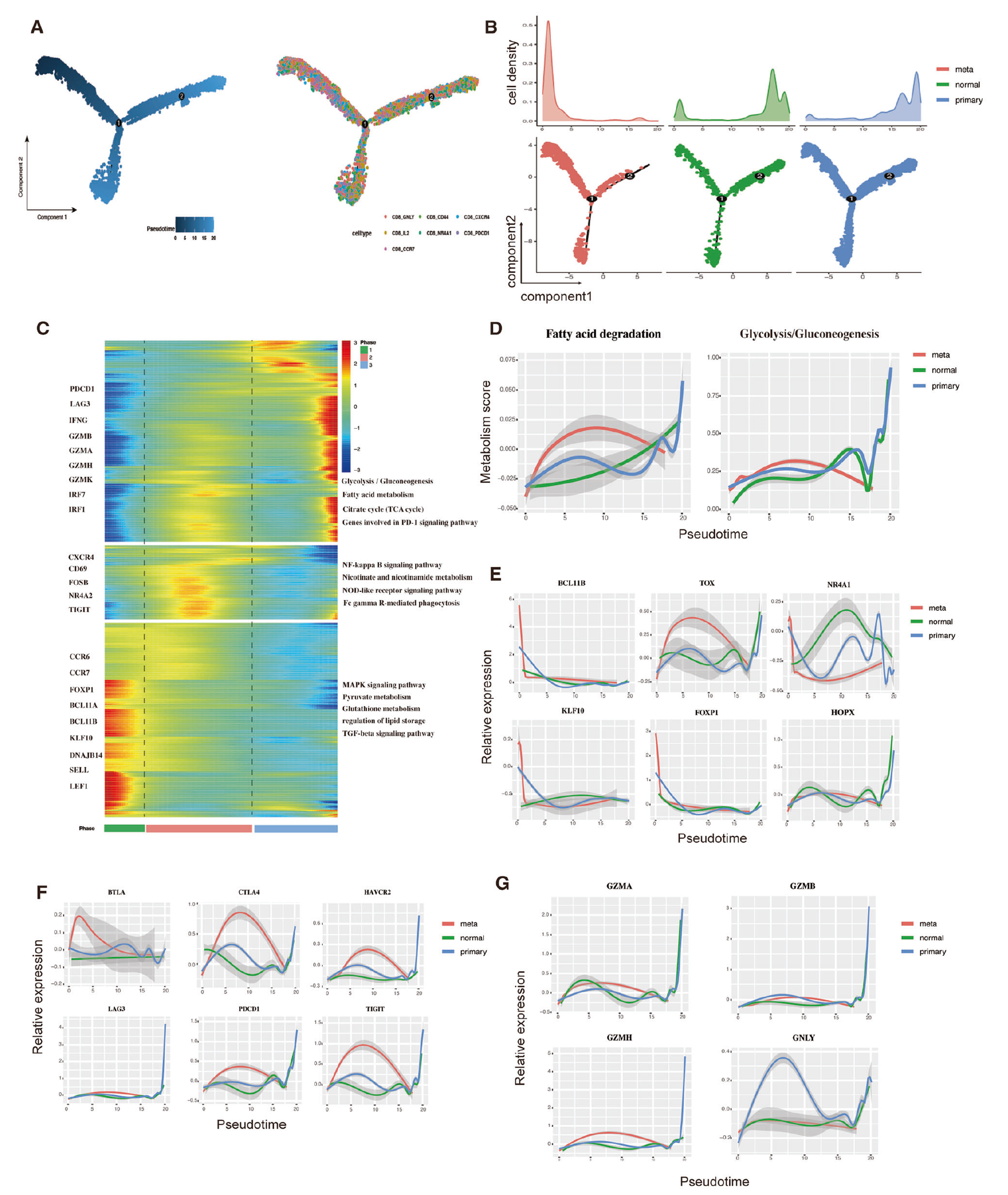
图 3 CD8+ T 细胞在原发性和转移性胃癌(GC)中展示出不同的转变轨迹。A 所有样本中 CD8+ T 细胞的拟时序分析。T 细胞亚型进行颜色编码。B 二维图显示从 MT(左侧面板)、NT(中间面板)和 PT(右侧面板)样本中按拟时序排序的 CD8+ T 细胞。图顶部显示了按状态的细胞密度分布。C 热图显示沿着拟时序的基因表达动态变化。转变期间 CD8 亚型的分布(分为 3 个阶段)。D 二维图显示 PT(蓝色)、NT(绿色)和 RT(红色)样本中与脂肪酸降解和糖酵解相关基因的表达比例以及拟时序。二维图显示沿拟时序 T 细胞转变期间转录因子(E)、检查点基因(F)和细胞性毒基因(G)的动态表达。
FOXP1 在记忆 T 细胞中通过促进 TGF-β信号通路对 c-JUN 的转录抑制发挥独特作用,从而确保它们的存活 [20, 21]。此外,CD8+ T 细胞中的 FOXP1 还抑制细胞增殖和 GZMB 的表达,从而阻碍 CD8+ T 细胞的细胞性毒影响。先前的研究报告显示,小鼠中 KLF10 的缺失增加了细胞性毒 CD8+ T 细胞,表明 KLF10 参与抑制 CD8+ T 细胞激活 [22]。这些细胞中表达的 TFs 的结果显示 FOXP1、KLF10、TOX、NFKB1 和 BCL11B 显著增加(图 3E)。BCL11B 对于 T 细胞特性的发展和维持至关重要 [23]。
第二阶段的细胞表达更高的 CXCR4、CD69、FOSB 和 NR4A1,符合驻留记忆细胞的特征 [24, 25],而第三阶段则表现出经典细胞性毒基因(GZMH, GZMB, GZMA, 和 GNLY)以及标志 T 细胞耗竭的标记物(PDCD1, CTLA4, 和 HAVCR2)的更高表达水平(图 3F, G)。这些结果表明,第三阶段的细胞由细胞性毒和耗竭 T 细胞组成。然而,转移样本中这两种细胞类型的数量相对减少,在免疫微环境中表现出差异。代谢和路径分析进一步揭示,第三阶段的细胞依赖于脂肪酸代谢和三羧酸循环(图 3D),意味着第三阶段的 T 细胞具有细胞性毒 [26]。这些细胞的耗竭状态通过表达高水平的 T 细胞耗竭相关 TFs(如 EOMES、DNAJC2、TOX2、HOPX 和 ARNT)以及与程序性细胞死亡蛋白 1(PD1)和有丝分裂途径相关的基因得到进一步证实(图 S2C)。此外,原发和正常样本中的第三阶段细胞表达了如 GZMA、GMZB 和 CD44 等细胞性毒基因,这些在转移样本中相对较低(图 3G)。转移样本中的 CD8+ T 细胞不表现出细胞性毒,与正常和原发样本相比,脂肪酸代谢和三羧酸循环减少(图 3D, 图 S3A)。
进一步分析显示,免疫检查点分子(例如 CTLA4、TIGIT 和 PDCD1)在从第二阶段过渡到第三阶段时,在正常和原发样本中略有增加,而在转移样本中在第二阶段增加后在第三阶段减少(图 3F)。这些发现表明,不同肿瘤位置的免疫检查点的存在表现出表达的异质性。然而,转移样本始终显示出这一现象的低水平,而经典的细胞性毒基因则没有显示出这一特征。
原发性和转移性 GC 中 CD8+ T 细胞显示不同的转变轨迹¶
进一步分析原发和转移性 CD8+ T 细胞样本之间的功能差异,着重探讨了转移样本中 CD8+ T 细胞的转录状态、组织驻留型、细胞性毒型和共刺激型表现。结果显示,与原发样本中的 CD8+ T 细胞相比,转移样本中的 CD8+ T 细胞显示出如 CD44、GZMB 和 GZMA 等细胞性毒标记的降低,以及包括 RUNX3、NR4A1 和 CD69 在内的组织驻留基因的降低。相反,观察到共刺激分子,包括 TNFRFS14、CD28 和 ICOS 的水平增加(图 4A)。因此,可以推断 CD8+ T 细胞在转移和原发样本中扮演不同的角色,转移样本中的细胞性毒能力减弱。此外,我们的发现表明,原发和转移样本中的 CD8+ T 细胞显示出相似的转变轨迹,但显示出不同的功能和代谢状态,这支持探索多种免疫治疗方法来治疗原发和转移性 GC 的需要 [27]。
差异表达基因(DEGs)分析结果显示,转移样本中的 CD8+ T 细胞中 GZMB、GNLY、GZMA 和 GZMH 是高度下调的基因,表明细胞性毒信号减弱(图 4B)。根据 GSEA 分析,发现转移肿瘤中的 CD8+ T 细胞糖酵解和干扰素(IFN)途径下调,表明它们的活化状态较低,没有细胞性毒(图 4C)。针对独特基因的 KEGG 富集分析显示,免疫系统是前三个基因途径的主要焦点(图 4D),细胞性毒信号通路显著不同。相比之下,GO 分析结果显示,与生物过程(BP)相关的免疫应答基因在转移肿瘤中均被抑制。此外,细胞组分(CC)中的差异基因主要涉及膜功能,而分子功能(MF)与免疫系统有强烈的相关性(图 4E)。
强迫 ApoE 在巨噬细胞中的表达与免疫抑制微环境相关¶
由于巨噬细胞对 T 细胞功能有显著影响,分析聚焦于髓系细胞。目前预测胃癌预后和指导治疗决策的标准是肿瘤 - 淋巴结 - 转移(TNM)分期系统 [28]。 利用 TCGA 数据库的公共数据,最初选择了 TxN0M0 的患者,并与 GC 中的 TxN1M1 进行了比较。随后应用 quanTIseq 算法确定免疫细胞浸润,发现 MT 中巨噬细胞水平升高,表明巨噬细胞可能对 GC 转移有重大影响(图 5A)。此外,使用 TSNE 方法,识别并可视化了九个髓系细胞簇,包括四个巨噬细胞簇、三个树突状细胞簇和两个单核
细胞簇(图 5B),其中高表达 CD163 和 CD68 的为巨噬细胞。鉴于巨噬细胞和树突状细胞均影响 T 细胞激活,对细胞相互作用进行了分析,以识别对 GC 中 T 细胞有显著影响的细胞类型,结果显示巨噬细胞对 T 细胞亚群有强大的影响,受体 - 配体连接更为丰富(图 5D)。此外,检查 MT 和 PT 中髓系细胞的数量表明,在 population macrophages_2 的数量上仅存在统计差异,并且总体巨噬细胞计数有所变化,意味着 macrophages_2 群体对转移肿瘤的免疫微环境有显著影响(图 5E)。通过比较 MT 和 PT 之间的巨噬细胞比例,观察到 macrophage_1 和 macrophage_2 之间存在显著差异;结合这两个结果,特别关注了 macrophage_2(图 5F)。使用 Seurat 中的 FindMarkers 函数找到 macrophage_2 和其他巨噬细胞中的 DEGs,结果显示 ApoE 的 logFC 达到了 5 的值,显示出极其显著的 p 值(图 5G)。ApoE 在 macrophage_2 中的水平降低,在其余三个巨噬细胞亚组中升高,表明 ApoE 在 GC 的先天免疫反应中具有关键功能。
ApoE 与胃癌转移有关,并在胃癌中上调 TGF-β的表达¶
与原发性和正常样本相比,转移样本中巨噬细胞的 ApoE 表达水平显著更高(图 6A,B)。巨噬细胞是一类多功能细胞,其极化谱系从促炎症(M1)到免疫抑制(M2)不等。为了评估 THP1 和健康捐献者单核细胞源巨噬细胞中的 ApoE 表达,它们分别用 PMA、LPS、IL-13 或 ApoE shRNA(sh-ApoE)处理,使其极化成 M0、M1、M2 和 sh-ApoE 型巨噬细胞。有趣的是,ApoE 在 M1 中明显下调,在 M2 中上调,这表明 sh-ApoE 增加了与炎症相关的基因表达,倾向于促进促炎症巨噬细胞的发展(图 6C,D)。此外,测量患者外周血样本中的 ApoE 水平显示,转移患者的病理标本和血浆中的 ApoE 水平比无转移患者更高(图 6E)。我们还测量了胃癌肝、卵巢和腹膜转移(石蜡切片)以及原发肿瘤组织(组织芯片)中的 ApoE 表达,使用免疫组化法。结果显示,肝脏、卵巢、腹膜转移样本中的 ApoE 表达水平高于原发肿瘤(图 6F,G)。
同时,我们进行了免疫荧光染色,观察到与转移样本相比,胃癌原发样本中表达 ApoE 的巨噬细胞较少(图 6H)。此外,对各种细胞类型上脂蛋白受体表达的单细胞数据分析显示,脂蛋白受体主要集中在上皮细胞和间充质细胞上(图 6I)。具有低 ApoE 表达的巨噬细胞控制的 T 细胞与常规巨噬细胞之间的差异主要集中在 TGF-β途径上,如 Cellchat 所示(图 6J,K),之前的报道也有所提及 [28]。
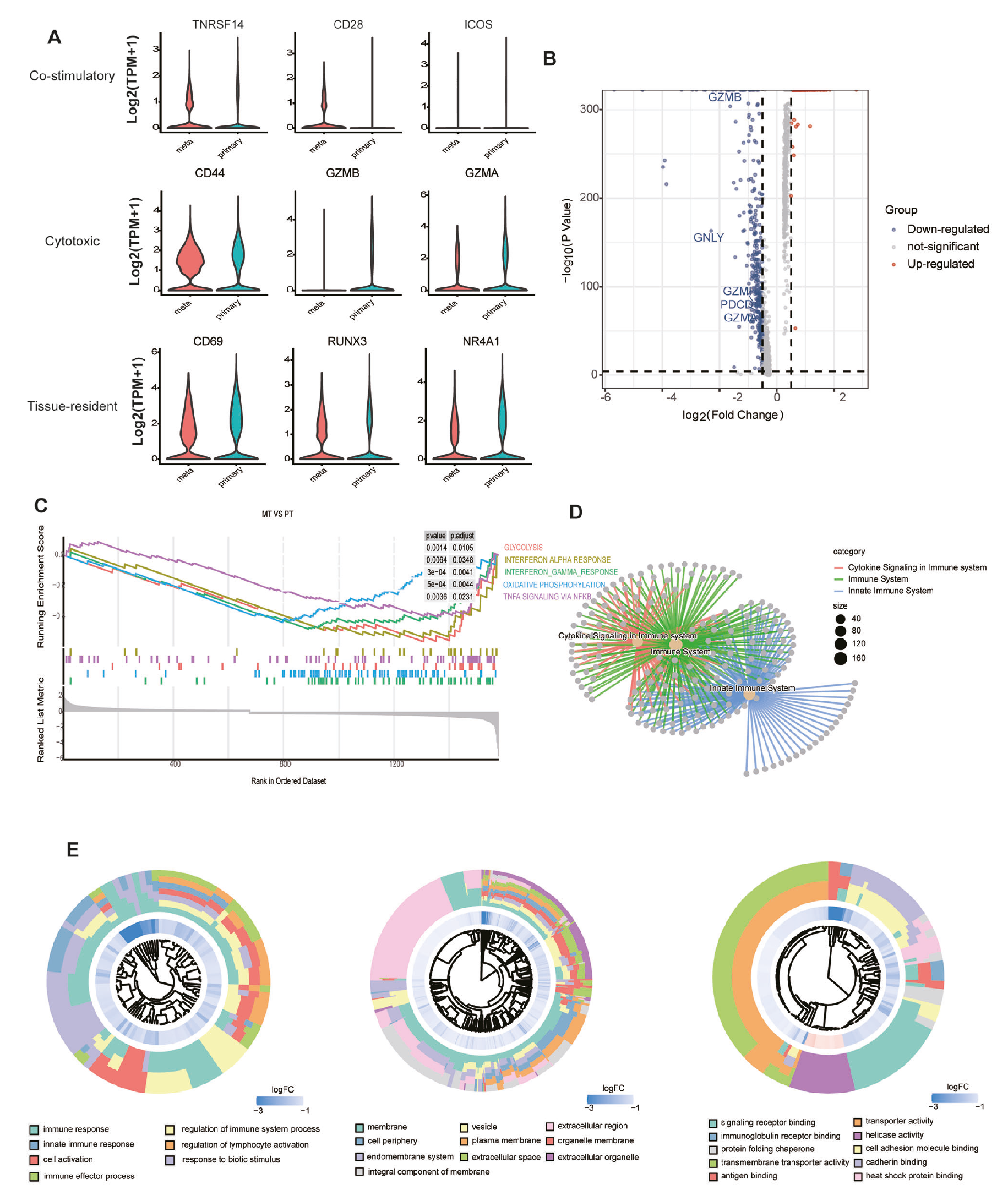
图 4 原发和转移样本中 CD8+ T 细胞的功能差异。A 小提琴图显示 PT(绿色)和 RT(蓝色)样本中 CD8+ T 细胞的组织驻留、耗竭和共刺激基因表达。B 火山图显示 MT(蓝点)和 PT(红点)CD8+ T 细胞之间差异表达的基因。图中标出了最显著基因的名称。C GSEA 算法揭示 MT 和 PT 样本中 T 细胞途径的差异。D, E KEGG 和 GO 分析用于富集 MT 和 PT 之间差异基因的途径和功能。
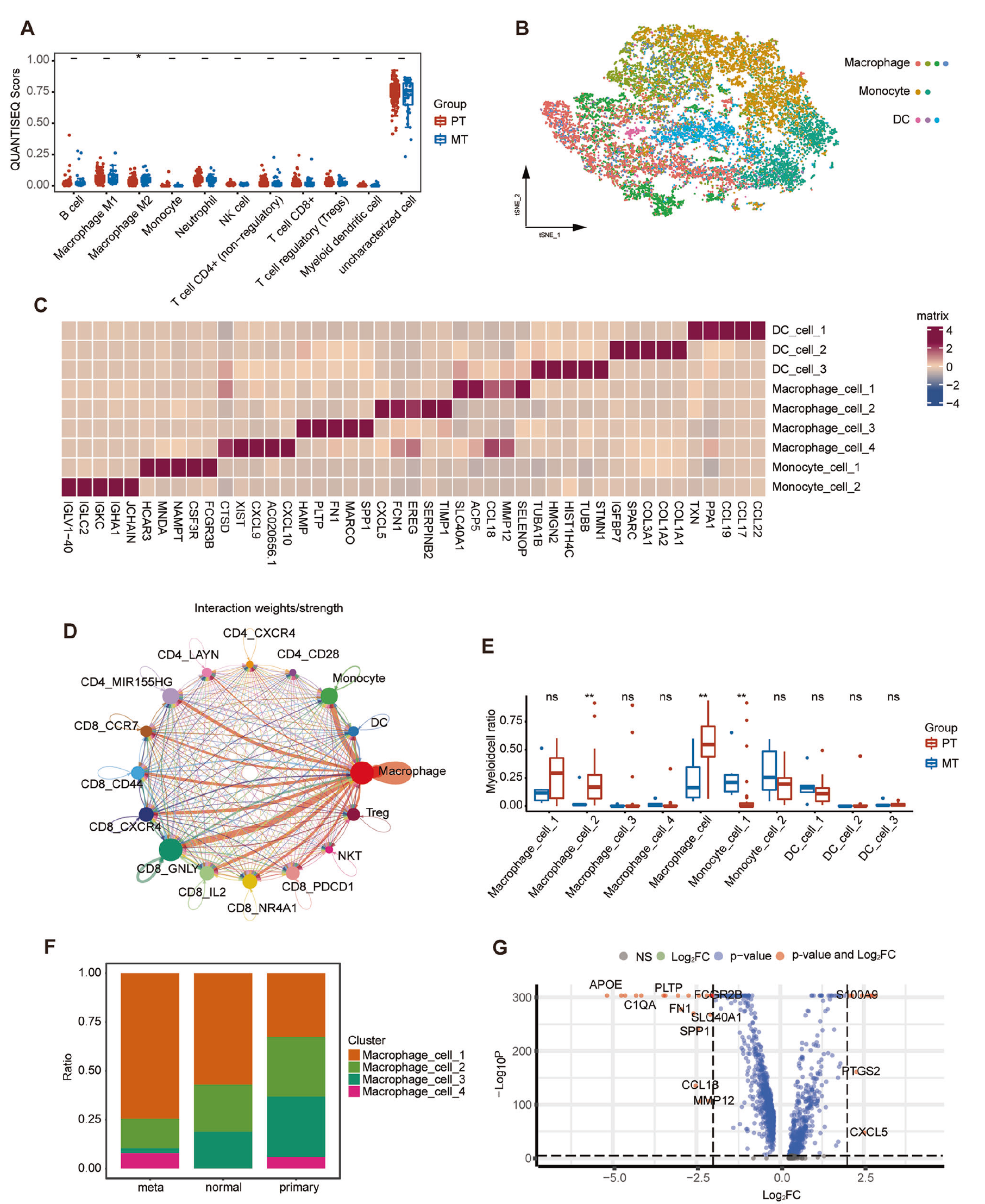
图 5 强迫巨噬细胞表达 ApoE 与免疫抑制微环境相关。A 使用 TCGA 公共数据,通过 quanTIseq 算法推算 MT 和 PT 间免疫细胞的差异。B t-SNE 投影显示不同颜色标记的髓系细胞亚群。C 热图显示特定细胞类型中差异表达基因(DEG)的表达。右侧标签指示对应特定细胞类型的簇。D 通过‘cellchatDB’软件包推断树突状细胞和巨噬细胞与 T 细胞间交流的强度。E 盒形图显示 PT(红色)和 MT(蓝色)中髓系细胞的比例。F 直方图显示 PT、NT 或 MT 中巨噬细胞的比例。G 火山图显示 Macrophage_2 与其他巨噬细胞之间差异表达的基因。图中标出了最显著基因的名称。
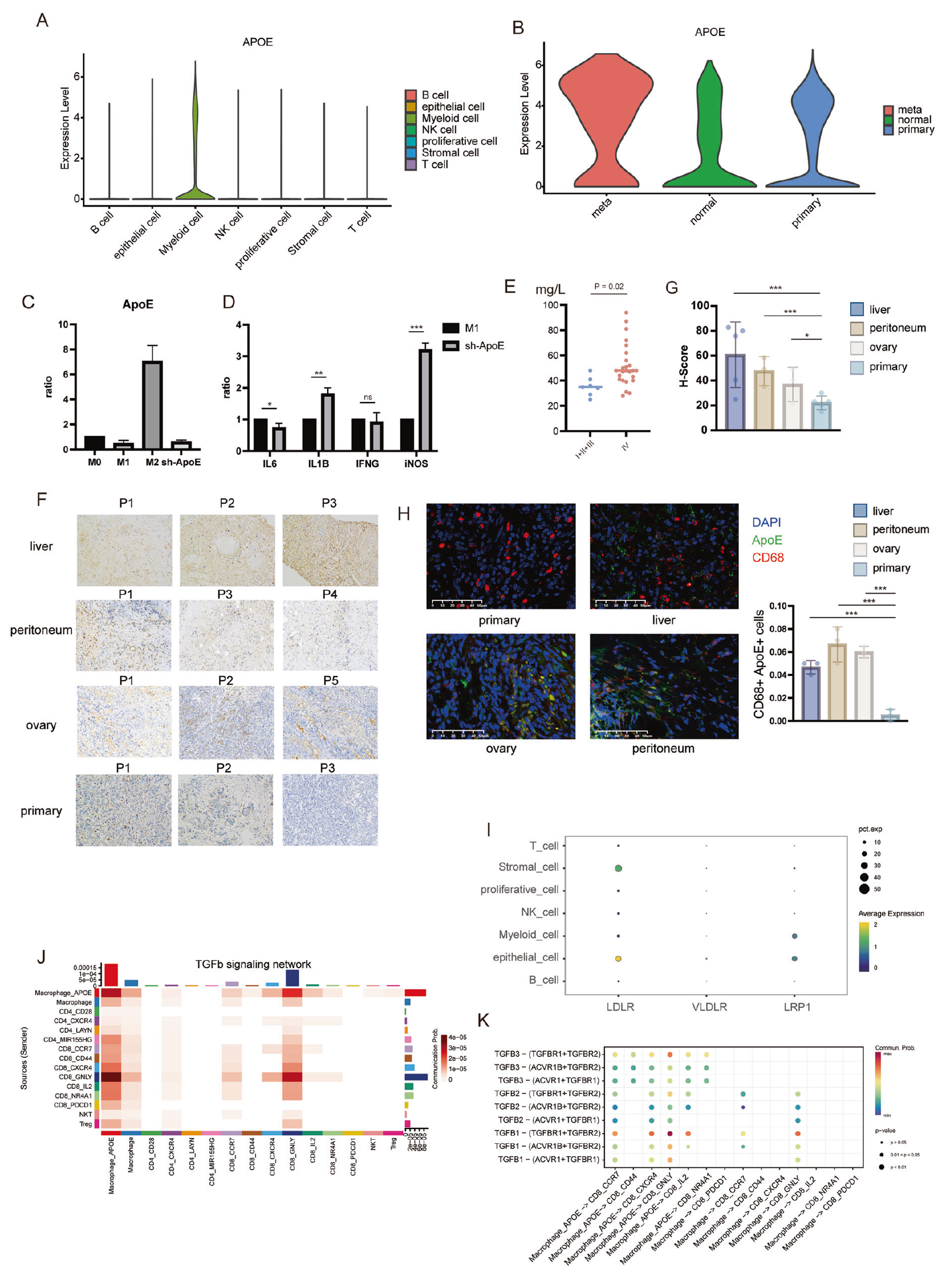
图 6 ApoE 与胃癌转移有关,并在胃癌中上调 TGF-β的表达。A 所有细胞类型中 ApoE 表达的归一化小提琴图。B MT、NT 和 PT 中 ApoE 表达的归一化小提琴图。C M0、M1、M2 与 sh-ApoE 中 ApoE 的表达。D 比较 sh-ApoE 和 M1 的关键细胞标记。E 不同阶段(I, II, III 与 IV)患者血样中 ApoE 的表达。F、G 原发性胃癌及胃癌肝脏、卵巢、腹膜转移中的 ApoE 水平。图像上方的数字代表样本来源,相同数字的样本来自同一患者。H 使用来自原发性胃癌、肝转移、卵巢转移和腹膜转移的样本进行免疫荧光染色。DAPI 以蓝色表示,APOE 以绿色表示,CD68 以红色表示。计算视野中双染色细胞的百分比相对于总细胞数,然后使用 t 检验进行统计分析。I 点图显示人类胃癌中 LDLR、VLDLR、LRP1 的表达。颜色表示平均表达量,点的大小表示表达频率。J、K TGF-β途径在两种类型的巨噬细胞与 T 细胞间细胞交流中的作用。
这些研究结果表明,巨噬细胞中较高的 ApoE 表达促进了转移中的抑制性免疫微环境;因此,假设由巨噬细胞释放的 ApoE 促进胃癌细胞释放 TGF-β,从而抑制 T 细胞功能。随后,在 HGC27 细胞系中补充 ApoE 重组蛋白,以评估其对胃癌细胞生长和移动性的影响。结果表明,与 NC 组相比,ApoE 对 HGC27 细胞的增殖和迁移能力没有直接影响(图 7A、B)。将 Jurkat 细胞和健康捐献者 T 细胞与/不含重组 ApoE 蛋白的 HGC27 细胞共培养,结果显示 ApoE 组的 Jurkat 细胞 GZMB 和 PRF 表达较低,而 CCR7 和 SELL 没有差异(图 7C)。然而,去除 HGC27 细胞后,两组间的差异消失(图 S3C)。
通过 RNA 测序研究 ApoE 组和 NC 组之间的不同基因,结果表明两组之间 TGF-β表达存在显著差异(图 7D)。建立了一种共培养系统,使用单核细胞、从健康人血液中分离的 T 细胞和 HGC27 细胞(图 7E)[29-31]。WB 结果显示 ApoE 组 HGC27 细胞的 TGF-β水平较高(图 7G)。与敲除 ApoE 的健康捐献者单核细胞及 HGC27 细胞和 Jurkat/健康捐献者 T 细胞共培养的结果显示,添加 ApoE 导致 T 细胞中 GZMB 和 PRF 的表达降低,以及 Jurkat 中的 GZMB 表达降低,通过添加 ITD-1 逆转(图 7H),这一点通过流式细胞仪进一步验证(图 7I、J),显示出显著的细胞性毒作用。然后通过将 GC PDO 与健康捐献者 T 细胞共培养,结果与之前的发现一致,表明添加 ApoE 重组蛋白的组细胞凋亡最少,活细胞最多(图 7K)。
ApoE 在体内抑制 T 细胞功能¶
为了进一步探索 ApoE 对体内 T 细胞功能的影响,我们使用了 B615 小鼠建立动物模型,特别是使用了 4 周龄的雌性小鼠。通过皮下注射 10^6 个 MFC 细胞来建立胃癌皮下肿瘤模型(图 8A)。小鼠被分为四组:IgG 组、ApoE 组、抗 PD1 组和 ApoE+ 抗 PD1 组。在第 7 天,当肿瘤体积达到约 100mm^3 时,根据初步实验结果开始干预。通过腹腔注射抗 PD1 或 IgG(4 mg/kg),而 ApoE(4 mg/kg)重组蛋白通过肿瘤内注射。抗 PD1 和 IgG 注射每 7 天进行一次,ApoE 注射每 7 天进行三次。到第 21 天,肿瘤体积达到 1800mm^3。随后,使用颈椎脱臼法对小鼠进行安乐死,解剖后取出并称重肿瘤。我们观察到,单独接受 ApoE 重组蛋白的小鼠比 IgG 组的肿瘤生长速度更快。此外,发现 ApoE 抑制了 PD1 抑制剂的抗肿瘤效果(图 8B、C)。这一现象进一步通过肿瘤重量测量得到证实(图 8D)。
随后,我们对小鼠肿瘤中的免疫细胞进行了流式细胞仪分析。我们的发现显示,仅用 ApoE 重组蛋白处理的小鼠显示出最低程度的 CD8+ T 细胞浸润(图 8E)。此外,表征 CD8+ T 细胞细胞性毒性的分子,如 GZMB 和 PRF 的表达水平降低。这表明 ApoE 可以减弱 T 细胞的功能。此外,与仅接受抗 PD1 治疗的组相比,ApoE+ 抗 PD1 组显示出 CD8+ T 细胞数量减少,以及 GZMB 和 PRF 的表达降低,表明 ApoE 可能影响 PD1 抑制剂的抗肿瘤效果(图 8F)。我们还比较了 ApoE+ 抗 PD1 联合组和单独 ApoE 组以及抗 PD1 组和 IgG 同种型对照组之间的肿瘤抑制率。我们发现,与对照相比,ApoE 减弱了抗 PD1 对肿瘤的抑制作用(图 S3D)。
皮下肿瘤被切成 1-2mm 的碎片并移植到 B615 小鼠的胃大弯处,建立原位肿瘤模型。此外,通过腹腔和脾静脉注射 MFC 细胞(2 × 10^5)在 B615 小鼠中创建了腹膜和肝脏转移模型(图 8G)。15 天后,小鼠被安乐死,肝组织和腹膜结节进行了磁珠分选以分离髓系细胞。我们观察到,转移病变中表达 ApoE 的巨噬细胞比原发肿瘤中的浸润程度更高(图 8H)。
所有这些结果表明,肿瘤细胞接收由巨噬细胞释放的 ApoE,这反过来促使其释放 TGF-β并抑制 T 细胞功能(图 9)。
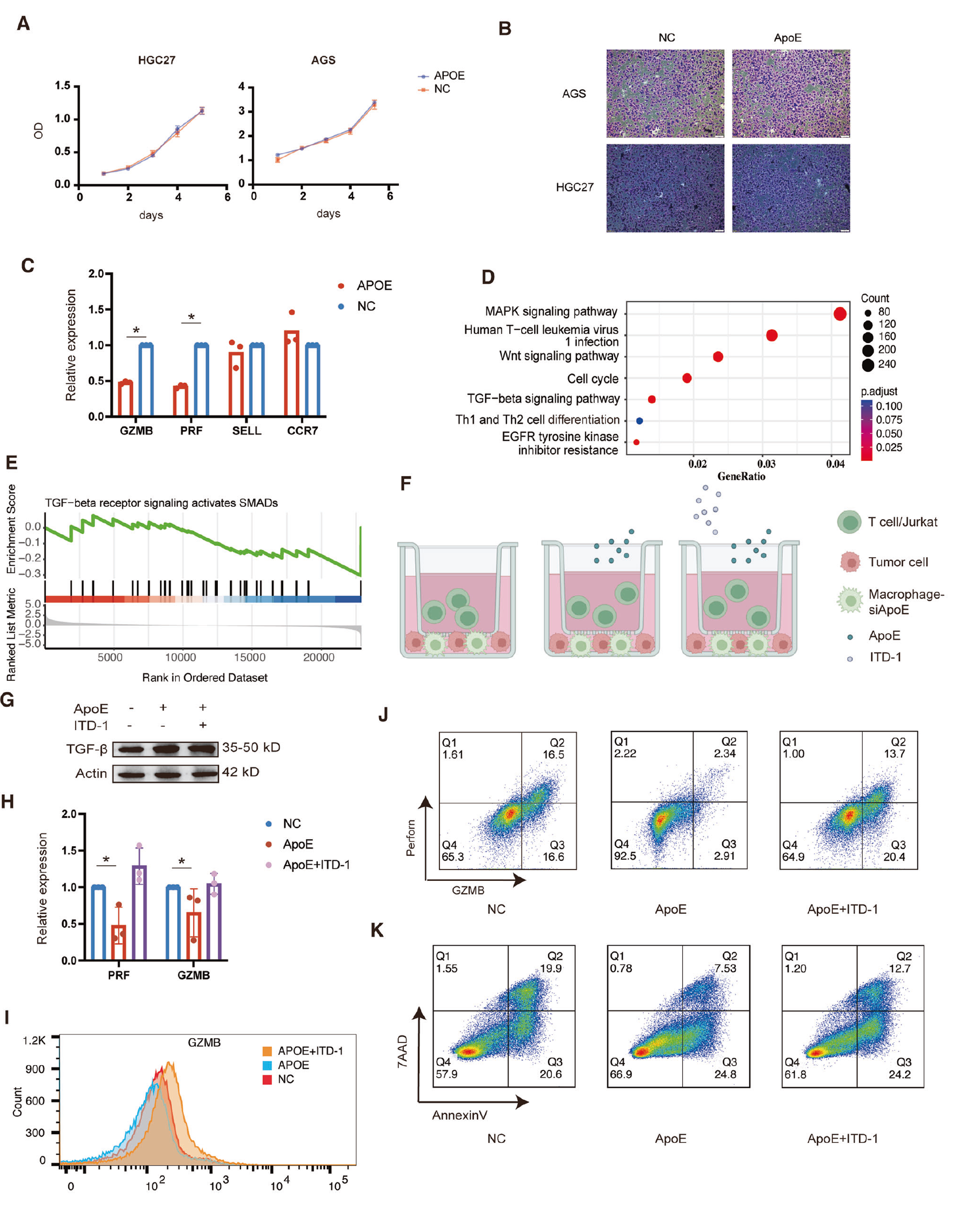
图 7 PDO 模型验证了 ApoE 对 T 细胞功能的抑制作用。A 通过添加 ApoE 与对照组相比,HGC27 和 AGS 细胞系的增殖情况。B 添加 ApoE 与对照组相比,HGC27 和 AGS 细胞系的侵袭能力。C 在实时定量 PCR 分析中,与 NC 组相比,ApoE 组的 HGC27 中 GZMB、PRF、CCR7、SELL mRNA 水平。显著性通过单向方差分析和 Tukey's 检验进行多重校正。D 体外 HGC27 细胞(n = 3)处理 0.3 μg/mL 重组人 ApoE(n = 3)48 小时后的差异性途径。E 两组细胞中 TGF-B 途径的差异表达。F 共培养模型,肿瘤细胞和巨噬细胞 -siApoE 位于下层,T 细胞位于上层,然后添加 APOE/ITD-1。G ApoE 组、ApoE+ ITD-1 组和 NC 组中的 TGF-B 蛋白。H 在实时定量 PCR 分析中,与 NC 组的 HGC27 相比,ApoE 组和 ApoE+ITD-1 组的 GZMB、PRF mRNA 水平。显著性通过单向方差分析和 Tukey's 检验进行多重校正。I 通过流式细胞仪检测 ApoE、ApoE + ITD-1 和 NC 组 Jurkat 细胞中的 GZMB 蛋白表达。J 通过流式细胞仪检测 ApoE、ApoE + ITD-1 和 NC 组健康捐献者 T 细胞中的 GZMB 和 PRF 表达。K 通过流式细胞仪检测 ApoE、ApoE+ITD-1 和 NC 组 PDO 凋亡情况。