Single cell sequencing depicts tumor architecture and empowers clinical decision in metastatic conjunctival melanoma
摘要¶
结膜黑色素瘤(CoM)是一种可能导致远处转移的毁灭性肿瘤。尽管对远处转移性结膜黑色素瘤采用了各种治疗策略,但临床结果仍然不理想。在本研究中,我们对来自正常结膜样本(n=3)和结膜黑色素瘤样本(n=7)的 47,017 个细胞进行了单细胞 RNA 测序(scRNA-seq)。值得注意的是,我们在肿瘤微环境(TME)中发现了更多的癌症相关成纤维细胞(CAFs),这与远处转移性结膜黑色素瘤中增强的血管生成能力和增加的 VEGFR 表达相关。此外,我们观察到总 CD8+ T 细胞比例显著减少,而初始 CD8+ T 细胞比例增加,这导致远处转移性结膜黑色素瘤中的免疫环境相对平静。这些发现通过对 7 个单独 CoM 样本的 70,303 个单细胞转录组分析以及额外 10 个 CoM 样本的空间分辨蛋白质组分析得到了证实。由于远处转移性结膜黑色素瘤中 VEGFR 介导的血管生成增加和 T 细胞环境的活跃度降低,已经启动了一项临床试验(ChiCTR2100045061),评估 VEGFR 阻断与抗 PD1 治疗联合使用对远处转移性结膜黑色素瘤患者的疗效,显示出有希望的抑瘤效果。总之,我们的研究揭示了结膜黑色素瘤肿瘤发生和进展过程中肿瘤微环境的景观和异质性,为远处转移性结膜黑色素瘤的管理提供了临床决策依据。据我们所知,这是首次将 scRNA-seq 分析转化为处理癌症的临床试验,提供了一种通过将 scRNA-seq 数据应用于癌症治疗的新概念。
引言
结膜黑色素瘤(CoM)是一种威胁视力和生命的恶性肿瘤,起源于球结膜、睑结膜和泪阜。由于其难以区分的起源、对肿瘤微环境(TME)缺乏了解以及即使在标准治疗后也有较高的转移死亡率,CoM 显得尤为隐晦。远处转移威胁着 CoM 患者的预后,系统性转移后的患者生存时间明显短于局部 CoM 患者。与西方国家的 CoM 患者相比,中国患者表现出更具侵袭性的临床行为和更差的预后。在中国,5 年和 10 年肿瘤相关的死亡率分别为 30.5% 和 37.4%,而在荷兰分别为 13.7% 和 28%。因此,有必要揭示组织结构,区分肿瘤起源,并分析 TME 的异质性,以制定治疗策略,特别是针对中国的 CoM 患者。
在大多数情况下,CoM 起源于具有非典型性的原发获得性黑色素病(PAM),约占 53%–75% 的病例。其他 CoM 则起源于结膜痣或在没有任何前期病变的情况下新发。值得注意的是,越来越多的证据表明结膜黑色素瘤和皮肤黑色素瘤之间存在共同的遗传联系(例如,BRAF、NRAS、NF1、KIT),同时也将其与脉络膜黑色素瘤区分开来(例如,GNAQ/11、BAP1、SF3B1)。CoM 起源于结膜上皮基底层的黑色素细胞。它们表现为来自覆盖结膜上皮的非典型黑色素细胞侵入基底膜进入下皮结缔组织(实质)。内因(遗传、预先存在的病变和黑色素)和外因(紫外线辐射)均有助于 CoM 的发展。然而,目前尚未建立对 CoM 的单细胞分辨率的系统剖析。进一步的分子特征研究对于深入了解 CoM 的生物学行为是必要的。
在本研究中,我们首先通过单细胞 RNA 测序(scRNA-seq)在 CoM 不同肿瘤阶段对综合细胞景观进行了表征。显著的是,我们观察到 TME 中癌症相关成纤维细胞(CAFs)的增加,这与远处转移性 CoM 中血管生成潜力增强和血管内皮生长因子受体(VEGFR)表达增加有关。此外,我们观察到 CD8+ T 细胞比例显著减少,而 CD8+ 初始 T 细胞比例增加,从而导致远处转移性 CoM 中的免疫环境相对不活跃。这些结果通过对 7 个独立样本的 70,303 个单细胞 RNA 转录组的分析以及额外 10 个 CoM 样本的空间分辨蛋白质组分析得到了验证。基于这些发现,我们启动了一项使用 VEGFR 阻断联合抗 PD1 治疗远处转移性 CoM 患者的临床试验,取得了高效的治疗效果。总之,我们的研究首次报告了 CoM 的组织结构和独特的 TME,并通过整合 scRNA-seq 数据为癌症治疗决策提供了新概念。
结果¶
良性结膜和 CoM 微环境的单细胞分析¶
为了系统性地探讨 CoM 的起源和肿瘤景观,我们收集了结膜样本(n=3)和结膜黑色素瘤样本(n=7),并对其进行了 scRNA-seq 分析。未在随访至少 12 个月内显示已知转移的 CoM 患者的原发肿瘤组织被归类为稳定肿瘤组(ST 组,n=3),而在随访期间发生远处转移的患者的原发肿瘤组织被归类为远处转移肿瘤组(DMT 组,n=4)。详细的临床和病理信息,包括起源、临床和病理特征、驱动突变和预后,见补充表 S1。我们通过纳入额外的结膜黑色素瘤样本(n=7)进行 scRNA-seq 验证(验证队列 1)扩展了我们的研究。此外,更多患者被纳入验证队列 2,用于通过免疫荧光(IF)染色分析靶蛋白的表达水平。该 IF 队列包括 13 个良性结膜病变、18 个原发性 CoM 病变(包括 10 个稳定性 CoM 和 8 个远处转移性 CoM)以及 2 个远处转移性病变(1 个皮下转移样本和 1 个肺转移样本)。此外,我们还包括了 10 个额外的 CoM 样本进行空间蛋白质组分析(验证队列 3),以验证发现的分子异常(图 1a)。验证队列中 CoM 患者的所有临床信息总结在补充表 S2 中。
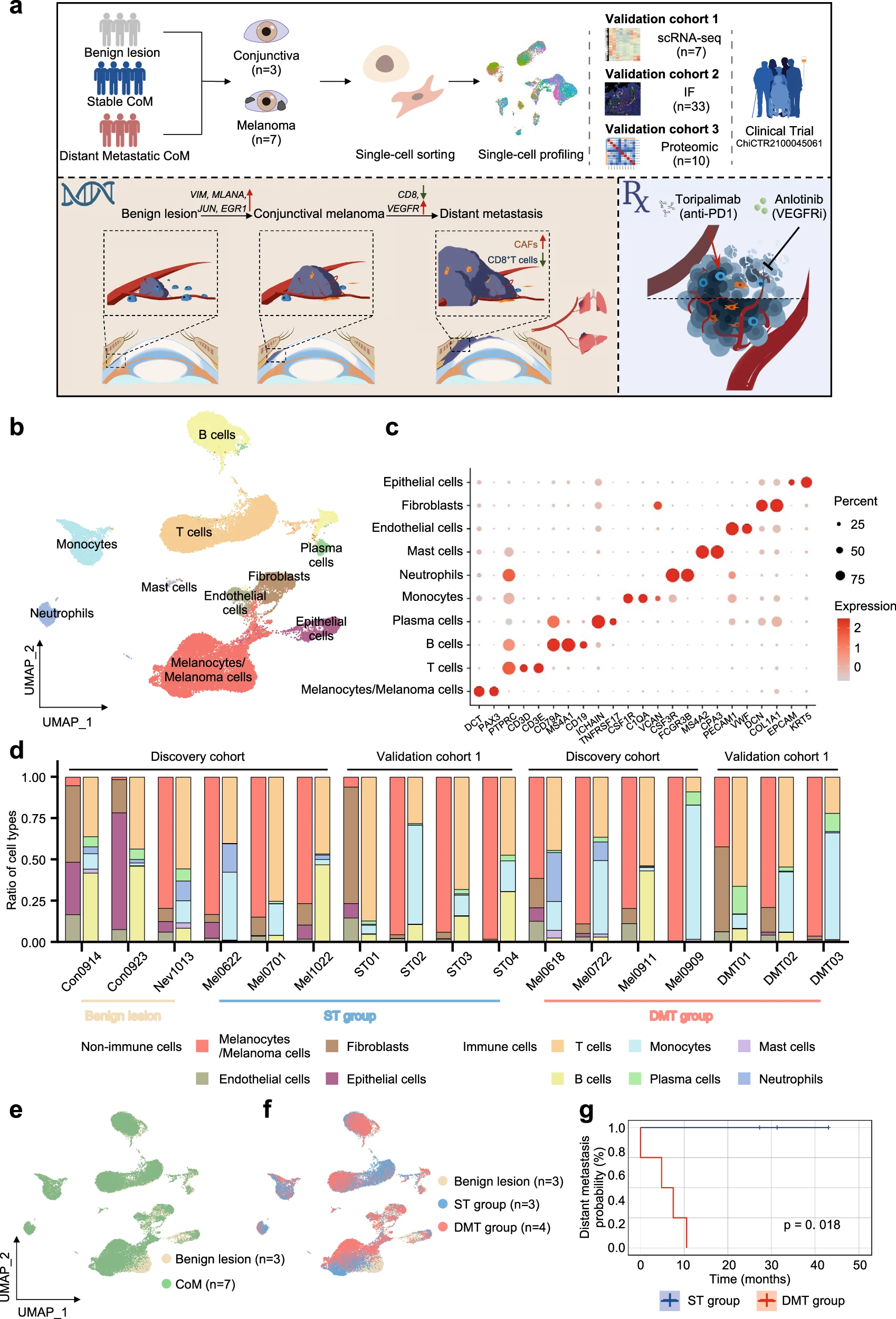
a 实验策略示意图,表明收集和处理来自 CoM 患者和非恶性结膜的样本。
b UMAP 图,展示了 CoM 和非恶性结膜组织中不同细胞类型的注释。
c 点图,显示了不同细胞类型中特定细胞标记基因的表达水平。点的大小表示表达标记基因的细胞比例。颜色光谱表示标记基因的平均表达水平。
d 条形图,显示了 3 个非恶性样本(2 个结膜样本和 1 个结膜痣样本)和 14 个原发性 CoM 样本(发现队列:n=7,验证队列 1:n=7)中注释的细胞类型比例。底部展示了注释的细胞类型和颜色。
e, f UMAP 图,按颜色显示细胞起源:良性或黑色素瘤起源(e),良性病变为白色,黑色素瘤为绿色;ST 或 DMT 起源(f),ST 组为蓝色,DMT 组为红色。
g 根据远处转移的 CoM 患者在 scRNA-seq 队列中登记的 ST(蓝色)和 DMT(红色)组的无进展生存期。
从 10 个样本中共获得了 47,017 个单细胞,并进行了单细胞 RNA 测序(scRNA-seq)(补充图 S1a)。其中,14,939 个细胞(31.8%)来自良性结膜组织,另外 32,078 个细胞(68.2%)来自肿瘤相关组织(补充图 S1b, c 和表 S3)。采用降维分析显示了黑色素细胞/黑色素瘤细胞、间质细胞和其他非恶性细胞类型的异质性,其中细胞根据已建立的基因标记进行了聚类和定义(图 1b)。具体来说,TME 和非恶性组织中注释的细胞类型包括黑色素细胞/黑色素瘤细胞(由 DCT 和 PAX3 标记)、T 细胞(由 PTPRC、CD3D 和 CD3E 标记)、B 细胞(CD79A、MS4A1 和 CD19)、浆细胞(ICHAIN 和 TNFRSF17)、单核细胞(CSF1R、C1QA 和 VCAN)、中性粒细胞(CSF3R 和 FCGR3B)、肥大细胞(MS4A2 和 CPA3)、内皮细胞(PECAM1 和 VWF)、成纤维细胞(DCN 和 COL1A1)和上皮细胞(EPCAM 和 KRT5)(图 1c),这些标准来源于已有的 scRNA-seq 研究。
值得注意的是,我们注意到在降维分析后,黑色素瘤细胞和结膜黑色素细胞之间表现出相似的表达模式。在此,我们应用了两种互补的方法来区分黑色素瘤细胞和非恶性黑色素细胞。首先,我们根据染色体间隔的平均表达谱推断每个单细胞的染色体拷贝数变异(CNVs)。这些推断的 CNVs 根据正常核型将恶性细胞与良性黑色素细胞分开(补充图 S2a)。此外,我们根据一组黑色素瘤相关标记基因(S100A1、PRAME、TYRP1、SOX10、MLANA 和 VIM)的表达识别恶性 CoM 细胞。最终,通过 CNV 和黑色素瘤标记基因表达分析,可以确认恶性黑色素瘤细胞与非恶性黑色素细胞的特征(补充图 S2b)。此外,我们比较了定义明确的黑色素细胞和黑色素瘤细胞之间的差异表达基因,进一步强调了 CoM 进展过程中黑色素瘤细胞与良性黑色素细胞之间不同的转录模式(补充图 S2c)。
根据个体细胞子集类型以及根据远处转移概率定义的临床子集类型,分析了每个样本中的细胞类型比例。良性病变、ST CoM 病变和 DMT CoM 病变的细胞比例明显不同,而细胞子集类型相同,包括黑色素细胞/黑色素瘤细胞、上皮细胞、内皮细胞、成纤维细胞、T 细胞、B 细胞、浆细胞、中性粒细胞、肥大细胞和单核细胞(图 1d)。由于其起源,痣的细胞类型组成与 CoM 样本相似。统一流形逼近和投影(UMAP)分析可视化了良性病变和 CoM 病变的分布,这些病变根据患者随访情况进一步分为 ST 组和 DMT 组(图 1e–g;补充图 S1b, c)。在验证队列 1 中,从 7 个不同样本中共获得 70,303 个单细胞并进行了 scRNA-seq,揭示了肿瘤异质性的存在(补充图 S3)。总体而言,我们观察到 ST 组和 DMT 组中个体肿瘤在组成上的显著异质性。
转录轨迹分析确定了 CoM 肿瘤发生和进展过程中若干致癌信号通路的激活¶
值得一提的是,皮肤黑色素瘤(SKCM)和脉络膜黑色素瘤的转录状态已通过单细胞测序阐明。然而,CoM 的景观异质性和转录轨迹仍然不确定。为了全面解决起源问题并阐明 CoM 肿瘤发生和进展中的转录状态,我们对 3041 个非恶性黑色素细胞和 11,964 个黑色素瘤细胞进行了转录轨迹分析。推断的状态转变轨迹显示了两条不同的谱系,从初始状态到最终状态呈现分叉配置。这些谱系可根据其转录状态进一步分为三个不同的簇(图 2a)。这两条谱系均源自共同的祖先状态,并在中间状态后分化出一条谱系向黑色素瘤细胞进展,另一条谱系向黑色素细胞分化(图 2b, c)。黑色素细胞主要呈现在一个终端状态(簇 2),而黑色素瘤细胞则分布在未分化的祖先状态(簇 1)和另一个确定的终端分化状态(簇 3)(补充图 S4a 和表 S4)。然后,我们使用 Monocle 2 中的分支表达分析建模(BEAM)和层次聚类分析了每个簇的轨迹,以确定跨状态富集的基因。在轨迹上,黑色素瘤细胞簇 3 的基因特征表现为某些功能通路的激活,包括细胞粘附通路(VIM)、免疫反应信号通路(JUN、EGR1)和黑素小体组织信号通路(MLANA)(图 2d, e;补充表 S5)。一致地,验证队列 2 的 IF 分析,包括 13 个良性结膜病变和 18 个原发性 CoM 病变,揭示了恶性结膜黑色素瘤样本中这些标记基因的高表达水平(图 2e, f)。
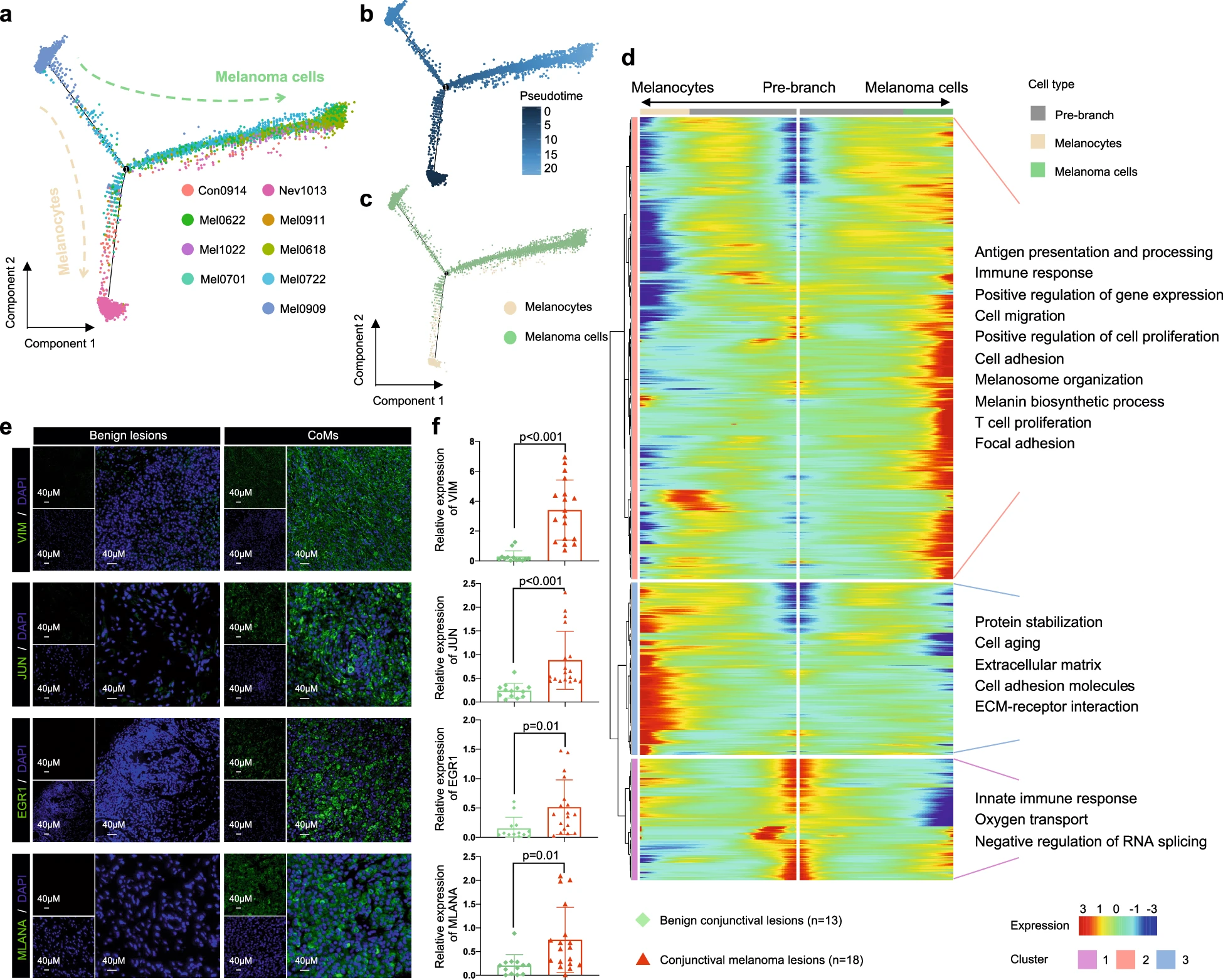
a 转录轨迹分析了来自所有结膜样本的 3041 个黑色素细胞和 11,964 个黑色素瘤细胞,并按患者 ID 进行着色。
b 使用颜色编码的状态直观表示了差异过程的转录轨迹,其中每个数据点对应一个单独的细胞。所用的颜色范围表示黑色素细胞和黑色素瘤细胞的不同状态。两条分支均源自共同的祖先状态(位于左侧),右侧分支表示向黑色素瘤细胞的进展,而下方分支表示向黑色素细胞的过渡。
c 伪时间分析用于比较黑色素细胞和黑色素瘤细胞之间的分布。每个数据点表示一个单独的细胞。黑色素细胞用白色标记,黑色素瘤细胞用绿色标记。
d 热图显示了分化过程中上调或下调的基因。沿伪时间(列)的差异表达基因(行)被层次聚类为三个子簇。提供了每个子簇的代表性富集通路。
e 验证队列中 FFPE 组织中 IF 染色的代表性图像,显示良性病变和 CoM 组织切片中 VIM、JUN、MLANA 和 EGR1 阳性细胞。比例尺,40μm。
f 基于 IF 染色结果,验证队列中非恶性结膜病变(绿色)和 CoM 组织(红色)中 VIM、JUN、MLANA 和 EGR1 的平均表达。所有统计分析均为双尾非配对学生 t 检验,n 代表来自患者的样本数量。
为了深入探讨 CoM 的进展,我们利用 Monocle 算法对黑色素瘤细胞进行了伪时间分析,旨在描绘 ST 和 DMT 组中黑色素瘤细胞的进化轨迹(补充图 S4b)。转录状态的伪时间排序用于将总共 3 个细胞簇分类为 3 个主要分支(补充图 S4c, d)。在按临床结果分类的子集层面,观察到 ST 组的黑色素瘤细胞主要集中在簇 1 和簇 3,而簇 2 主要由 DMT 组贡献(补充图 S4e, f 和表 S6)。为了更深入地了解驱动 CoM 进展的因素,我们利用并比较了 BEAM 进展轨迹中的标记基因(补充图 S4g)。值得注意的是,我们在簇 2 中观察到一系列激活的信号通路,包括糖酵解(P<0.001)和谷胱甘肽代谢(P=0.03)。值得注意的是,这些信号通路也支持 SKCM 和其他黏膜黑色素瘤的远处转移。总体而言,这些观察结果阐明了 CoM 发生和进展过程中的景观,可能表明 CoM 与其他类型黑色素瘤之间的转化模式相似。
CAFs 通过增强血管生成支持远处 CoM 转移¶
间质成纤维细胞是 TME 的重要组成部分,促使肿瘤进展并导致免疫治疗抵抗。随后,我们根据 CAFs(FAP、IL1R1、MMP2 和 PDGFRA)和肌成纤维细胞(TAGLN、MYL9、TPM1 和 TPM2)的标记基因的表达,检测并探索了间质成纤维细胞,包括 CAFs 和肌成纤维细胞的特征,如前所述(图 3a, b;补充图 S5 和表 S7)。在 DMT 组中观察到的 CAFs 数量多于 ST 组(发现队列:χ2=142.87,P<0.001,见图 3c;验证队列 1:χ2=11.46,P<0.001,见补充图 S5f–h)。DMT 组中 CAFs 的大比例表明 CAFs 在 DMT 样本中的致癌作用。

a UMAP 图显示了从 ST 和 DMT 患者中衍生的 CAFs 亚型,按细胞类型着色,蓝色为肌成纤维细胞,橙色为 CAFs。
b UMAP 图展示了肌成纤维细胞(TAGLN、MYL9、TPM1 和 TPM2)和 CAFs(FAP、IL1R1、MMP2 和 PDGFRA)标记基因的表达。颜色光谱表示标记基因的平均表达水平。
c 条形图显示了 ST 和 DMT 样本中 CAFs 和肌成纤维细胞的比例。差异具有统计学显著性。所有统计分析均为卡方检验。
d CAFs、血管内皮细胞、肿瘤和免疫微环境在 ST 和 DMT 组中的通讯网络。
e 肌成纤维细胞和 CAFs 的血管生成 GSVA 评分的箱线图。
f HUVEC 管形成实验显示了肌成纤维细胞和 CAFs 对 HUVEC 管状结构形成的影响。比例尺,50μm。
g 管形成实验中节点、连接点、网格和分支长度的统计数据。n=4。数据以均值±标准差表示。双尾非配对学生 t 检验。肌成纤维细胞组的 HUVEC 共培养数据设为 1。
h ST 组和 DMT 组中 FAP(CAF 标记)、VEGFR 和 CD31 的 IF 染色。DMT 组包括 DMT CoM 患者的远处转移部位。显示了代表性图像(ST 组:原发性 CoM 组织,n=2,左;DMT 组:原发性 CoM 组织,n=2,中;远处转移病变,n=2,右)。比例尺,50μm。
i CoM 中血管相关蛋白与 FAP 的相关性分析(CD31 为蓝色,VEGFR 为橙色)。
j 根据 IF 染色结果,ST CoMs 原发性、DMT CoMs 原发性和远处转移部位中间质细胞标志的相对表达(单向 ANOVA)。
k CAFs 通过增强血管生成促进远处转移的可能作用示意图。
为了探索 CAFs 对远处转移的贡献机制,我们分析并比较了 CAFs 和肌成纤维细胞的表达。发现差异表达的基因在血管生成通路中显著富集(P<0.001,补充图 S5a, b)。一致地,CAFs 中血管生成相关基因的表达水平显著升高,包括 IGF1(P<0.001)、IGF2(P<0.001)、VEGFA(P<0.001)和 VEGFB(P<0.001)(补充图 S5c, i)。根据标记基因定义了血管内皮系统中的细胞类型,包括动脉、静脉和毛细血管,以全面探讨 CAFs 与内皮细胞之间的相关性(补充图 S5d)。正如预期,CAFs 与血管内皮系统表现出强烈的正相关,包括增加的 CAFs 与动脉、静脉和毛细血管的相互作用(图 3d;补充图 S5e)。此外,CAFs 中观察到一系列血管生成信号通路的 GSVA 评分升高,包括内皮细胞增殖(P<0.001)、迁移(P<0.001)和萌发(P<0.001)(图 3e)。这些结果表明,CAFs 与血管共享许多血管生成标记,与之前的研究一致。
为了从 CoM 临床远处转移样本中分离原代 CAFs 和肌成纤维细胞,肿瘤组织按照既定协议进行差异胰蛋白酶消化。随后,通过荧光激活细胞分选(FACS)对成纤维细胞亚群(CAFs 和肌成纤维细胞)进行表征。CAFs 被识别为表达成纤维细胞激活蛋白(FAP)的成纤维细胞,而肌成纤维细胞则被识别为低表达 FAP 的成纤维细胞(补充图 S5j)。通过针对 CAFs(FAP)和肌成纤维细胞(MYL9)的标记物进行 IF 染色进一步验证了区分的细胞(补充图 S5k)。通过 Matrigel 管形成实验评估,CAFs 增强了人脐静脉内皮细胞(HUVECs)的管形成能力(图 3f, g)。我们进一步推测,CAFs 通过促进血管生成和形成纤维血管位点,促进了肿瘤进展。为了全面再现原发性和远处转移性 CoM 的分子特征,我们从验证队列 2 中的 ST 和 DMT 患者收集了原发性和远处转移病变,并评估了 FAP、CD31 和 VEGFR 的表达。与之前的观察结果一致,CAFs 通常包裹内皮细胞形成纤维血管位点(图 3h)。具体来说,观察到 FAP 与血管标记物(CD31 和 VEGFR)之间的正相关表达(图 3i, j)。总体而言,这些结果表明 CAFs 在血管生成过程中被激活,促进了 CoM 的远处转移(图 3k)。
相对静止的免疫生态系统与远处转移性 CoM 相关¶
免疫微环境的信号教育肿瘤细胞的适应性可塑性,在决定临床结果中起着重要作用。为了描绘肿瘤免疫微环境,我们生成了免疫细胞的 UMAP 图,并检查了肿瘤样本中的平均基因表达,以识别分层簇(图 4a)。识别的免疫细胞包括 T 细胞(PTPRC、CD3E 和 CD3D)、B 细胞(CD79A、MS4A1 和 CD19)、肥大细胞(MS4A2 和 CPA3)、单核细胞(CSF1R、C1QA 和 VCAN)、中性粒细胞(CSF3R 和 FCGR3B)和浆细胞(ICHAIN 和 TNFRSF17)(图 4b)。值得注意的是,在发现队列和验证队列 1 中,ST 和 DMT 组之间的比例表现出显著的异质性(图 4c)。我们观察到所有 CoM 中肥大细胞和中性粒细胞的浸润很少。相反,DMT 组和 ST 组之间的其他免疫细胞组成有所不同。在发现队列和验证队列 1(总计:P=0.003,发现队列:P=0.002,验证队列 1:P=0.05)中,DMT 样本(n=7)的 B 细胞和 T 细胞浸润水平低于 ST 样本(n=7),尤其是 CD8+ T 细胞(图 4d;补充图 S6a, b)。总之,这些结果表明,不同的免疫微环境与 CoM 患者的转移结果相关,尽管存在显著的异质性。
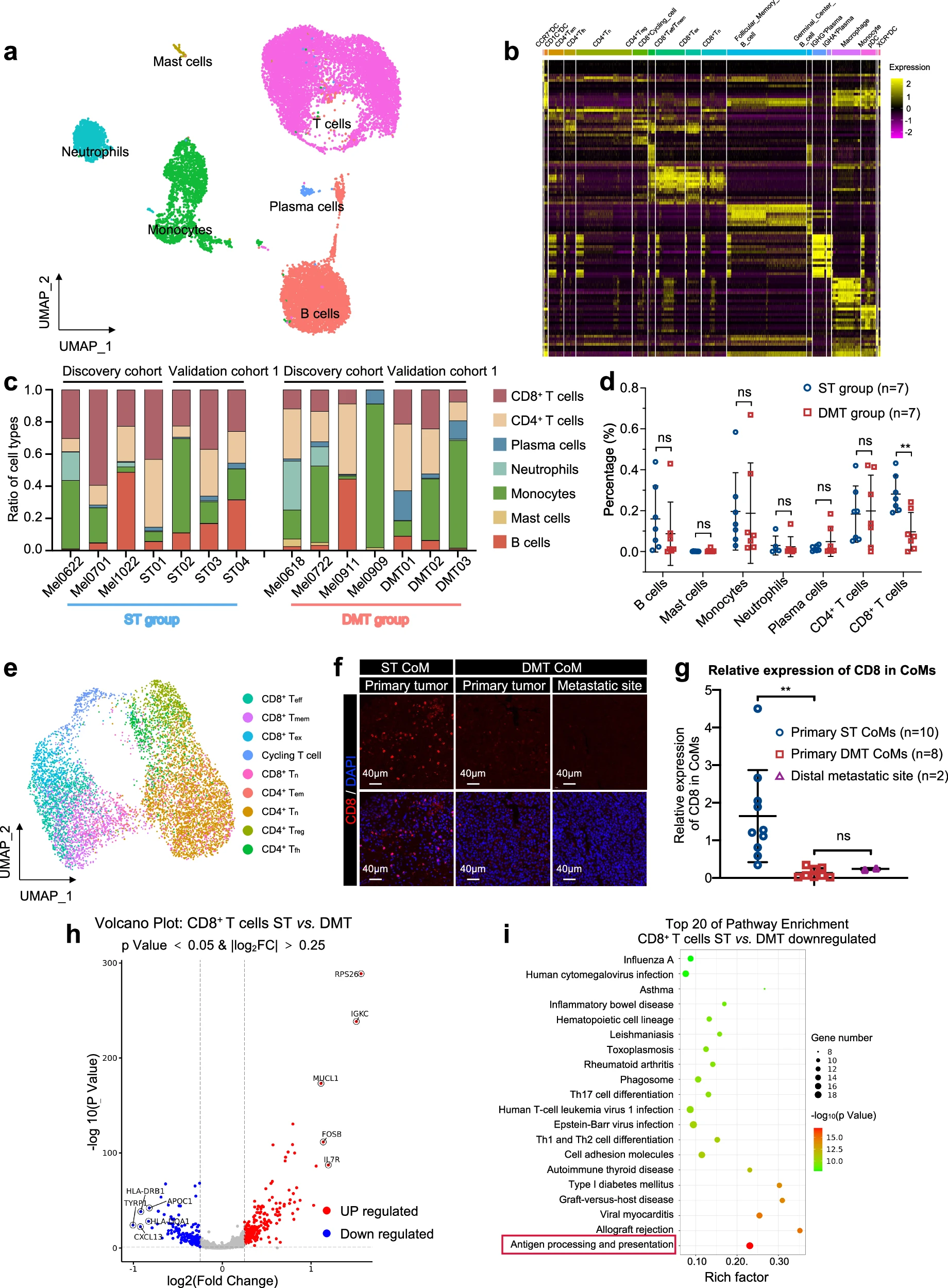
a UMAP 图显示了 CoM 样本中的免疫细胞类型,用不同颜色标记。
b 热图显示了每种亚型免疫细胞中标记基因的表达水平。
c 条形图显示了 ST 组 7 个样本和 DMT 组 7 个样本中注释的细胞类型的比例。
d 发现队列和验证队列 1 中 ST 组和 DMT 组的每种免疫细胞亚型比例。双尾非配对学生 t 检验。
e UMAP 图显示了发现队列中所有 7 个 CoM 样本的 T 细胞亚型,用不同颜色标记。
f CoM 组织切片和远处转移部位中使用 CD8 抗体的 IF 染色,分别来自 ST 组和 DMT 组。DMT 组包括 DMT CoM 患者的远处转移部位。显示了代表性图像(ST 组:原发性 CoM 组织,n=2,左;DMT 组:原发性 CoM 组织,n=2,中;远处转移病变,n=2,右)。比例尺,40μm。
g 根据 IF 染色结果,原发性 ST CoMs、原发性 DMT CoMs 和远处转移部位中 CD8 的平均表达(单向 ANOVA)。
h 火山图显示了 ST 组和 DMT 组之间 CD8+ T 细胞中差异表达的基因。
i 气泡图显示了 ST 组和 DMT 组之间 CD8+ T 细胞中下调基因的富集通路。显示了前 20 个过程。
我们进一步应用降维分析来展示 T 细胞的异质性。如 UMAP 图所示,T 细胞根据标记基因的平均表达水平聚类成 9 个亚型(图 4e)。与 scRNA-seq 结果一致,在远处转移性 CoM 组织中观察到低比例的 CD8+ T 细胞,包括验证队列 2 中的原发性和转移性病灶(学生 t 检验,P=0.003;图 4f, g)。ST 和 DMT 样本中的 CD8+ T 细胞表现出不同的转录组特征,与 ST 样本相比,DMT 样本中的 CD8+ T 细胞中有 216 个基因上调,173 个基因下调(图 4h)。一致地,这些下调的基因在与免疫相关的通路中富集,包括抗原处理和呈递、T 细胞分化和自身免疫疾病(图 4i)。总体而言,这些数据表明远处转移性 CoM 的免疫生态系统表现出较低的 CD8+ T 细胞浸润水平,导致远处转移性 CoM 中的免疫环境相对不活跃。
功能性 CD8+ T 细胞在远处转移性 CoM 中被排除¶
然后,我们应用降维分析进一步展示 CD8+ T 细胞的异质性。如 UMAP 图所示,CD8+ T 细胞根据标记基因的平均表达水平聚类成 5 个亚型,根据以往的方法(图 5a)。
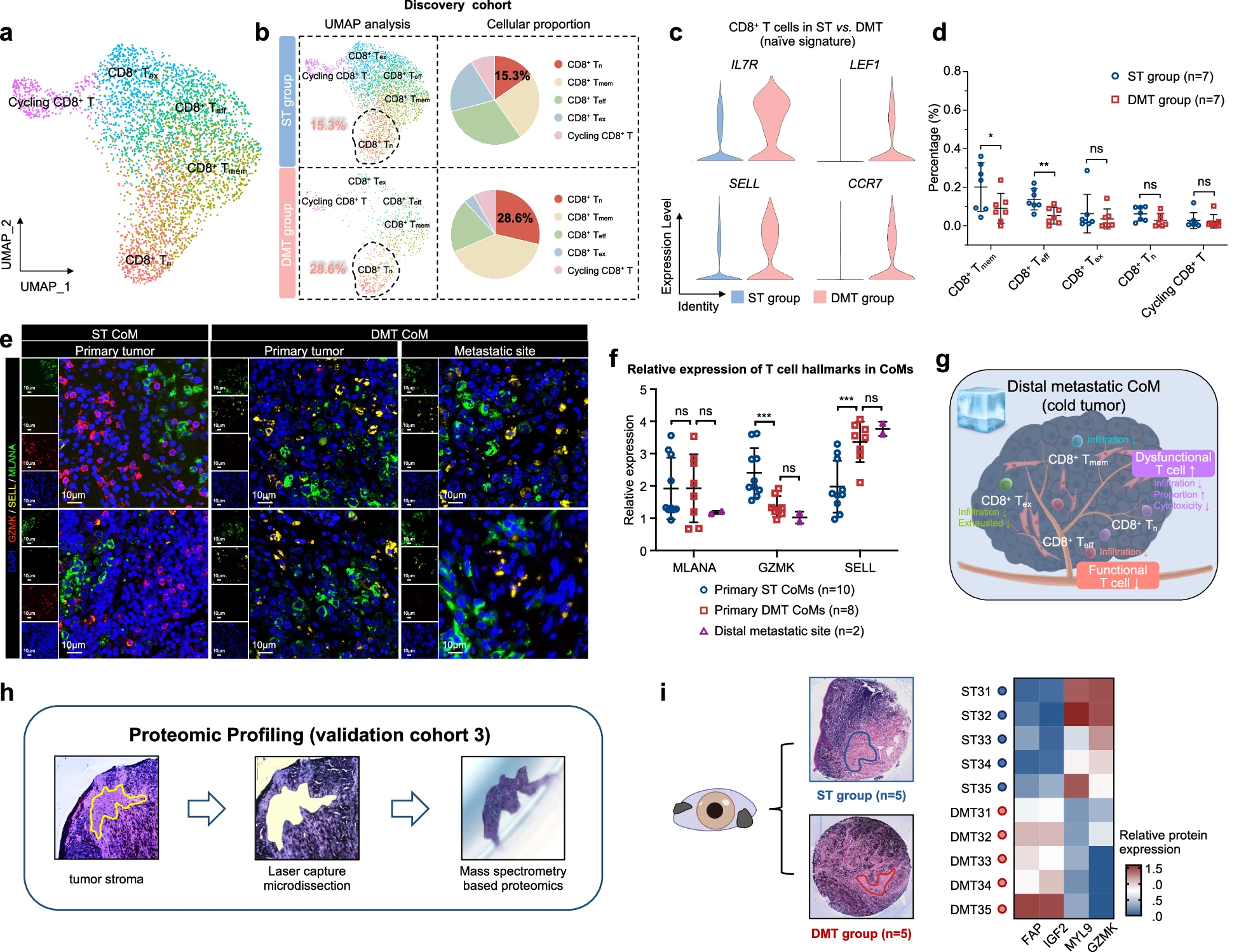
a UMAP 图显示了来自所有 7 个 CoM 样本的 CD8+ T 细胞亚型,用不同颜色标记。
b 分析了 ST 组和 DMT 组之间特定 CD8+ T 细胞亚型的比例(左)。饼图显示了 ST 和 DMT 组中 CD8+ Tn 细胞的比例(右)。
c 小提琴图显示了 ST 组和 DMT 组中 CD8+ T 细胞的初始特征表达。
d 分析了发现队列和验证队列 1 中 ST 组(n=7)和 DMT 组(n=7)之间特定 CD8+ T 细胞亚型的浸润比例。双尾非配对学生 t 检验。
e IF 染色验证了 ST 和 DMT 样本中免疫微环境的特征。DMT 组包括 DMT CoM 患者的远处转移部位。显示了代表性图像(ST 组:原发性 CoM 组织,n=2,左;DMT 组:原发性 CoM 组织,n=2,中;远处转移病变,n=2,右)。比例尺,10μm。
f 根据 IF 染色结果,原发性 ST CoMs、原发性 DMT CoMs 和远处转移部位中 MLANA、GZMK 和 SELL 的相对表达(单向 ANOVA)。
g 示意图显示了远处转移性 CoM 中 CD8+ T 细胞的变化。
h FFPE 组织切片并用苏木精和伊红(H&E)染色以识别组织形态学特征。然后使用激光捕获显微切割(LCM)切除组织,并准备用于基于 LC-MS/MS 的蛋白质组学分析。
i ST 组(n=5)和 DMT 组(n=5)之间差异表达的蛋白质,患者来源在左侧标注。
为了展示 CD8+ T 细胞的详细功能亚型,我们比较了 ST 组和 DMT 组之间的细胞比例。特别是,在 DMT 组中观察到 CD8+ 初始 T 细胞(Tn)细胞比例显著增加(发现队列:ST 中为 15.3%,DMT 中为 28.6%,χ2=73.13,P<0.001;验证队列 1:ST 中为 16.4%,DMT 中为 20.5%,χ2=17.92,P<0.001;见图 5b;补充图 S6c)。DMT 组中的 CD8+ T 细胞显示 IL7R(P<0.001)、LEF1(P<0.001)、SELL(P<0.001)和 CCR7(P<0.001)表达增加,提示一种初始和功能障碍表型(图 5c)。由于在转移性肿瘤中观察到的初始 T 细胞群体的细胞毒性降低,这表明 T 细胞重编程在远处转移性 CoM 中起关键作用。
为了进一步评估 DMT 样本中免疫生态系统的功能效应,我们分离了 CD8+ T 细胞并比较了 ST 组和 DMT 组中各亚型的浸润情况。大多数 CD8+ T 细胞亚型在 DMT 组中的浸润水平低于 ST 组,CD8+ 效应 T 细胞(Teff)和 CD8+ 记忆 T 细胞(Tmem)的比例在 DMT 组中显著降低(P=0.01 和 P=0.03)(图 5d;补充图 S6d, e)。值得注意的是,DMT 组中的 CD8+ Teff 细胞显示 PDCD1(抗 PD1 疗法的靶点)表达增加(补充图 S6f),进一步强调了 CoM 转移性微环境中 T 细胞群体的功能障碍。然而,CD4+ T 细胞没有明显差异(补充图 S6g)。
此外,通过 IF 染色验证了 CD8+ T 细胞的独特特征,包括功能障碍亚型的比例增加(通过初始 T 细胞标记 SELL 测量)和功能亚型的浸润减少(通过有效 T 细胞标记 GZMK 测量)在 ST 和 DMT(原发性和转移性病灶)组中(图 5e, f)。总体而言,功能障碍的 Tn 细胞比例增加和 CD8+ Teff/Tmem 细胞浸润减少导致了相对静止的微环境,将远处转移性 CoM 描述为功能性 T 细胞排除的“冷”肿瘤(图 5g)。
组织形态学区域的蛋白质组特征突显了 TME 中的独特生物过程并验证了 scRNA-seq 发现¶
为了研究 TME 的蛋白质组模式,我们在一个包括 10 个良好采样的福尔马林固定石蜡包埋(FFPE)原发性 CoM 的队列中进行了空间蛋白质组分析。对于每个单独的病例,由上海第九人民医院病理科的两位认证病理学家通过共识注释定义了 CoM 的间质区域,并使用激光捕获显微切割(LCM)切除 TME 区域,如前所述。总共,我们分离了 10 个 CoM 样本(ST 组 n=5,DMT 组 n=5)进行 LC-MS/MS 分析,结果量化了总共 3514 种蛋白质,其中 66 种上调,48 种下调(图 5h;补充图 S7a)。
重要的是,DMT 样本显示出增强的血管生成能力,伴随着 CAFs 标记(FAP 和 IGF2)表达增加,肌成纤维细胞标记(MYL9)表达减少,以及功能性 T 细胞标记(CD8+ Teff 细胞标记 GZMK)表达减少,这与发现队列的结果一致。这些发现与观察到的 CAF 介导的血管生成和转移性 CoM TME 中功能障碍的 T 细胞一致(图 5i;补充表 S8)。
VEGFR 阻断联合抗 PD1 治疗在远处转移性 CoM 患者中触发临床疗效¶
先前的研究表明,转移性 CoM 和转移性黏膜黑色素瘤对抗 PD1 单药治疗的反应有限。相反,抗血管生成剂与抗 PD1 联合使用在各种实体瘤中显示出有希望的安全性并表现出显著的抗肿瘤活性,特别是在皮肤黑色素瘤中。基于上述数据,我们为远处转移性 CoM 患者启动了一项临床试验(ChiCTR2100045061)。收集并呈现了入组患者的临床详细信息(补充表 S9)。
为了研究 VEGFR 阻断(Apatinib)与抗 PD1(Camrelizumab)联合治疗的临床效果,招募并记录了一组远处转移的患者。患者 CoM-10 在通过 PET/CT 发现多发性肝转移后接受了 VEGFR 抑制剂(VEGFRi)和抗 PD1 治疗。按照标准治疗方案治疗 5 个月后,影像学评估显示患者病情稳定。患者在 14 个月的稳定期后进展,经历了从稳定期到因脑转移去世的 22.42 个月随访。患者 CoM-11 在 2021 年通过 PET/CT 诊断出左肺上叶和下叶转移。在 3 个疗程的抗 VEGFR 和抗 PD1 治疗后,没有发现疾病进展。到 2023 年 8 月的最新随访,患者仍然存活。根据 RECIST 1.1 标准,在 VEGFR 阻断联合抗 PD1 治疗后,两名患者的肿瘤负荷均有所减少(图 6c)。
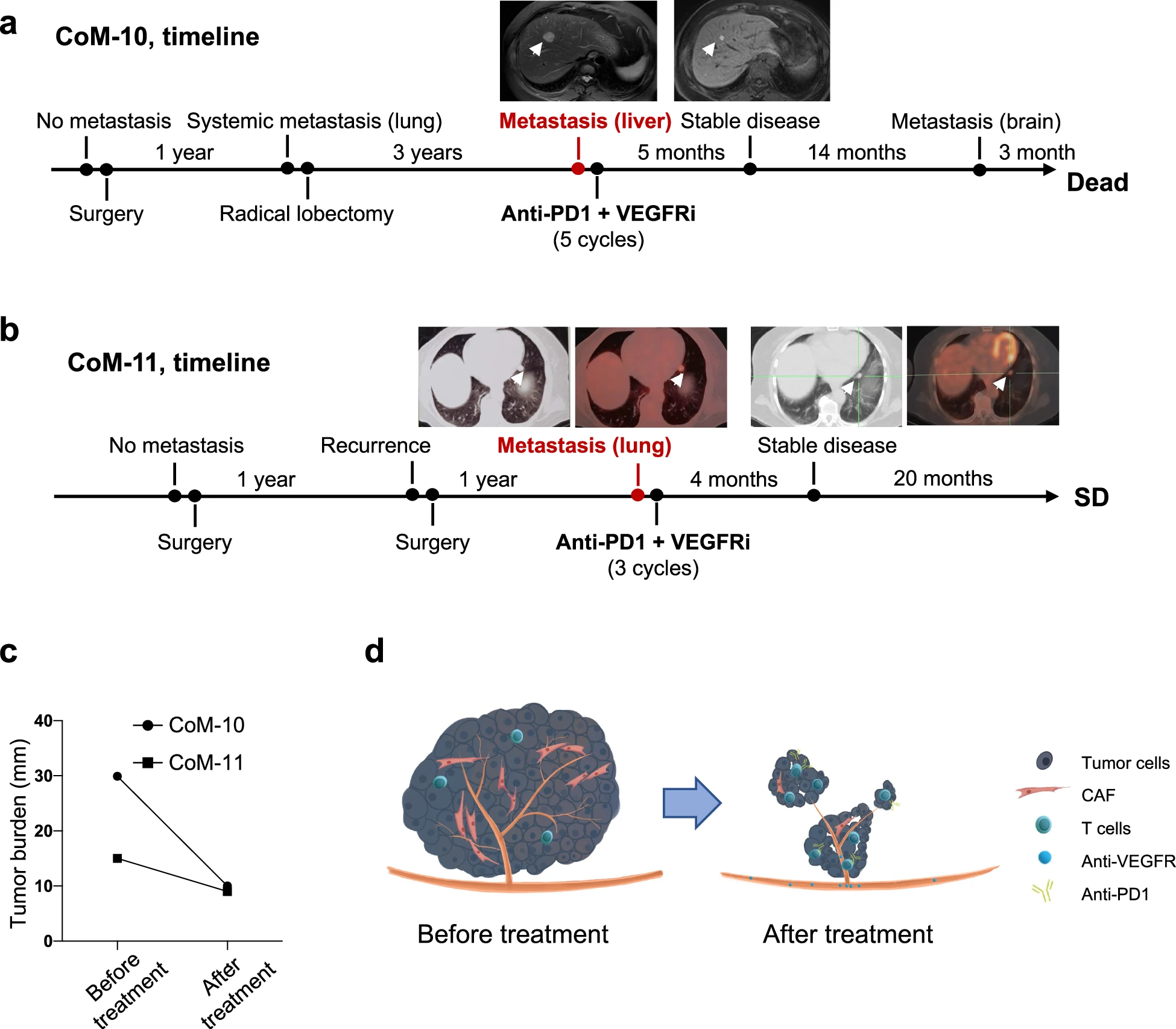
a 患者 CoM-10 接受 VEGFR 阻断联合抗 PD1 治疗后的放射学变化时间表。
b 患者 CoM-11 的 CoM 进展和治疗示意图。肿瘤被确认复发并迅速进展。在 VEGFR 阻断联合抗 PD1 治疗下,未观察到进展。
c 患者肿瘤负荷的时间变化。
d 临床试验可能潜在机制的示意图。
为了进一步评估免疫治疗和靶向治疗的临床疗效,我们分析了 2020 年 1 月至 2023 年 8 月期间在我们中心治疗的远处转移性 CoM 患者的临床特征和治疗信息。详细的临床和病理信息以及治疗过程见补充表 S10。在所有 11 名远处转移性 CoM 患者中,5 名患者在局部切除后未接受系统治疗,中位生存时间为 3.91 个月(蓝色)。四名患者接受了抗 PD1 免疫治疗,中位生存时间为 5.67 个月(红色)。上述参加临床试验并接受抗 VEGFR 和抗 PD1 治疗的 2 名患者显示出延长的预后(中位生存时间=23.71 个月,绿色,P=0.02,log-rank P 检验,补充图 S8a)。总体而言,VEGFR 阻断联合抗 PD1 治疗可以被认为是一种针对远处转移性 CoM 患者的新治疗策略(图 6d)。
讨论¶
尽管诊断和治疗手段取得了进展,但由于远处转移的频繁发生,即使在进行眼窝清扫手术后,CoM 的临床结果仍不令人满意。考虑到在皮肤、脉络膜和结膜黑色素瘤中观察到的不同基因背景和突变特征,基于每种亚型的特定遗传特征修改治疗方法是必要的。此外,缺乏对 CoM 进展的基本机制的全面理解,阻碍了潜在靶向治疗干预措施的转化实施。本文的 scRNA-seq 研究揭示了肿瘤、间质成纤维细胞和免疫细胞的复杂生态系统的高分辨率描述,为 DMT CoM 的临床决策提供了支持。
CoM 的转录组特征得以描绘。我们的一个观察结果是识别了关键基因,这些基因对转录状态的演变有贡献,包括 VIM、JUN、MLANA 和 EGR1。这些升高的致癌信号通路也在 SKCM 和脉络膜黑色素瘤的恶性转化中被观察到,表明不同类型黑色素瘤的起始之间存在共同的遗传联系。然而,这些基因在 CoM 细胞演变中的分子机制仍未探索,需在未来进行调查。
TME,包括间质成纤维细胞和免疫成分,对不同类型黑色素瘤的远处转移具有调控作用。然而,尚未在单细胞分辨率下研究 CoM TME。我们的研究揭示了在 DMT CoM 中表现出高表达血管生成标记基因的 CAFs 的存在。先前的研究表明,CAFs 是肿瘤进展中主要的细胞外基质成分来源,这与我们的观察一致。此外,CAFs 还分泌大量细胞因子、趋化因子、生长因子和外泌体,可能促进肿瘤进展并调节治疗反应。
VEGF 在 TME 中发挥重要的免疫抑制作用并介导 T 细胞排除,VEGF 对于 T 细胞粘附和渗出是必需的。此外,肿瘤血管可以过表达 Fas 配体,Fas 配体可诱导表达 Fas 的迁移 T 细胞的凋亡,从而阻止 T 细胞在 CoMs 中的浸润,例如免疫排除的肿瘤。另一方面,先前的研究表明,VEGF 分泌增加会降低 T 细胞效应功能和对肿瘤的迁移。通过抑制 VEGF- 受体通路联合免疫检查点抑制剂在治疗转移性肾细胞癌和肝细胞癌中,改善肿瘤组织灌注和免疫功能的努力已经展开。
黑色素瘤是一种异质性疾病,在不同部位和不同阶段的治疗策略各不相同。本文描述了 DMT CoM 中 CD8+ T 细胞排除特征的独特免疫细胞组成。值得注意的是,抗 PD1 的检查点抑制剂疗法是通过各种途径激活 CD8+ T 细胞反应治疗转移性黑色素瘤的突破之一。先前的研究显示,抗 PD1 治疗后转移性 SKCM 患者的生存率有所提高。然而,在 PD1 阻断治疗的黑色素瘤患者中也观察到治疗耐药。我们注意到 DMT CoM 的肿瘤微环境中癌症相关成纤维细胞的丰度增加,这与增强的血管生成能力和 VEGFR 表达增加相关。此外,DMT CoM 表现出免疫抑制环境,表现为效应/记忆 CD8+ T 细胞的减少和初始 CD8+ T 细胞的增多。鉴于这些关键变化,我们启动了 VEGFR 阻断联合抗 PD1 治疗远处转移性 CoM 患者的临床试验,展示了足够的抑瘤效果。
重要的是,我们的数据表明抗血管生成治疗不仅有助于减少促进恶性生长和转移的血管,还改变了 TME,从而可能增强非免疫反应性 CoM 的反应。
为了通过减少血管和利用免疫检查点阻断作为治疗目标来增强免疫细胞补充,采用了 VEGFR 阻断(阿帕替尼)和抗 PD1(卡瑞利珠单抗)联合治疗。该组合提供给被鉴定为 VEGFR 表达增加的远处转移性 CoM 患者。与局部切除后未接受系统治疗的患者相比,参加临床试验并接受抗 VEGFR 和抗 PD1 治疗的 2 名患者表现出延长的预后,中位生存时间增加了 6 倍(3.91 个月对比 23.71 个月)。然而,有限的样本量限制了对 DMT CoM 临床效力的深入分析。由于 CoM 是一种罕见疾病,需要在长期研究中充分探讨抗 PD1/VEGFRi 的临床潜力。
综上所述,我们的工作提供了对 CoM 景观及其在 TME 中间质细胞和免疫细胞特征的重要见解,揭示了 CoM 的异质性。这种复杂性通过 CAF 诱导的增强血管生成和肿瘤转移以及 DMT CoM 中的 CD8+ T 排除的发现得以揭示。这些观察结果促使了 CoM 患者的临床决策。临床试验结果为 DMT CoM 的治疗提供了新的临床策略。
材料与方法¶
样本收集和伦理批准 本研究按照《赫尔辛基宣言》进行,并获得上海交通大学医学院附属第九人民医院机构审查委员会的批准(SH9H-2019-T185-2)。本研究中的验证队列样本是从 2018 年 6 月至 2022 年 6 月间,上海交通大学医学院附属第九人民医院病理科确诊的 CoM 患者中收集的。所有患者均签署了书面知情同意书。人类肿瘤标本来自于接受广泛切除、冷冻治疗或眼窝清扫术以及淋巴结和远处转移部位切除的 CoM 患者。本研究纳入的患者年龄>18 岁,具有组织学确诊的结膜黑色素瘤。系统性转移病例通过影像学确诊。非恶性结膜样本来自于因结膜痣和眼外伤接受局部结膜切除术的患者。所有新鲜组织被解剖并酶解成单细胞悬液。
研究人群和试验设计 本临床试验在中国上海交通大学医学院附属第九人民医院进行。符合条件的患者年龄>18 岁,组织病理学确诊为局部或广泛晚期 CoM。患者在 2021 年 1 月至 2022 年 12 月期间入组。
试验遵循《赫尔辛基宣言》的伦理指南,并获得上海交通大学医学院附属第九人民医院伦理委员会的批准。每位患者在参与本试验前均提供签署的知情同意书。第九人民医院临床研究委员会批准了数据发布的授权。本试验在中国临床试验注册中心注册(ChiCTR2100045061)。在本研究中,患者免费接受卡瑞利珠单抗(200mg,每 3 周,静脉注射)和阿帕替尼(250mg,每日一次,口服)。
组织解离 ScRNA-seq 实验由 NovelBio 生物制药技术有限公司的实验人员在实验室进行。组织被手术切除并保存在 MACS 组织保存液(Miltenyi Biotec)中,直到处理。首先用磷酸盐缓冲液(PBS)洗涤组织样本,在冰上切成小块(约 1mm³),并用 200μL Enzyme H、100μL Enzyme R 和 25μL Enzyme A 在 37°C 下酶解 30 分钟,同时震荡。酶解后,样本通过 70μm 细胞滤网筛选,并在 300×g 离心 5 分钟。去除上清液后,将沉淀的细胞悬浮在红细胞裂解缓冲液(Miltenyi Biotec)中以裂解红细胞。用含 0.04% BSA 的 PBS 洗涤后,将细胞沉淀重悬在含 0.04% BSA 的 PBS 中并通过 35μm 细胞滤网重新过滤。解离的单细胞随后用 Countstar 荧光细胞分析仪染色以评估活力。
ScRNA-seq 发现队列使用 BD Rhapsody 系统。通过限量稀释方法,将单细胞悬液随机分配到>200,000 个微孔中,实现单细胞捕获。将含有寡核苷酸条形码的珠子添加到饱和状态,以便在一个微孔中与一个细胞配对。在微孔中裂解细胞以将 mRNA 分子与珠子上的条形码捕获寡核苷酸杂交。收集珠子到一个管中进行逆转录和 ExoI 消化。在 cDNA 合成过程中,每个 cDNA 分子在 5' 端(即 mRNA 转录的 3' 端)标记一个独特的分子标识符(UMI)和细胞条形码,指示其细胞来源。使用 BD Rhapsody 单细胞全转录组扩增(WTA)工作流程,包括随机引物扩展(RPE)、RPE 扩增 PCR 和 WTA 索引 PCR,制备全转录组文库。使用 Bioanalyzer 2200 上的高灵敏度 DNA 芯片(Agilent)和 Qubit 高灵敏度 DNA 测定法(Thermo Fisher Scientific)对文库进行定量。通过 Illumina 测序仪(Illumina, San Diego, CA)在 150bp 双端运行上进行测序。
验证队列 1 的 scRNA-seq 文库使用 10X Genomics Chromium 控制器仪器和 Chromium 单细胞 3' V3 试剂盒(10X Genomics, Pleasanton, CA)生成。简而言之,将细胞浓缩到~1000 个细胞/μL 并加载到每个通道中以生成单细胞胶珠 - 乳剂(GEMs)。在 RT 步骤后,破碎 GEM 并纯化条形码 -cDNA 并扩增。扩增的条形码 cDNA 被片段化、A 尾化、连接适配器并进行索引 PCR 扩增。使用 Qubit 高灵敏度 DNA 测定法(Thermo Fisher Scientific)对最终文库进行定量,并使用 Bioanalyzer 2200 上的高灵敏度 DNA 芯片(Agilent)确定文库的大小分布。所有文库通过 Illumina 测序仪(Illumina, San Diego, CA)在 150bp 双端运行上进行测序。
ScRNA-seq 数据分析 ScRNA-seq 数据分析由 NovelBio 生物制药技术有限公司使用 NovelBrain 云分析平台进行。我们应用 fastp 以默认参数过滤适配器序列并去除低质量读数以获得干净数据。使用 UMI 工具进行单细胞转录组分析以识别细胞条形码白名单。使用 UMI 工具标准流程的定制参数将 UMI 基础的干净数据映射到人类基因组(Ensemble 版本 91)以获得每个样本的 UMI 计数。包含超过 200 个表达基因且线粒体 UMI 率低于 40% 的细胞通过细胞质量过滤,表达表中删除线粒体基因。根据 UMI 计数和线粒体率百分比,使用 Seurat 包(版本:3.1.4,https://satijalab.org/seurat/)对细胞进行标准化和回归以获得缩放数据。基于前 2000 个高变基因构建 PCA,并使用前 10 个主成分进行 tSNE 和 UMAP 构建。
利用基于图的聚类方法(分辨率=0.8),我们基于 PCA 前 10 个主成分获得无监督细胞聚类结果,并使用 wilcox 秩和检验算法的 FindAllMarkers 函数计算标记基因,标准如下:(1)lnFC>0.25;(2)P<0.05;(3)min.pct>0.1。为了详细识别细胞类型,选择相同细胞类型的聚类进行重新 tSNE 分析、基于图的聚类和标记分析。
伪时间分析 我们使用 Monocle2(http://cole-trapnell-lab.github.io/monocle-release)和默认参数应用单细胞轨迹分析。在 Monocle 分析之前,我们选择了 Seurat 聚类结果的标记基因和通过过滤的细胞的原始表达计数。基于伪时间分析,分支表达分析建模(BEAM 分析)用于分支命运确定基因分析。
细胞通讯分析 为了系统分析细胞间通讯分子,我们基于 CellPhoneDB 进行细胞通讯分析,这是一种配体、受体及其相互作用的公共数据库。注释了不同时间点簇的膜分泌和外周蛋白。基于相互作用和 Seurat 标准化获得的标准化细胞矩阵,计算显著均值和细胞通讯显著性(P<0.05)。
差异基因表达分析 为了识别样本之间的差异表达基因,使用 wilcox 秩和检验算法的 FindMarkers 函数,标准如下:(1)lnFC>0.25;(2)P<0.05;(3)min.pct>0.1。
CNV 估计 使用 R 包 infercnv(v0.8.2)以内皮细胞和成纤维细胞作为参考识别体细胞 CNVs。通过全基因组 CNV 值的均方来评分每个细胞的 CNV 信号。将 CNV 信号高于 0.05 且 CNV 相关性高于 0.5 的细胞定义为潜在恶性细胞。
IF 染色分析 用 4% 甲醛固定脱蜡和再水化的组织样本或玻片上的细胞 30 分钟,用 5% 正常山羊血清(Vector)封闭 1 小时,并用 0.5% Triton X-100 透化 15 分钟。随后,样本在 4°C 孵育过夜的初级抗体和在室温下孵育 1 小时的相应次级抗体。用 DAPI(Sigma-Aldrich)在室温下孵育 30 分钟染核。最后,用 ZEISS Axio Scope A1 立式显微镜拍摄 IF 图像。使用 ImageJ 1.52 软件测量目标蛋白的表达。
细胞培养 CAFs 和肌成纤维细胞来源于新鲜手术切除的正常和 CoM 肿瘤组织。由院内病理学家评估结膜黑色素瘤的初步病理诊断。将组织切碎,并通过差异胰蛋白酶消化分离成纤维细胞。在贴壁成纤维细胞培养 5-8 天至 80% 汇合后,用 FAP 标记混合成纤维细胞并通过 FACS 分选以富集 FAP 阳性 CAFs。本研究中涉及人类参与者的所有程序均遵循上海交通大学医学院附属第九人民医院和 1964 年《赫尔辛基宣言》及其后续修订或可比较的伦理标准。细胞在 37°C、5% CO2 供应的湿润培养箱中孵育。所有细胞系均无支原体和致病性鼠病毒。
FACS 简要来说,提取和切碎肿瘤组织。将肿瘤细胞胰蛋白酶消化并在冰上重悬为单细胞悬液,然后进行分选。细胞在冰上用染色缓冲液重悬并用抗 FAP 染色 30 分钟,然后在 MoFlow XDP(Beckman Coulter,美国)上分离。这些分离的 FAP 阳性成纤维细胞被称为“CAFs”,其余细胞称为“肌成纤维细胞”。
流式细胞术分析 细胞用荧光染料标记的抗体染色。使用的抗体详见补充表 S11。然后用流式细胞仪(BD FACSCalibur,BD Biosciences,CA)分析染色的细胞。
HUVEC 管形成实验 将 24 孔板每孔预涂 150μL 预冷的 Matrigel(Corning,354234),在 37°C 下聚合 30 分钟。悬浮在 200μL 条件培养基中的 HUVECs(1×104 细胞)与肌成纤维细胞和 CAFs 共培养,每孔进一步培养 4 小时。然后随机选择和拍摄管状结构的视野以进行定量。
LCM 组织处理 将 FFPE 组织切片切至 8μm,收集后风干并在 65°C 下加热 60 分钟以促进更好的附着力。接着,将切片脱蜡、再水化并湿载,按如下顺序进行:2×2 分钟二甲苯,2×1 分钟 100% 乙醇,95% 乙醇,85% 乙醇,75% 乙醇,50% 乙醇和 ddH20。然后将组织切片按如下步骤染色:每片用苏木精染色 7 分钟,用蓝化缓冲液染色 2 分钟,用伊红染色 40 秒。最后一步的剩余缓冲液应使用水冲洗。H&E 染色的组织切片在 37°C 孵育 5 分钟并在 20 倍放大倍率下用数字切片扫描仪 SLIDEVIEW VS200(OLYMPUS)可视化。
在激光捕获显微切割系统 PALM(Zeiss)上完成 LCM 程序。开启 LCM 系统并保持 15 分钟以稳定激光能量。显微镜和激光设置如下:放大倍数:20×;切割能量:39;对焦:62;发射能量:64;对焦:70;循环次数:1;切割速度:100。将干燥的 H&E 染色切片放在 LCM 显微镜的切片适配器上。使用 LCM 标记笔标记切片中包含特定细胞类型的感兴趣区域,并使用上述设置进行微切并用微管(Zeiss,415190-9201-000)收集。通过 LCM 分离的 CoM 间质区域的方法由上海交通大学医学院附属第九人民医院病理科的病理学家验证。将微切样本存储在–80°C 或消化以进行蛋白质组学分析。
样品制备和 MS 分析 将微切样本重悬于 5μL 裂解缓冲液中,并使用非接触高强度超声处理器(Scientz)超声 3 分钟,然后在 95°C 孵育 5 分钟。加入 1μL 50ng 胰蛋白酶后,在 37°C 孵育过夜进行蛋白质消化。使用 C18 Zip Tips 脱盐肽,根据制造商的说明,然后干燥以进行进一步的 MS 分析。
空间蛋白质组分析由 PTM 生物实验室进行。胰蛋白酶肽溶解在溶剂 A 中,直接加载到自制反相分析柱(25cm 长度,100μm 内径)上。流动相由溶剂 A(0.1% 甲酸,2% 乙腈/水中)和溶剂 B(0.1% 甲酸,90% 乙腈/水中)组成。肽按如下梯度分离:0–1.6 分钟,4%–22.5%B;1.6–2.0 分钟,22.5%–35%B;2.0–2.1 分钟,35.0%–35.1%B;2.1–2.3 分钟,35.1%B;2.3–9.2 分钟,35.1%–35.2%B;9.2–9.6 分钟,35.2%–55.0%B;9.6–10.1 分钟,55.0%–99.0%B;10.1–12.0 分钟,99%B,恒定流速为 200nL/分钟,在 Vanquish Neo UPLC 系统(Thermo Fisher Scientific)上进行。分离的肽在 Orbitrap Astral 上用纳米电喷雾离子源进行分析。应用的电喷雾电压为 1900V。前体在 Orbitrap 检测器上分析,片段在 Astral 检测器上分析。全 MS 扫描分辨率设置为 240,000,扫描范围为 400–800m/z。MS/MS 扫描固定第一个质量为 150.0m/z,分辨率为 80,000。HCD 碎裂在 25% 标准化碰撞能下进行。自动增益控制目标设置为 800%,最大注射时间为 15ms。
统计分析 使用 GraphPad Prism 9.2 进行统计分析。使用 Student’s t 检验或单向 ANOVA 进行比较评估。数据以均值±SD 表示。P<0.05 被认为具有统计学显著性。
数据可用性 发现队列的 ScRNA-seq 数据已在基因表达汇总(GEO)平台上存档,编号为“GSE217707”。验证队列 1 的 ScRNA-seq 数据已在国家组学数据百科全书平台(NODE,https://www.biosino.org/node/)上存档,编号为“OEZ01468~OEZ01474”。