TIM 3+ CD8 T cells with a terminally exhausted phenotype retain functional capacity in hematological malignancies
慢性抗原刺激被认为会导致 CD8 T 细胞功能失调。在此,我们在骨髓肿瘤微环境中鉴定了一种 CD8 T 细胞亚群,尽管表现出明显的终末耗竭表型(TPHEX),却表达了颗粒酶、穿孔素和干扰素 -γ(IFN-γ)。基因表达和 DNA 可及性分析显示,编码这些功能蛋白的基因与 BATF 表达和基序可及性相关。具有 IFN-γ 的 TPHEX 能够有效地杀死骨髓瘤,效能与过渡性效应细胞相当,并且疾病进展与 IFN-γ+ TPHEX 数量的减少相关。我们还观察到 CD19 靶向嵌合抗原受体 T 细胞中的 IFN-γ+ TPHEX 能够杀死 CD19+ 白血病细胞。在包括骨髓瘤和淋巴瘤在内的人类癌症中,IFN-γ+ TPHEX 基因特征在耗竭性 T 细胞(TEX)中得到了重现。在此,我们描述了血液恶性肿瘤中一种矛盾地保持功能的 TEX 亚群,与在慢性病毒感染中发现的功能失调的 TEX 不同。因此,IFN-γ+ TPHEX 代表了一种潜在的血癌免疫治疗靶点。
引言¶
随着多个与耗竭性 T 细胞(TEX)表型相关的转录因子(TF)的发现,对 CD8 T 细胞耗竭的特征和理解不断演变。胸腺细胞选择相关高迁移率族盒(TOX)和核受体转录因子(NR4A)家族 TF 的表达增加以及 T 细胞因子 1(TCF-1)表达的丧失,最近在小鼠和人类中被认为与 TEX 表型相关【1-5】。TCF-1 表达的维持标志着具有干细胞样特性和自我更新能力的前体耗竭(TPEX)细胞,这对于维持对慢性感染和肿瘤的免疫反应至关重要【6-8】。尽管围绕慢性病毒感染驱动的耗竭特征在肿瘤微环境(TME)中的总体相关性存在争议,但一致认为在这两种情况下,终末耗竭的 CD8 T 细胞都是功能失调的【1-3, 9】。然而,转录网络的复杂性增加(例如,基础亮氨酸拉链 ATF 样转录因子(BATF),干扰素调节因子 4,活化 T 细胞核因子(NFAT))【10-14】,在不同的上下文和表达时间中,已被证明驱动细胞毒性效应或耗竭表型。这表明,用“功能失调”这一术语广泛描述具有经典终末耗竭表型的 CD8 T 细胞可能无法捕捉其功能的细微差别。此外,不同癌症亚型和解剖部位的 TME 组成存在显著差异,特别是在实体和血液恶性肿瘤之间【15, 16】,这可能进一步影响 TEX 的功能。
最近描述的 CD8 T 细胞中“中间”耗竭阶段增加了该领域的复杂性【17】。首先,具有“受限”表型的 CD8 T 细胞在自体免疫中表现出 T 细胞耗竭和效应功能的特征【18】,并且在小鼠肺癌模型中描述了表达颗粒酶 B 的程序性细胞死亡蛋白 1(PD-1+)T 细胞【19】。其次,“过渡性”CD8 T 细胞,表达耗竭标志物,包括 T 细胞免疫球蛋白和粘蛋白域包含蛋白 3(TIM-3)和 TOX,同时维持效应细胞标志物如 CX3CR1 和 T-Box 转录因子(T-BET)的表达,已在癌症和慢性感染模型以及人类免疫检查点阻断反应中被描述【17, 20-22】。第三,在人类循环中的病毒特异性 T 细胞中,描述了表达 TOX 的效应记忆 T 细胞【23】。需要注意的是,这些描述的亚群可能代表耗竭的中间阶段,因为它们保留了多个效应 T 细胞分化的标志物,并且不显示终末耗竭的特征。综上所述,这些数据突出了致力于耗竭途径的 CD8 T 细胞内的异质性。
在本研究中,我们使用小鼠模型表征了血液恶性肿瘤中 CD8 T 细胞的终末耗竭轨迹,这些模型包括自体干细胞移植(ASCT)后复发的骨髓瘤和 CD19 导向嵌合抗原受体(CAR)T 细胞治疗后复发的白血病。这些免疫健全的原位小鼠模型提供了在临床相关治疗后骨髓(BM)TME 中肿瘤 - 免疫细胞相互作用的关键见解。我们使用单细胞多组学测序和确认性流式细胞术,鉴定了小鼠复发骨髓瘤中 BM 中不同的终末 TEX 亚群。一个 TEX 亚群类似于在实体肿瘤和慢性病毒感染中描述的功能失调细胞,效应分子表达减少,而另一个亚群则在进展性疾病的小鼠中表现出 Havcr2 和 Cd28 的共表达以及高水平的干扰素 -γ(IFN-γ)、穿孔素和颗粒酶的表达。尽管具有一致的终末耗竭表型,IFN-γ+ TPHEX 亚群表现出 Batf、Cd28 和 Ly6a 表达增加,并在 Batf 基序结合域中增强了可及性。在小鼠中,肿瘤控制的丧失与骨髓瘤细胞相对于 IFN-γ+ TPHEX 的生长相关,而不是 T 细胞功能失调本身,因为 IFN-γ+ TPHEX 在体外有效杀死骨髓瘤靶标。IFN-γ+ TPHEX 还在 CD19 CAR T 细胞中对 B 细胞急性淋巴细胞白血病(B-ALL)的反应中分化,并在体外杀死 B-ALL 细胞,突显了这些具有终末耗竭表型的 T 细胞保持功能能力的潜力。在骨髓瘤患者的肿瘤浸润淋巴细胞中,与 BATF 表达相关的类似 IFN-γ+ TPHEX 特征,以及 ASCT 后扩展的类似 TIM-3+ CD28+ CX3CR1- CD8 T 细胞特征。
结果¶
骨髓肿瘤微环境中的骨髓瘤产生了不同的 TEX 特征¶
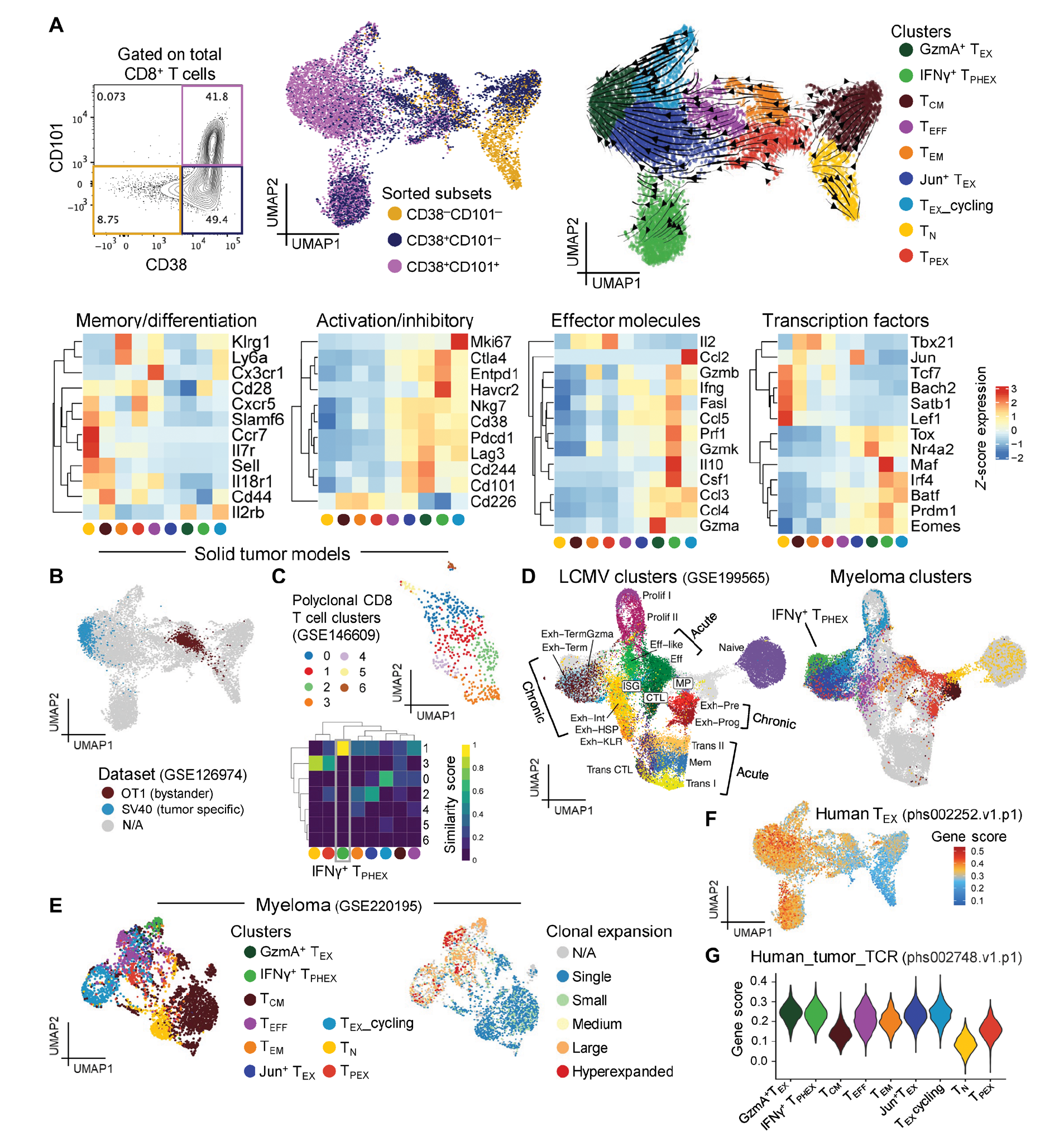
图 1. 骨髓瘤在骨髓中产生了不同的 TEX 特征。(A) 复发骨髓瘤小鼠(n = 4 只小鼠合并)在移植后 7 周从骨髓中分离的 CD8 T 细胞的 RNA 数据的 UMAP 嵌入。细胞按簇着色,RNA 速度矢量描绘了分化轨迹。热图显示各识别簇的平均基因表达。TCM,中心记忆 T 细胞。TEM,效应记忆 T 细胞。N/A,不适用。(B) SV40(耗竭表型)和 OT 1(效应表型)T 细胞整体 RNA 表达数据的伪单细胞投影。(C) Yummer1.7 黑色素瘤模型的多克隆 CD8 T 细胞嵌入图,按簇着色,ViewmastR 热图(行是 Yummer1.7 簇,列是骨髓瘤簇)确定簇 1 类似于 IFN-γ+ TPHEX。(D) (A) 中的 CD8 T 细胞亚群和 LCMV 感染的单细胞 RNA 表达数据的共同嵌入,按簇着色。(E) SCT 后 4 周携带 MM 小鼠骨髓中 CD8 T 细胞的嵌入图,显示使用 ViewmastR 识别的与 (A) 中类似的簇(左)和按 TCR 克隆大小着色(右)。小 = 1 到 5,中 = 6 到 20,大 = 21 到 100,超扩展 = 101 到 500。(F) 来自肾癌数据集的终末耗竭人类 T 细胞的基因评分嵌入图。(G) (A) 中每个簇内人类新抗原特异性 CD8 T 细胞的基因评分的小提琴图。
大多数研究探索了在癌症中 T 细胞耗竭机制,主要是在实体瘤小鼠模型中进行的,这些模型中的肿瘤通常会在干预后普遍复发或消退。在此,我们描述了一种肿瘤模型,在这种模型中,一些小鼠复发,而另一些小鼠在干细胞移植(SCT)后维持长期肿瘤控制。ASCT 是骨髓瘤患者的临床护理标准,并且在我们的 SCT 小鼠模型中得到了真实再现,只有一小部分患者实现长期无进展生存。在我们的模型中,SCT 促进了主要由 CD8 T 细胞介导的多克隆骨髓瘤特异性效应 T 细胞反应【24】。我们使用单细胞 RNA 测序(scRNA-seq)捕捉了 SCT 后 7 周复发骨髓瘤小鼠骨髓中 CD8 T 细胞分化的关键阶段(图 1A)。简而言之,我们根据 CD38 和 CD101 表达将 CD8 T 细胞分为三类群体(CD38−CD101− = 初始;CD38+CD101− = 活化;CD38+CD101+ = 耗竭)【25】,并以调整后的比例重新混合这些细胞(图 1A)。在这个数据集中,我们鉴定了四个 TEX 群体,通过 Tox 的表达和 Tcf7 的丧失来表征,并通过 Mki67、Maf、Ly6a、Havcr2、Cd28 和/或不同的细胞毒性特征区分开来(图 1A 和图 S1A)。RNA 速度分析【26】表明在我们的数据集中从 TPEX 簇到 TEX 簇的共同轨迹(图 1A),这也类似于慢性感染和实体肿瘤中描述的 TEX 分化途径【6-8】。我们在数据集中观察到三个具有终末耗竭特征的细胞簇,可以通过 Ly6a、Cd28 和 Havcr2 的表达来区分(图 S1A)。Cd28 表达簇具有非常高的编码共抑制分子 IFN-γ、穿孔素和颗粒酶 B 的基因表达,此外还有耗竭相关标志物 Tox、Nr4a2、Eomes、Ctla4 和 Entpd1(图 1A),称为 IFN-γ+ TPHEX。第二个簇表达中等水平的 Tox、Nr4a2、Eomes 和 Ifng,并高表达 Jun,称为 Jun+ TEX。在第三个簇中,Ly6a 和 Cd28 的丧失与 Ifng 和 Gzmb 表达减少以及 Gzma 表达增加相关。这个簇称为 GzmA+ TEX。使用用于维度缩减的统一流形近似和投影(UMAP)变换函数,我们发现这些细胞在转录上类似于先前描述的 SV40 特异性 T 细胞的终末耗竭功能失调群体,这些细胞识别表达 SV40 大 T 抗原的实体瘤(图 1B 和图 S1A)【1】。为了与已发表的 TEX 数据集进一步比较,我们使用黑色素瘤模型(Yummer1.7)【27】中的 CD8 T 细胞作为参考数据集,发现一个细胞簇(簇 1)在多项逻辑回归中在转录上类似于 IFN-γ+ TPHEX 细胞(图 1C)。我们接着将我们的数据与小鼠感染淋巴细胞性脉络脑膜炎病毒(LCMV)的数据共同嵌入,包括 Armstrong(急性感染)或 clone 13(慢性感染)(图 1D 和图 S1B)【17】。效应、细胞周期、TPEX 和初始 T 细胞簇在数据集中共同定位,表明这些两个数据集中相似标记细胞的基因表达相似。进一步验证这些发现,我们的模型中共表达 Ly108 和 PD-1 的 TPEX 在我们模型中也是 TOX+ 和 TCF-1+,与已发表的数据一致(图 S1C)【5, 28】。几个过渡和细胞毒性淋巴细胞群体特定于 LCMV 数据集;然而,这些簇主要存在于感染急性 LCMV 的小鼠中,但在我们的骨髓瘤数据集中不存在(图 S1B)【17】。值得注意的是,我们数据集中的 IFN-γ+ TPHEX 簇没有与 LCMV 感染小鼠的任何 T 细胞簇重叠,尽管其他终末 TEX 亚群显示出密切的共同定位(图 1D)。为了确定 IFN-γ+ TPHEX 中特异表达的基因,我们将这个亚群中的差异表达基因与我们数据集中其他 TEX 簇进行比较,生成了 IFN-γ+ TPHEX 特征(图 S2A 和数据文件 S1)。与自然杀伤细胞相关的基因(Klrd1、Klrk1 和 Klre1)在其他 TEX 中差异表达,而 Ccl5、Malat1、Ier3、Maf、Cd28、Id2、Gzmb 和 Havcr2 在 IFN-γ+ TPHEX 中特异富集。这些基因与 T 细胞持久性、淋巴细胞向 TME 的募集和记忆分化相关【29-32】。
我们接下来使用我们先前发表的从携带 Vk*MYC 多发性骨髓瘤(MM)的小鼠在 SCT 后 4 周从骨髓中分离的 CD8 T 细胞的基因表达和 T 细胞受体(TCR)测序数据的参考数据集,探索克隆性并与我们数据中的 TEX 细胞进行比较【33】。使用多项线性回归,我们能够在参考数据集中识别出一个明确的 IFN-γ+ TPHEX 簇(图 1E)。鉴于这些细胞和其他“耗竭”细胞在参考数据集中克隆扩展的程度,以及我们之前的研究表明 SCT 在这个模型中生成了骨髓瘤特异性 T 细胞记忆【24】,我们假设 IFN-γ+ TPHEX 是肿瘤特异性的。进一步支持肿瘤反应性,我们的 IFN-γ+ TPHEX 细胞显示出与人类终末耗竭和肿瘤特异性 T 细胞的基因特征富集(图 1F 和图 1G)【34, 35】。
TIM-3+ CD8 T 细胞具有终末耗竭表型,在体内产生细胞毒性分子和 IFN-γ¶
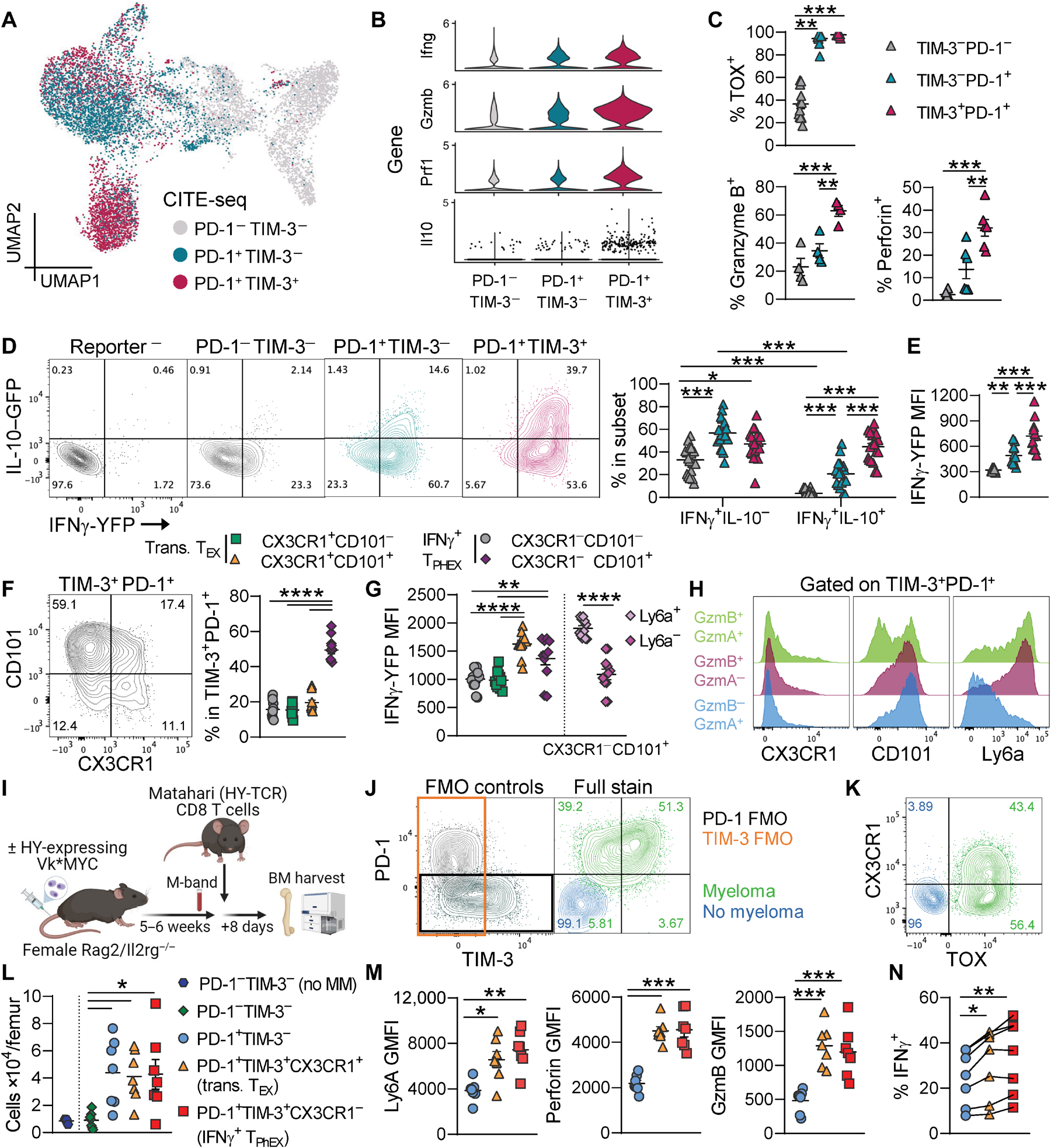
图 2. CX3CR1−TIM-3+ TOX+ CD8 T 细胞在体内产生细胞毒性分子和 IFN-γ。 (A) 图 1 中 RNA 数据的 UMAP 嵌入图。此处,细胞按 TIM-3 和 PD-1 的细胞表面标志物表达(CITE-seq)分类着色。 (B) 小提琴图显示 TIM-3 和 PD-1 亚群中的基因表达。 (C) TIM-3 和 PD-1 亚群在移植后 7 周的骨髓中 TOX(n = 12;克鲁斯卡尔 - 沃利斯检验和 Dunn 检验)、颗粒酶 B(n = 4)和穿孔素(n = 6)的表达。 (D) 各亚群中 IFN-γ 和 IL-10 报告蛋白表达的代表性图(n = 19;双因素方差分析和 Šidák 检验)。 (E) 各亚群中 IFN-γ+ 细胞的 MFI(n = 12)。 (F) 代表性流式细胞术图和 TIM-3+ PD-1+ CD8 T 细胞上 CD101 和 CX3CR1 表达的定量(n = 11)。 (G) CD101 和 CX3CR1 亚群中的 IFN-γ MFI。根据 Ly6a 表达进一步细分 CX3CR1−CD101+ 细胞(n = 11)。IFN-γ+ TPHEX 为 TIM-3+ PD-1+ CX3CR1−。 (H) 直方图显示 TIM-3+ PD-1+ T 细胞上 CX3CR1、CD101 和 Ly6a 的表达,这些 T 细胞分别表达颗粒酶 B 和颗粒酶 A(GzmB+GzmA+)、仅 GzmB 和仅 GzmA(n = 11 拼合)。 (I 到 N) 雌性 Rag2/IL2rg−/− 小鼠为初始状态(无骨髓瘤)或注射表达雄性 HY 抗原的 Vk28158(骨髓瘤)。一旦检测到 M 带,注射 5000 个 MataHari(HY 抗原特异性 TCR 转基因)CD8 T 细胞,8 天后收集骨髓。 (I) 实验设计。 (J) 代表性轮廓图显示 PD-1 和 TIM-3 表达(左侧为 FMO 对照,右侧为全染色)和 (K) 骨髓瘤和无骨髓瘤小鼠中 MataHari CD8 T 细胞的 CX3CR1 和 TOX 表达。 (L) 基于 TIM-3 和 PD-1 表达的 MataHari CD8 T 细胞亚群的总数。 (M) 各亚群中 Ly6a、穿孔素和颗粒酶 B 的 MFI。 GMFI,几何平均荧光强度。 (N) 体外 PMA/离子霉素刺激后 MataHari CD8 T 细胞亚群中 IFN-γ+ 细胞的频率(重复测量单因素方差分析)。数据为均值 ± SEM。每个符号代表一只小鼠。除非另有说明,否则使用单因素方差分析和 Tukey 检验。
基于 IFN-γ+ TPHEX 簇内 Havcr2 的高表达,我们接下来使用细胞转录组和表位索引(CITE-seq)测量的 PD-1 和 TIM-3 表面表达,将 TEX 细胞广泛分成亚群。我们观察到 TIM-3+ PD-1+ 细胞中 Prf1、Gzmb 和 Ifng 的表达增强,相比之下,PD-1+ TIM-3− 细胞中这些基因的表达较低(图 2,A 和 B)。我们通过流式细胞术在蛋白水平上确认了这些发现,发现所有 PD-1+ CD8 T 细胞都表达 TOX,但细胞毒性分子主要存在于 TIM-3+ 亚群中(图 2C)。在我们的模型中识别出的 TIM-3+ 细胞缺乏 Cx3cr1、Ki67 和 Tbx21(T-BET)表达,因此与已描述的增殖过渡细胞和其他中间耗竭亚群不同(图 1A 和图 S1A)【20, 37】。我们的数据集中效应 T 细胞(TEFF)簇可能包括这些过渡细胞,基于“Exh-int”【17】亚群和这里识别的 TEFF 簇之间的重叠(图 1D)。
为了验证细胞因子产生的转录组数据,我们接下来使用三重报告小鼠 [白细胞介素 -10(IL-10)–绿色荧光蛋白(GFP)x IFN-γ–黄色荧光蛋白(YFP)x FoxP3–红色荧光蛋白(RFP)] 来测量细胞因子,而无需体外重新刺激。IFN-γ 报告小鼠【38】使用双顺反子 mRNA,这样荧光蛋白只有在 IFN-γ mRNA 被翻译成蛋白质时才会产生。简要地说,增强型 -YFP 报告盒被插入翻译终止密码子和 3' 非翻译区(3'UTR)/(polyA)多腺苷酸尾之间,使用内部核糖体进入位点(IRES)为基础的载体。使用 IRES 生成双顺反子 mRNA 不会影响上游基因通过 3'UTR 的转录后调控【39】。Reinhardt 等人【40】已经验证了该 IFN-γ 报告小鼠,报告蛋白与 CD4 T 细胞中的 IFN-γ 蛋白产生密切相关。为了确认这些发现,我们显示脾脏和骨髓中的记忆 CD8 T 细胞在 PMA/离子霉素刺激下表现出可比的 IFN-γ–YFP 和 IFN-γ 蛋白表达水平(图 S3,A 和 B)。
在我们的骨髓瘤模型中,大多数 PD-1+ T 细胞表达 IFN-γ–YFP,其中体内产生最多 IFN-γ 的细胞是 TIM-3+ 细胞(图 2,D 和 E,图 S4A)。PMA/离子霉素刺激并未重现这种效果,因为所有亚群同样产生 IFN-γ,这与记忆 T 细胞对多克隆 T 细胞池的广泛刺激的快速反应一致(图 S4B)。一半的 TIM-3+ 细胞在体内也产生 IL-10–GFP(图 2D)。我们随后测量 TIM-3+ PD-1+ T 细胞上的 CD101 和 CX3CR1 表达,以确定这些细胞是否在蛋白水平上表达先前描述的耗竭(CD101)或效应(CX3CR1)标志物(图 2F)【20, 25】。大多数 TIM-3+ PD-1+ 细胞为 CD101+CX3CR1−,确认这些细胞具有终末耗竭而非效应表型。IFN-γ 产生在 IFN-γ+ TPHEX 中同样高于 CX3CR1+ 过渡性 TEX,突显了 IFN-γ+ TPHEX 所产生的 IFN-γ 在生理上是相关的(图 2G)。此外,CX3CR1+ 细胞中预期的 IFN-γ 分泌【20, 21】为我们模型中的 IFN-γ–YFP 信号提供了强有力的内部对照。Ly6A 在蛋白水平上的表达仅识别出最具功能的 TIM-3+ PD-1+ 细胞,这些细胞具有高表达的 IFN-γ 和颗粒酶 B,但不表达颗粒酶 A(图 2,G 和 H)。为了在抗原特异性 T 细胞的骨髓瘤模型中调查这些细胞亚群,我们将 MataHari CD8 T 细胞(HY 特异性 TCR)【41, 42】转移到雌性 Rag2/Il2rg−/− 小鼠中,这些小鼠要么是初始状态,要么注射了表达 HY 抗原的 Vk*MYC 骨髓瘤(Vk58)(图 2I)。MataHari T 细胞在 Vk58 携带小鼠中表达 TIM-3、PD-1、TOX 和 CX3CR1,但在初始小鼠中不表达(图 2,J 和 K)。在肿瘤携带小鼠中扩展了 TEX 细胞,包括 IFN-γ+ TPHEX(PD-1+ TIM-3+ CX3CR1−)和过渡性 TEX(PD-1+ TIM-3+ CX3CR1+),这些细胞与 PD-1+ TIM-3− 细胞相比具有更高的 Ly6A、穿孔素、颗粒酶 B 和 IFN-γ 表达(图 2,L 到 N)。我们还将 MataHari 或野生型(WT)T 细胞注射到携带雌性 VK*MYC 的受体中,以证明骨髓瘤 TME 本身不会独立于肿瘤抗原驱动 PD-1 或 TIM-3 的表达(图 S5A)。在骨髓瘤上缺乏 HY 抗原表达的情况下,MataHari CD8 T 细胞上完全没有 PD-1 和 TIM-3 表达(图 S5B)。总之,这些数据识别出一个 PD-1+ TIM-3+ CX3CR1− T 细胞亚群,IFN-γ+ TPHEX,在 TME 中具有终末耗竭表型,产生 IFN-γ 和细胞毒性分子。
IFN-γ+ TPHEX 细胞在 BATF 基序上的可及性增加¶
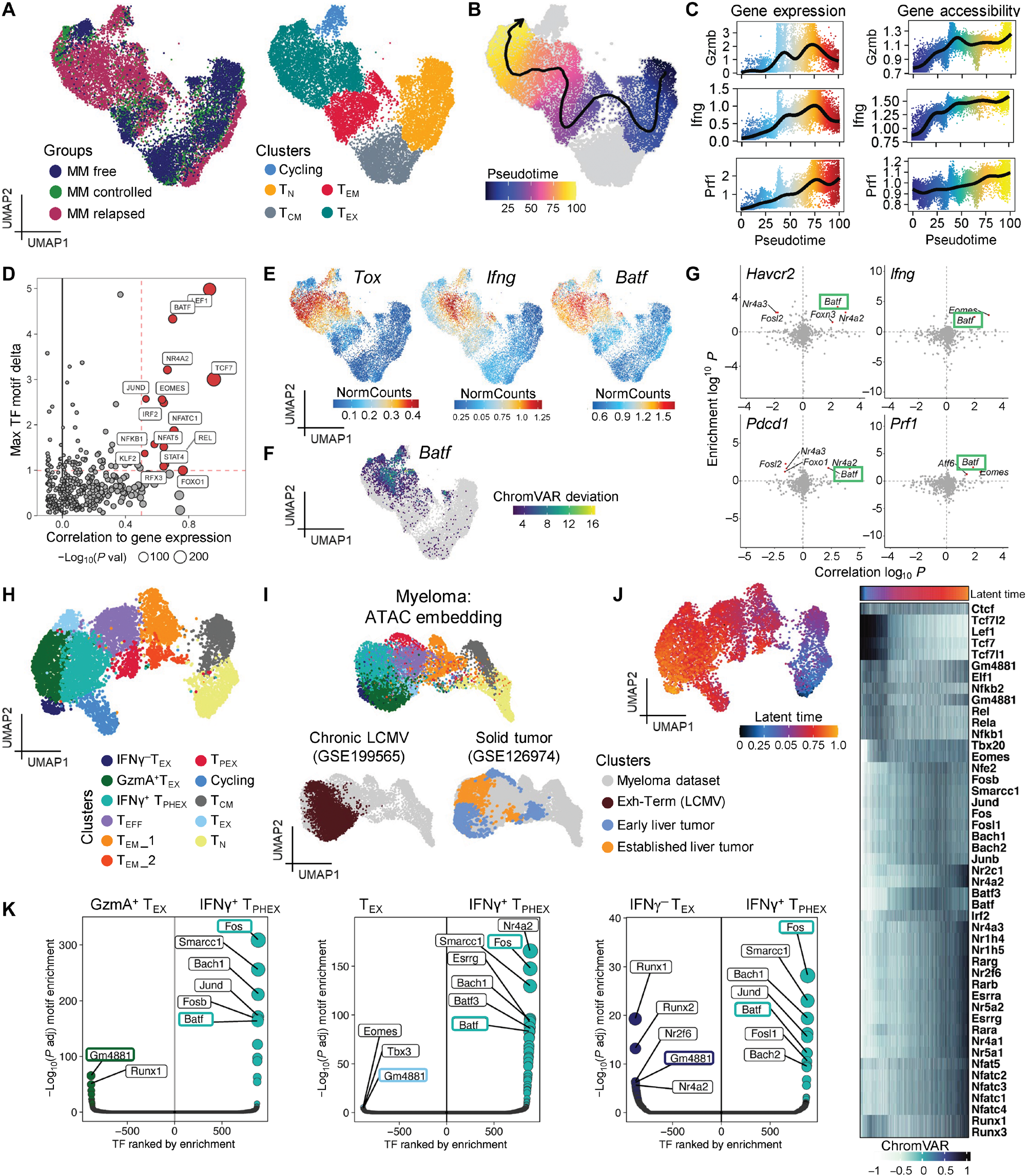
图 3. IFN-γ+ TPHEX 中功能基因的表达与 BATF 基序的可及性相关。小鼠接受了来自基因匹配供体的骨髓和 T 细胞移植。受体要么从未注射肿瘤(MM free),要么在移植后 6 周控制了骨髓瘤(MM controlled)或病情进展(MM relapsed)。收集骨髓用于通过单细胞 RNA 和 ATAC 测序同时分析 CD8 T 细胞。 (A) 加权最近邻(WNN)嵌入,按组别(左)和识别的 CD8 T 细胞簇(右)着色。 (B) WNN 嵌入及从初始(TN)到 TEX 簇的拟时分析。 (C) 功能蛋白在拟时中的基因表达(左)和染色质可及性(右)。 (D) 实验中 TF 基序的基因调控评分。 (E) Batf、Tox 和 Ifng 的基因表达。 (F) 通过 ChromVAR 测量的 Batf 结合域的单细胞可及性。 (G) 推断的 Havcr2、Pdcd1、Ifng 和 Prf1 的激活(右上)和抑制(左上)TFs。 (H) (A) 中 MM 复发小鼠 T 细胞的 WNN 嵌入,按与图 1 中识别的亚群类似的簇着色。 (I) ATAC 嵌入,按骨髓瘤数据集簇(上)和慢性 LCMV(左下)及实体瘤(右下)中的终末耗竭簇着色。 (J) 按潜在时间着色的 WNN 嵌入图及显示跨潜在时间的染色质可及性的热图。 (K) IFN-γ+ TPHEX 与其他 TEX 簇之间 TF 基序的差异可及性。感兴趣的 TFs 在彩色框中突出显示。
为了探究与 T 细胞控制骨髓瘤相关的表观遗传特征,我们对移植小鼠的骨髓中 CD8 T 细胞进行了同步的 RNA 和转座酶可及染色质(ATAC)单细胞测序(multiome)。这些小鼠分为三组:(i) 从未注射骨髓瘤(MM free),(ii) 移植后控制了骨髓瘤(MM controlled),以及 (iii) 移植后 6 周病情进展(MM relapsed)(图 S6A)。首先,我们广泛识别了 T 细胞分化阶段的细胞,以测量这三组中功能基因表达的变化(图 3A)。TEX 细胞表现出 Ifng、Ly6a、Il10 和 Eomes 的表达增加,同时 Tbx21 表达减少(图 S6B)。在 TEX 细胞中,编码 IL-10R 的基因(Il10ra)高表达值得注意,因为最近描述的 IL-10 信号在维持 TME 中 TEX 细胞功能中的作用【43, 44】。接下来,我们使用一种能够关联单细胞中这些事件的算法,将基因表达与染色质可及性变化联系起来【45】。我们发现 TEX 细胞在 Ifng 和 Il10 相关峰中的可及性增加,并伴随基因表达的增加(图 S6C)。先前鉴定的在 TOX+ 细胞中显示 Ifng 位点可及性减少的基因座,在我们的数据集中与 Ifng 基因表达没有高水平相关性(图 S6C)。Ly6a 的表达再次与 Ifng 表达相关(图 S6B)。接下来,我们通过拟时轨迹从初始(TN)细胞到 TEX 细胞,以识别这些转变细胞状态中的转录和表观遗传差异(图 3B 和图 S7A)。在轨迹的早期点,高度表达和可及初始和干细胞样基因(Bach2 和 Lef1)。随后,我们观察到干细胞特性的丧失和终末/耗竭标志物和 TFs(Tox、Pdcd1、Havcr2、Nr4a2 和 Eomes)中染色质可及性的增加(图 S7,A 和 B)。跨拟时轨迹的基序分析还确定了 NFATC1 是我们模型中耗竭的调节因子(图 S7B)。这些数据共同突显了我们数据集中 TEX 细胞具有典型的耗竭表观遗传特征。然而,我们再次观察到在 MM 复发小鼠中发现的 TEX 细胞中编码细胞毒性分子(Prf1 和 Gzmb)和 Ifng 的基因的高表达和可及性,这对应于拟时标尺上的~75(图 3,A 到 C)。
然后,我们将 TF 表达与其在可及 DNA 中的基序富集相关联,以推断数据集中高度使用的 TF。如预期的那样,先前描述的 T 细胞耗竭和干细胞途径的调节因子在数据集中具有高相关性得分:Nr4a2、Eomes 和 Tcf7(图 3D)。这一分析还突显了 Batf 作为一个重要的 TF,展示了与 Tox 和 Ifng 的共表达(图 3E)。此外,具有最高 Ifng 表达的 TEX 细胞在 Batf 基序上的可及性增加(图 3F)。MM-free 和 MM-controlled 小鼠的终末分化细胞位于广泛的 TEX 簇内;然而,这些细胞的 Tox 表达水平较低(图 3E),可能在干细胞移植期间对炎性信号作出响应而分化【46】。这些细胞中存在可及性但没有功能基因(Ifng、Prf1 和 Gzmb)的活跃转录(图 3C)。使用一种能够在单细胞中关联基序富集与目标基因表达的方法【47】,我们鉴定了 Batf 的目标基因,包括在 IFN-γ+ TPHEX 细胞中高表达的基因,如 Pdcd1、Havcr2、Prf1 和 Ifng(图 3G)。这些数据共同表明,骨髓瘤中的 TEX 细胞表现出耗竭表型的标志,并表达 BATF,一个与效应功能相关的 TF【11】。在 BATF 基序上的高可及性可能因此有助于 IFN-γ+ TPHEX 中 IFN-γ 和颗粒酶 B 的持续产生。
接下来,为了在 multiome 数据中具体识别 IFN-γ+ TPHEX 细胞,我们集中分析了 MM 复发数据集的重新嵌入(图 3H)。然后我们使用初始复发队列的 scRNA-seq 数据中的 IFN-γ+ TPHEX 特征来识别一个类似的簇(图 S8A)。在这个数据集中识别的 IFN-γ+ TPHEX 簇也具有高表达的 Havcr2、Ifng、Gzmb、Prf1、Ly6a 和 Batf(图 S8B)。为了再次与其他 TEX 数据集进行比较,我们将慢性 LCMV 和实体瘤模型的 ATAC 数据投射到我们的多组学数据集上。如预期的那样,我们发现我们的 TEX 和 IFN-γ+ TPHEX 簇与这些模型中识别的终末耗竭簇共同定位(图 3I)。接下来,我们进行了无监督潜在时间分析,观察到 CD8 T 细胞从 TPEX 和 TEFF 簇向 TEX 亚群的相似分化(图 3J),这验证了我们的监督拟时轨迹(图 3B)。这也与图 1A 中的 RNA 速度分析一致。在潜在时间内,干细胞基因的可及性减少,而耗竭相关基因的可及性增加(图 3J)。我们接下来比较了复发数据集中 IFN-γ+ TPHEX 和其他 TEX 簇之间的差异可及基序(图 3K)【47】。Batf 和 Fos 在 IFN-γ+ TPHEX 中更具可及性,而 Gm4881 在其他 TEX 簇中更具可及性。这些数据共同表明,虽然 IFN-γ+ TPHEX 表现出与先前描述的实体瘤和慢性 LCMV 感染中的 TEX 大致相似的染色质可及性特征,但它们表达的功能基因与 Batf 结合位点的染色质可及性变化以及 Batf 自身的表达密切相关。
骨髓瘤进展与 IFN-γ+ TPHEX 和 TPEX 与肿瘤负担的比例减少相关¶
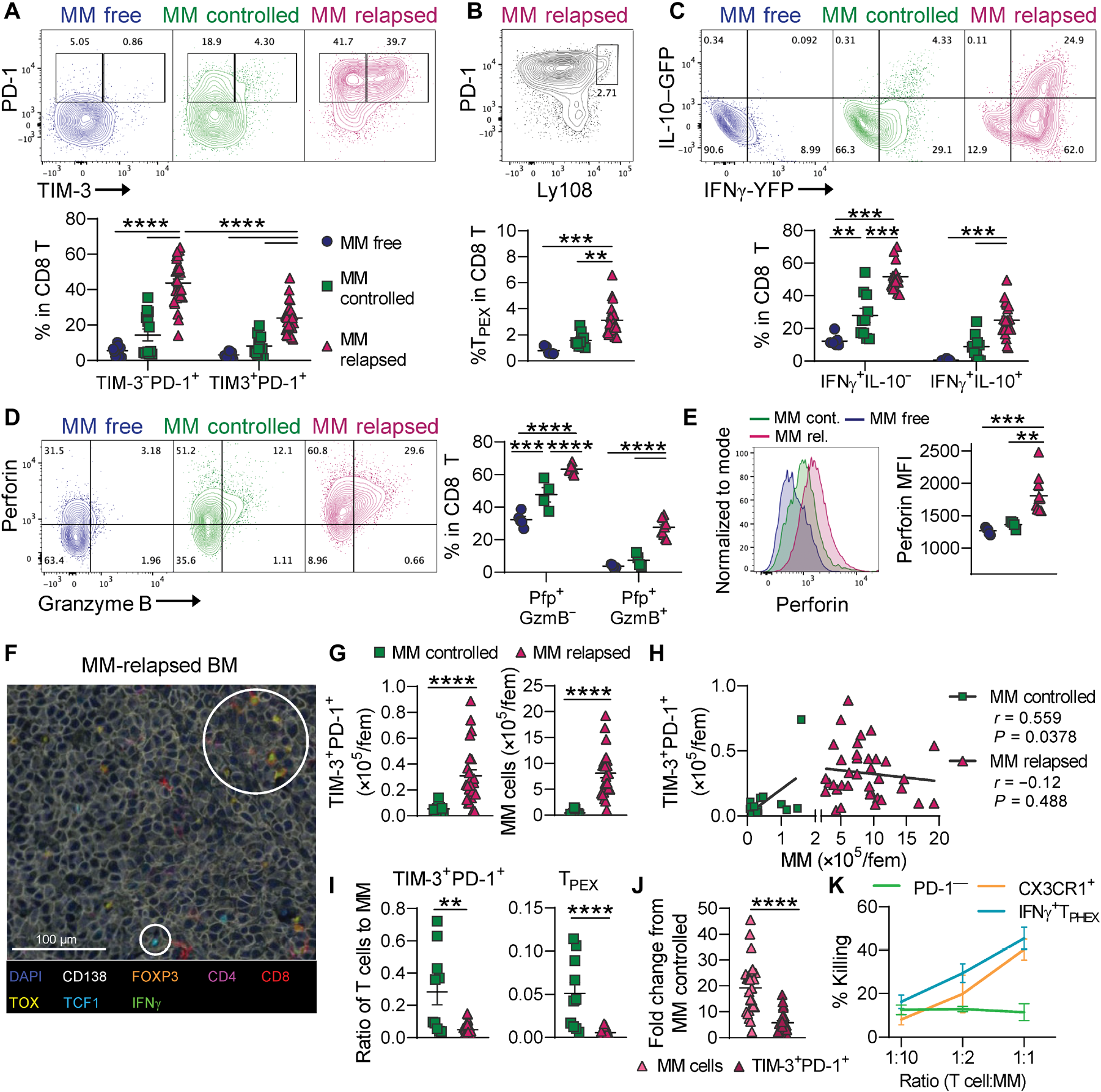
图 4. 骨髓瘤进展与 IFN-γ+ TPHEX 和 TPEX 与骨髓瘤细胞的比例减少相关。接受者 C57Bl/6 x PTPRCA(CD45.1/CD45.2)小鼠移植了 HULK 供体(IFN-γ–YFP x IL-10–GFP x FoxP3-RFP;CD45.2)的移植物。受体要么从未注射肿瘤(MM free),要么在移植后 6 到 7 周控制了骨髓瘤(MM controlled)或病情进展(MM relapsed)。收集骨髓,通过流式细胞术分析 CD8 T 细胞。(A) PD-1+ TIM-3− 和 PD-1+ TIM-3+ 细胞的代表性轮廓图和频率(MM free n = 8;MM controlled n = 10;MM relapsed n = 19)。Kruskal-Wallis 和 Dunn 检验。(B) TPEX(Ly108hi PD-1+)细胞的代表性轮廓图和频率(MM free n = 5;MM controlled n = 9;MM relapsed n = 24)。Kruskal-Wallis 和 Dunn 检验。(C) IFN-γ+ IL-10− 和 IFN-γ+ IL-10+ 细胞的代表性轮廓图和频率(MM free n = 8;MM controlled n = 10;MM relapsed n = 19)。单因素方差分析和 Tukey 检验。(D) Pfp+GzmB− 和 Pfp+ GzmB+ 细胞的代表性轮廓图和频率,以及 (E) 所有 Pfp+ 细胞中穿孔素的直方图和 MFI(MM free n = 5;MM controlled n = 4;MM relapsed n = 11)。单因素方差分析和 Tukey 检验。(F) 在 MM 复发时收集胸骨进行 VECTRA 多光谱成像分析骨髓中的骨髓瘤病灶。白色圆圈突出显示感兴趣的群体,包括 TOX+ 和 TCF1+ CD8 T 细胞。(G) 在控制和复发受体中,TIM-3+ PD-1+ CD8 T 细胞(左)和 MM 细胞(右)的数量定量和 (H) 相关性。Fem,股骨。(I) TIM-3+ PD-1+ 细胞和 TPEX 细胞对骨髓瘤细胞的比例(MM controlled n = 10;MM relapsed n = 24)。Mann-Whitney t 检验和 Pearson r 相关性。(J) 相对于 MM 控制小鼠,MM 复发小鼠中骨髓瘤细胞和 TIM-3+ T 细胞数量的倍增变化。Mann-Whitney t 检验。(K) 分选纯化的 PD-1+ TIM-3+ CX3CR1−(IFN-γ+ TPHEX)、CX3CR1+ 或 PD-1− T 细胞与骨髓瘤细胞共培养 17 小时,然后进行 Annexin V 和 7AAD 染色。通过使用仅骨髓瘤孔的存活基线计算% 杀伤(7AAD+)。误差条来自三个生物重复(PD-1− 来自两个重复),每个生物重复中合并了五只小鼠的数据。数据为均值 ± SEM。每个符号代表一只小鼠。
为了确定尽管存在高功能性 T 细胞亚群,但为什么肿瘤控制仍然丧失,我们在移植后 6 到 7 周通过表型分析 MM-free、MM-controlled 和 MM-relapsed 小鼠的 CD8 T 细胞,探讨 IFN-γ+ TPHEX 与肿瘤负担之间的关系。我们之前已经显示,骨髓瘤复发时 CD8 T 细胞上单一抑制受体的表达增加【48】,在这里我们确认了 PD-1 和 TIM-3 共表达的 T 细胞在 MM 复发小鼠中显著扩展(图 4A)。所有 PD-1+ T 细胞都表达 CD39,这是人类中肿瘤特异性的标志物(图 S9A)【49】。我们观察到,MM 复发小鼠中 TPEX 的频率较 MM 控制和 MM-free 小鼠增加(图 4B)。与我们模型中描述的 TIM-3+ T 细胞的功能一致,IFN-γ、穿孔素和颗粒酶 B 的产生在 MM 复发小鼠中最高,尽管与 MM-free 小鼠相比,MM 控制小鼠产生更多的 IFN-γ 和穿孔素(图 4,C 到 E)。移植后 3 周的非终末骨髓抽吸(BMA)显示,在明确复发之前,小鼠中存在 TIM-3+ 细胞(图 S9B)。MM 控制小鼠中 TIM-3+ T 细胞的细胞因子谱与 MM 复发小鼠中相当(图 S9C 与图 4C)。接下来,为了确认 IFN-γ+ TPHEX 的产生不是移植特定的现象,我们分析了未移植的晚期骨髓瘤三重报告小鼠的骨髓中 CD8 T 细胞(图 S9D)。我们观察到与 SCT 后复发小鼠相比,CD8 T 细胞中 TIM-3+ T 细胞的频率相似,这些细胞也在体内产生 IFN-γ 和 IL-10(图 S9,E 和 F)。这些数据表明 IFN-γ+ TPHEX 细胞是对肿瘤的反应而分化的,这些细胞在骨髓中的存在早于明确的疾病复发。
接下来,我们进行了多光谱成像,以确认 T 细胞浸润了骨髓瘤病灶。在移植后复发的小鼠中,TOX+ 和 TCF1+ CD8 T 细胞在骨髓瘤病灶中稀疏可见(图 4F)。此外,在骨髓瘤病灶中,骨髓瘤细胞数量远多于 T 细胞。由于在骨髓切片中检测细胞核的技术限制,我们使用流式细胞术量化了 MM 控制和 MM 复发小鼠中骨髓瘤细胞和 TIM-3+ T 细胞的总数(图 4G)。接下来,我们将 TIM-3+ T 细胞数量与 MM 细胞数量进行关联,发现仅在 MM 控制小鼠中存在正相关(图 4H)。因此,尽管复发时 TIM-3+ T 细胞的总数增加,但控制骨髓瘤的小鼠中 TIM-3+ 和 TPEX 细胞与骨髓瘤细胞的比例显著更高(图 4I)。与控制疾病的小鼠相比,复发 MM 小鼠中 MM 细胞数量增加约 20 倍,而 TIM-3+ TEX 数量仅增加约 5 倍(图 4J)。此外,MM 复发小鼠中新鲜分离的 IFN-γ+ TPHEX 在体外杀死 Vk*MYC 骨髓瘤细胞的效能与表达 CX3CR1 的效应细胞相当(图 4K 和图 S10,A 和 B)。相比之下,PD-1− 细胞没有抗骨髓瘤活性。这些数据突显了骨髓瘤中免疫控制的丧失不是由于终末分化的 T 细胞功能失调,而是由于 IFN-γ+ TPHEX 的数量不足,这可能部分归因于这些细胞中干细胞样基因的可及染色质的缺乏。
CD11c+ 细胞和 IL-6 信号促进了 IFN-γ+ TPHEX 的分化¶
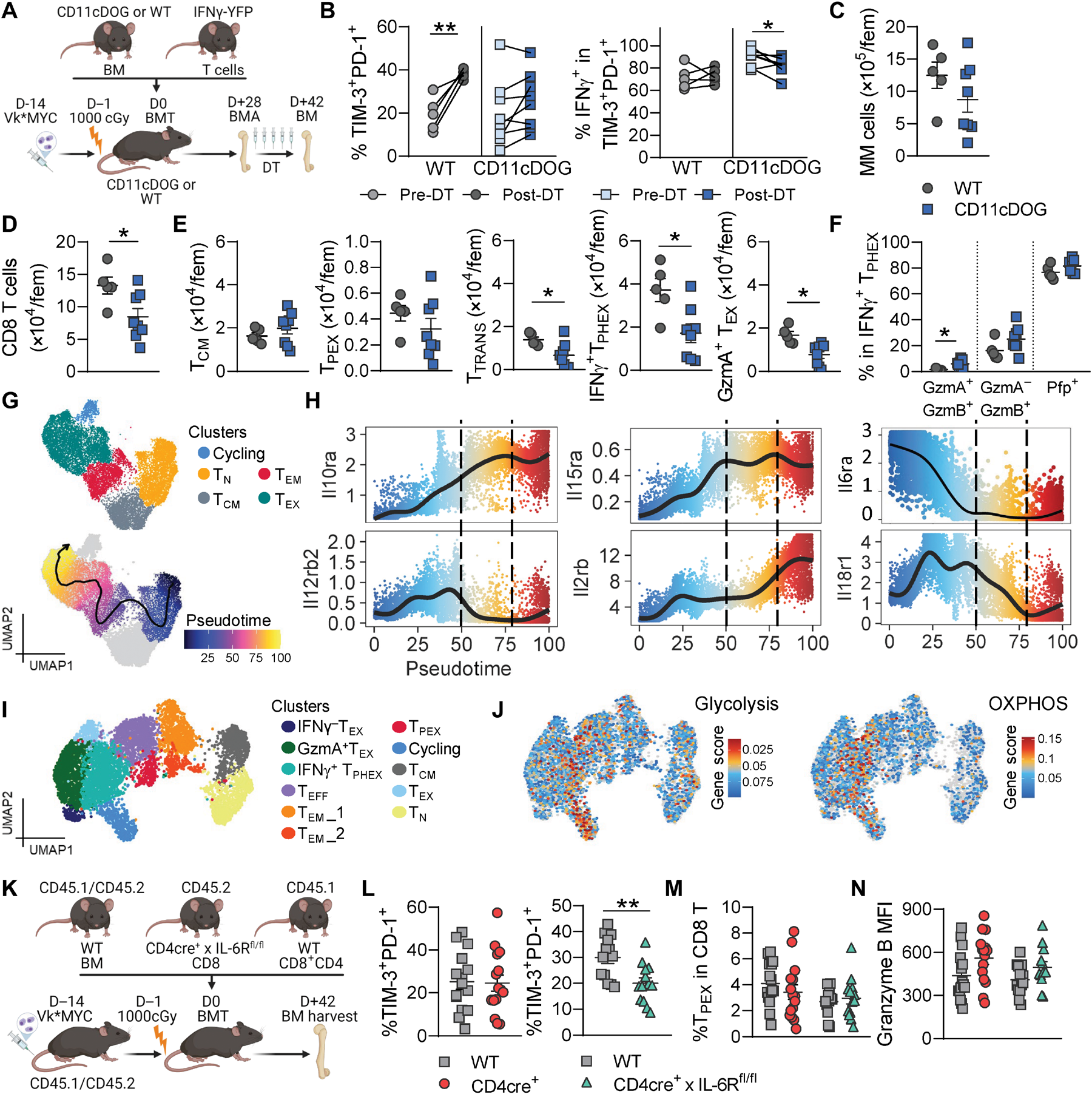
图 5. CD11c+ 细胞和 IL-6 信号在骨髓瘤微环境中促进了 IFN-γ+ TPHEX 的分化。 (A 到 F) 受体 C57Bl/6 或 CD11cDOG 小鼠接受了 B6 或 CD11cDOG 供体骨髓和 IFN-γ–YFP 供体 T 细胞移植。在 DT 治疗前进行骨髓抽吸 (BMA),两周后收集骨髓 (每组 n = 5 到 8)。 (A) 实验设计。 (B) 治疗前 (pre-DT) BMA 和治疗后 (post-DT) 骨髓中 CD8 T 细胞内 PD-1+ TIM-3+ 细胞和 PD-1+ TIM-3+ 细胞内 IFN-γ–YFP+ 细胞的频率。Wilcoxon 检验。 (C) 治疗后股骨中的骨髓瘤细胞 (CD138+CD155+) 总数和 (D) CD8 T 细胞总数。 (E) 治疗后股骨中 TCM (CD44+CD62L+)、TPEX (LY 108hiPD-1+)、过渡性 TEX (PD-1+ TIM-3+ CX3CR1+)、IFN-γ+ TPHEX (PD-1+ TIM-3+ CX3CR1−) 和 GzmA+ TEX (PD-1+ TIM-3− GzmA+) 总数。 (F) IFN-γ+ TPHEX 中颗粒酶 B、颗粒酶 A 和穿孔素 (Pfp) 表达细胞的频率。 (G) 图 3 中重复的多组学数据嵌入 (A 和 B),按簇和拟时轨迹着色。 (H) 拟时中编码细胞因子受体的基因表达。虚线表示在 MM 复发小鼠中找到 TEX 的拟时。 (I) 图 3H 中重复的嵌入,按簇和 (J) Guo 等人 (44) 的糖酵解和 OXPHOS 途径相关基因集富集着色。 (K 到 N) 携带骨髓瘤的 C57Bl/6 x Ptprca (CD45.1/CD45.2) 受体接受了来自 WT (CD45.1) 和转基因 (CD45.2) 小鼠的 CD45.1/CD45.2 骨髓和 CD8 T 细胞移植。转基因小鼠为 CD4cre+ 或 CD4cre+ x IL-6Rfl/fl。CD4 T 细胞来自 WT 小鼠。小鼠被安乐死,并在移植后 7 周收集骨髓 (n = 13 到 15,来自四个实验)。 (L) 相同小鼠中 WT 和 Tg T 细胞内 PD-1+ TIM-3+ 细胞的频率。左图: Tg = CD4cre+,右图: Tg = CD4cre+ x IL-6Rfl/fl。 (M) WT 和 Tg T 细胞内 TPEX 的频率。 (N) PD-1+ TIM-3+ 细胞中颗粒酶 B 的 MFI。Student's t 检验。数据为均值 ± SEM。每个符号代表一只小鼠。
接下来,我们研究了哪些信号有助于 IFN-γ+ TPHEX 在骨髓瘤中的分化和/或功能。首先,使用 CD11cDOG 小鼠评估树突状细胞(DCs)的作用,其中在暴露于白喉毒素(DT)后删除 CD11c 表达的细胞。DT 治疗在 SCT 后 4 周开始,经过 2 周治疗后收集骨髓。使用非致死性骨髓抽吸(BMA),在 DT 注射前记录 IFN-γ+ TPHEX 的频率和功能,以控制不同小鼠肿瘤负担的可能差异(图 5A)。在磷酸盐缓冲液(PBS)处理的小鼠中,CD8 T 细胞中 IFN-γ+ TPHEX 的频率在时间点之间增加(图 5B)。在 DT 处理的小鼠中,进一步的 IFN-γ+ TPHEX 分化被抑制,而 IFN-γ+ TPHEX 中的 IFN-γ 产生仅略微受抑(图 5B)。在治疗结束时,PBS 和 DT 处理小鼠之间的骨髓瘤负担没有差异,这可能是因为在疾病晚期开始治疗(图 5C)。DT 处理的小鼠骨髓中 CD8 T 细胞减少,这是由于所有下游于 TPEX 的 TEX 亚群选择性减少(图 5,D 和 E)。IFN-γ+ TPHEX 中颗粒酶和穿孔素的产生不受 CD11c+ 细胞消耗的影响(图 5F)。这些数据表明 CD11c 表达细胞广泛促进了骨髓瘤 TME 中的 TEX 分化。
接下来,我们探索了细胞因子在促进 IFN-γ+ TPHEX 分化或功能中的潜在作用。我们首先使用我们的多组学数据集,通过拟时分析评估 TEX 分化过程中 IFN-γ 相关细胞因子受体表达的变化(图 5,G 和 H)。在 TEX 分化过程中,Il10ra、Il15ra 和 Il2rb 增加,而 Il12rb、Il6ra 和 Il18r1 减少。我们集中研究了 IL-6 和 IL-10,这些在骨髓瘤微环境中已知失调【50, 51】。在这个模型中,我们之前显示 CD8 T 细胞上 IL-10R 的表达对于 TIM-3+ T 细胞分化不是必需的【48】。鉴于最近描述的 IL-10 信号在增强 TME 中耗竭 CD8 T 细胞代谢中的作用【44】,我们在复发数据集中测量了与糖酵解和氧化磷酸化(OXPHOS)途径相关的基因特征的表达。我们发现 IFN-γ+ TPHEX 和循环簇中这两种特征的富集,与 TEX 细胞中高 Il10r 表达一致(图 5,H 到 J)。因此,尽管 IL-10 信号对于 IFN-γ+ TPHEX 细胞的分化不是必需的,但 IL-10 可能影响这些细胞内的代谢。另一方面,使用 CD4cre+ x IL-6Rfl/fl 小鼠删除 IL-6R 导致 CD8 T 细胞中 IFN-γ+ TPHEX 细胞频率的减少,特别是在 IL-6R 敲除转基因 T 细胞中,而在同一动物的配对 WT T 细胞中则没有(图 5,K 和 L)。TPEX 频率和 IFN-γ+ TPHEX 中的颗粒酶 B 产生未受影响(图 5,M 和 N)。这些数据共同提供了关于在骨髓瘤微环境中驱动 IFN-γ+ TPHEX 分化的细胞因子的额外见解。
CD19 靶向的 CAR T 细胞具有 IFN-γ+ TPHEX 表型,在骨髓中是功能性的¶
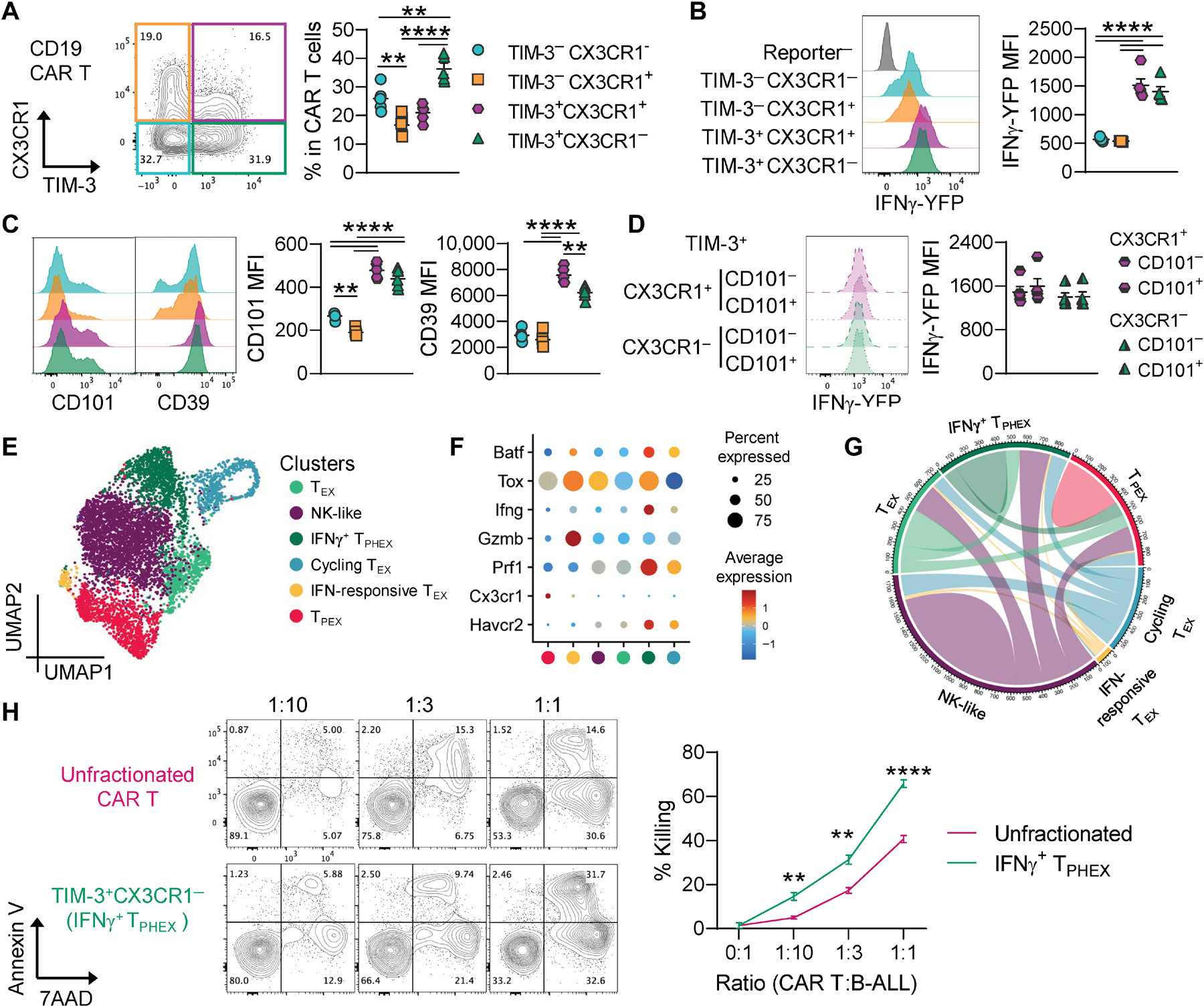
图 6. 具有 IFN-γ+ TPHEX 表型的 CD19 CAR T 细胞有效杀死白血病细胞。携带 CD19+ B-ALL 的小鼠注射了鼠源 CD19 CAR T 细胞(HULK;B6 背景)。初次转移后 25 天收集骨髓中的 CAR T 细胞,并过继转移到二次 B-ALL 携带的受体中。19 天后收集骨髓 CAR T 细胞(人 eGFR+)并进行分析。(A) CX3CR1 和 TIM-3 表达的代表性图和 CAR T 细胞亚群的定量。(B) IFN-γ-YFP 表达的直方图(以报告基因阴性的内源性细胞为对照)和 CAR T 细胞亚群中 MFI 的定量。(C) CD101 和 CD39 表达的直方图和 CAR T 细胞亚群中 MFI 的定量。(D) 按 CX3CR1 表达(有/无 CD101 共表达)分割的 TIM-3+ 细胞中 IFN-γ-YFP 表达的直方图和定量。(A 到 D) 数据为均值 ±SEM。每个符号代表一只小鼠(n = 5)。单因素方差分析和 Tukey 检验。(E 到 G) 对 CD8 CAR T 细胞进行了 5' RNA 测序。(E) 按簇着色的 UMAP 嵌入。(F) 显示每个簇内基因表达的点图。(G) 簇之间克隆重叠的图。(H) 分选纯化的 TIM-3+ CX3CR1− CAR T 细胞或未分离的 CAR T 细胞,从五个生物重复中合并,并与 B-ALL 细胞共培养 18 小时,然后进行 Annexin V 和 7AAD 染色。Annexin V 和 7AAD 染色在效应: 靶目标比率上的代表性图。使用仅 B-ALL 孔的存活基线(>90%)计算% 杀伤。数据为均值 ±SEM,误差条来自技术重复(每个条件 n = 3 到 5)。Student's t 检验。
为了确认终末分化细胞在另一模型中可以展示耗竭和效应功能的特征,我们分析了复发 B-ALL 小鼠中的 CD19 CAR T 细胞。在 CAR T 细胞转移后 9 天,大多数 CD8 CAR T 细胞为 CX3CR1+CD39+PD-1+;然而,一部分 CAR T 细胞具有 TEX 表型,为 CX3CR1−CD39+PD-1+TIM-3+(图 S11A)。这些 TEX 细胞不表达 Ly108,高水平表达 Ly6a,并产生与 CX3CR1+ 对应细胞相同量的 IFN-γ(图 S11,B 和 C)。此外,与骨髓瘤小鼠的多克隆 T 细胞类似,TIM-3+ CD19 CAR T 细胞中 IFN-γ、穿孔素和颗粒酶 B 的表达更高(图 S11,C 到 F)。所有 CAR T 细胞在转移后 9 天均为 TOX+(图 S11E)。为了增加 CAR T 细胞池中终末耗竭 CAR T 细胞的频率,我们进行了 CD19 CAR T 细胞的二次过继转移,这些 CAR T 细胞来自初次 CAR T 细胞转移后 25 天的 B-ALL 控制小鼠的骨髓(图 S12A)。从初次受体的骨髓中分离的 CAR T 细胞大多数为 CD44+CD62L−,并且 CD39 表达较高,但仍保持 IFN-γ 分泌(图 S12,B 和 C)。二次转移后,TIM-3+ CX3CR1− 亚群在转移后 19 天内占据骨髓中 CD19 CAR T 细胞的 35% 以上(图 6A)。TIM-3+ CX3CR1− T 细胞产生更多的 IFN-γ,并相对于 TIM-3− 亚群具有更高的 CD101、CD39 和 PD-1 平均荧光强度(MFI);所有亚群均高表达 Ly6a(图 6,B 和 C,图 S12D)。CD101 表达不会影响 TIM-3+ 细胞(无论是 CX3CR1− 还是 CX3CR1+)中的 IFN-γ 分泌,可能是因为在该模型中所有亚群中均保持高水平的 Ly6a 表达(图 6D)。scRNA-seq 揭示了 CD19 CAR T 细胞内的六个簇,包括一个表达 Havcr2、Prf1、Ifng、Tox 和 Batf 的 IFN-γ+ TPHEX 簇(图 6,E 和 F)。我们使用 5' TCR 测序评估各簇之间克隆型的重叠,发现 TPEX 与所有 TEX 簇,包括 IFN-γ+ TPHEX 簇之间共享克隆型(图 6G)。该数据集中的所有簇之间都有克隆型重叠,这与 CD19 CAR T 细胞在响应 CD19 CAR 信号时通过多个 T 细胞耗竭阶段分化一致。分选纯化的 TIM-3+ CX3CR1−(IFN-γ+ TPHEX)CAR T 细胞在体外杀伤试验中有效杀死 B-ALL 靶细胞(图 6H)。此外,与未分馏的 CAR T 细胞相比,IFN-γ+ TPHEX CAR T 细胞在所有测试的效应: 靶目标比例下杀死了更多的 B-ALL 细胞(图 6H)。这些数据共同表明,IFN-γ+ TPHEX 是 CD19 CAR T 细胞的一个功能性亚群,能够有效杀死白血病细胞。
IFN-γ+ TPHEX 在患者中发现并在 ASCT 后扩展¶
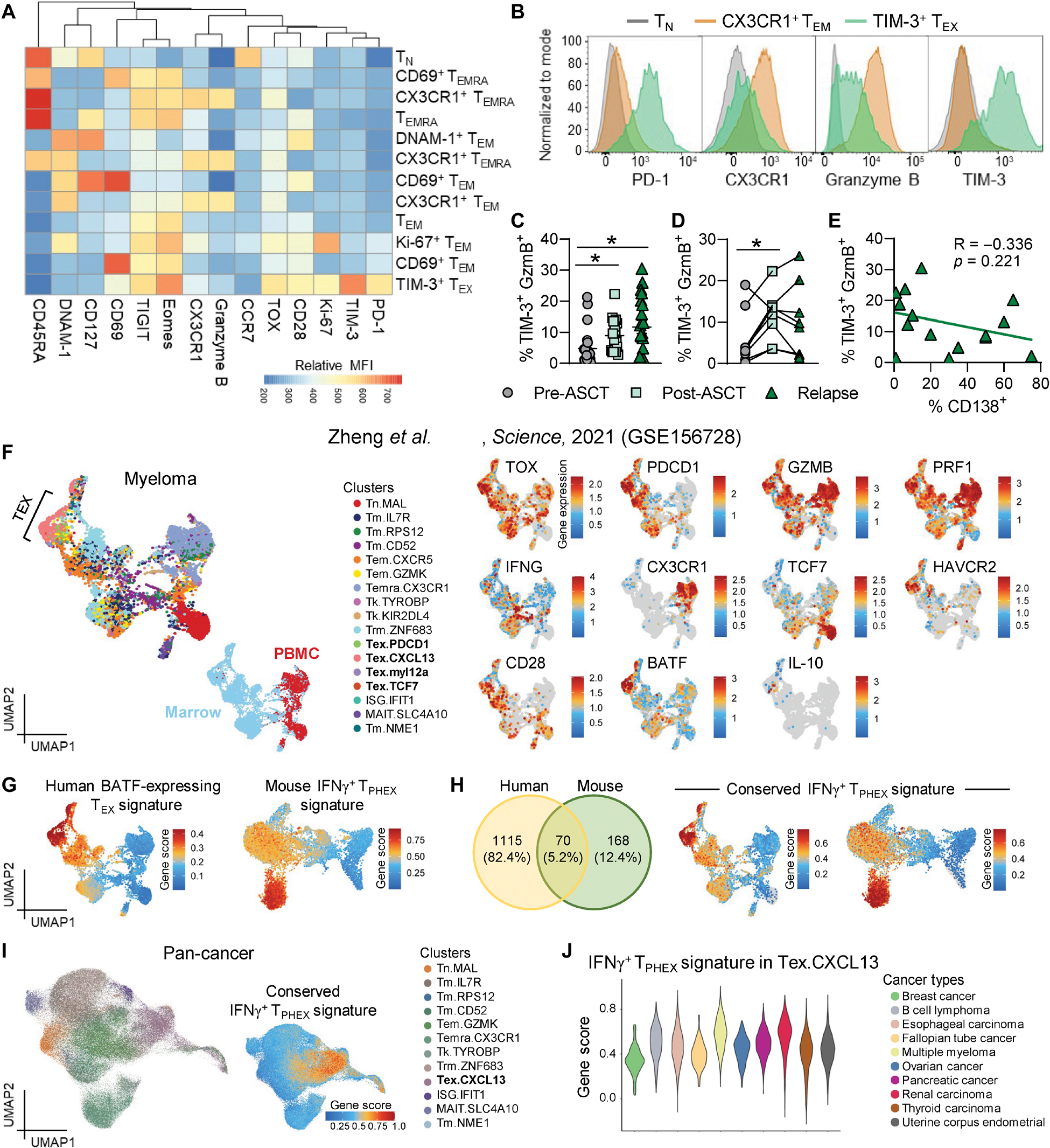
图 7. 在多发性骨髓瘤患者中发现 IFN-γ+ TPHEX 并在 ASCT 后扩展。(A 到 E) 从患者中提取的骨髓样本,时间点包括 ASCT 前(pre-ASCT)、ASCT 后(post-ASCT)和 ASCT 后疾病复发时,解冻并染色后通过流式细胞术分析(n = 17 到 23)。数据表示均值 ±SEM。*P < 0.05。(A) FlowSOM CD8 T 细胞群体中标志物表达(MFI)的热图。(B) 初始 T 细胞(灰色)、CX3CR1+效应细胞(橙色)和 TIM-3+ TEX 细胞(绿色)中 PD-1、CX3CR1、颗粒酶 B 和 TIM-3 表达的代表性直方图。(C) 在三个队列中 CD8 T 细胞内 TIM-3+ GzmB+细胞的频率(Kruskal-Wallis 检验和 Dunn 多重比较检验)以及(D) 来自(C)中在所有时间点均有配对样本的患者(n = 8;Friedman 检验和 Dunn 多重比较检验)中的频率。(E) 在(C)中复发骨髓瘤患者(n = 15)中 CD8 T 细胞内 TIM-3+ GzmB+细胞的频率与形态学上 CD138+细胞百分比的相关性。(F) 左:Zheng 等人【53】的多发性骨髓瘤患者 CD8 T 细胞的 UMAP 嵌入图。顶部嵌入图按簇着色,底部嵌入图按 T 细胞位置着色(肿瘤=蓝色,外周血=红色)。右:按基因表达着色的嵌入图。(G) 按人类中 BATF 表达的 TEX 相关基因特征(左)和我们数据集中图 1 中的小鼠 IFN-γ+ TPHEX 特征(右)着色的 UMAP 嵌入图。(H) 表示人类和小鼠基因特征之间共享基因数目的维恩图,形成了一个保守的 IFN-γ+ TPHEX 特征,并按该特征着色的人类(左)和小鼠(右)骨髓瘤数据集的嵌入图。(I) Zheng 等人【53】的泛癌症数据集中 CD8 T 细胞的嵌入图,按簇(左)和保守的 IFN-γ+ TPHEX 特征表达(右)着色。(J) 在 Tex.CXCL13 簇中按癌症类型分层的 IFN-γ+ TPHEX 特征基因评分的小提琴图。PBMC,外周血单个核细胞。
为了确定是否在患者中发现 IFN-γ+ TPHEX,我们分析了来自两个中心骨髓瘤患者的骨髓样本,时间点包括:(i) ASCT 前(n = 23),(ii) ASCT 后(n = 17),以及 (iii) 病情进展时(n = 20)(图 7A)。使用流式细胞术和 FlowSOM 进行无偏细胞聚类,鉴定出类似于小鼠 IFN-γ+ TPHEX 表型的人群,其中 TIM-3+ CD8 T 细胞表达 PD-1、TOX、CD28 和中等水平的颗粒酶 B,但不表达 CX3CR1(图 7,A 和 B)。由于没有报告基因或已知的骨髓瘤抗原进行重新刺激,我们无法通过流式细胞术验证该亚群中的 IFN-γ 产生。与 ASCT 前样本相比,该亚群在 ASCT 后和骨髓瘤复发时扩展(图 7C)。集中分析每个时间点都有配对样本的患者(n = 8),发现 ASCT 后 TIM-3+ GzmB+ 细胞的频率增加,但在疾病复发时不再进一步增加(图 7D)。与我们的鼠模型相似,TIM-3+ GzmB+ 细胞的频率与复发时的骨髓瘤负担不相关(图 7E)。
为了使我们的发现具有更多的临床相关性,我们调查了来自公开的泛癌症数据集的 scRNA-seq 数据,其中包括骨髓瘤患者【53】。首先,在骨髓瘤患者的骨髓中,我们发现 Tex.CXCL13 簇中的 TOX、HAVCR2、GZMB、IFNG、PRF1 和 CD28 的表达与 BATF 的高表达相关(图 7F)。接下来,为了生成一个人类基因特征,我们查看了 BATF 表达的 TEX 细胞中差异表达的基因(图 7G 和数据文件 S2)。然后,我们将这个特征与我们小鼠 IFN-γ+ TPHEX 簇中差异表达的基因列表进行比较,生成了一个包含 70 个基因的“保守 IFN-γ+ TPHEX 特征”,涵盖小鼠和人类骨髓瘤(图 7H 和数据文件 S3)。最后,我们将保守的 IFN-γ+ TPHEX 特征应用于泛癌症数据集【53】,发现基因评分最高的细胞主要位于 Tex.CXCL13 簇中(图 7I 和图 S13)。当我们在不同癌症类型中量化该簇中保守 IFN-γ+ TPHEX 特征的表达时,我们发现骨髓瘤、肾癌和 B 细胞淋巴瘤中 IFN-γ+ TPHEX 相关基因的表达最高(图 7J)。这些数据共同表明,IFN-γ+ TPHEX 是一种临床相关的 TEX 表型,存在于广泛的人类癌症中,并在骨髓瘤的 ASCT 后扩展。