The aged tumor microenvironment limits T cell control of cancer
摘要¶
癌症中的年龄相关免疫功能障碍的病因和影响尚不完全清楚。本文表明,老化肿瘤微环境(TME)中有限的 CD8+ T 细胞激活,超出了细胞本身缺陷对肿瘤控制的限制。在老化过程中,肿瘤生长增加与 CD8+ T 细胞浸润和功能的减少有关。年轻小鼠的 T 细胞转移到老年小鼠中,由于 T 细胞功能障碍的迅速诱导,无法恢复肿瘤控制。老化 TME 中的细胞外信号驱动了一种肿瘤浸润的年龄相关功能障碍(TTAD)细胞状态,其在功能、转录和表观遗传学上与经典的 T 细胞耗竭不同。老化肿瘤中天然杀伤细胞(NK 细胞)- 树突状细胞(DC)-CD8+ T 细胞的交叉通话改变,导致常规 1 型树突状细胞(cDC1s)的 T 细胞激活受损,并促进 TTAD 细胞的形成。因此,老年小鼠无法从治疗性肿瘤疫苗中受益。关键是,针对髓系细胞的治疗可以重新激活 cDC1s,提高肿瘤控制,并恢复老年中的 CD8+ T 细胞免疫。
引言¶
衰老是癌症发展的最大风险因素之一。老年人群癌症发病率的增加与免疫功能的逐渐下降平行,包括 CD8+ T 细胞群体的下降。尽管 CD8+ T 细胞对于有效的抗肿瘤免疫至关重要,但与年龄相关的 T 细胞失调对肿瘤控制和免疫治疗结果的影响仍然知之甚少。
衰老通过多种机制促进癌症进展,包括细胞损伤积累、系统性炎症增加和适应性免疫减弱。与年龄相关的 T 细胞缺陷包括初始 T 细胞库减少、端粒磨损、DNA 损伤积累和促炎特征增加。然而,这些变化在多大程度上相对于与年龄无关的机制(如 T 细胞耗竭的发展)导致老年肿瘤中 CD8+ T 细胞反应受损尚不清楚。
CD8+ T 细胞的耗竭主要是由于持续刺激,表现为多种功能缺陷,包括效应细胞因子产生的丧失和细胞毒性减少。先前的研究表明,CD8+ T 细胞耗竭是一种在许多肿瘤中诱导的基本功能障碍状态,不能通过常见的治疗干预逆转。不幸的是,先前的研究主要限于健康供体中的衰老效应,或仅关注年轻小鼠中 TME 的影响。因此,衰老相关的 CD8+ T 细胞功能障碍与慢性刺激驱动的 CD8+ T 细胞耗竭在老化 TME 中的相对重要性仍不清楚。
结果¶
衰老促进肿瘤生长并改变 CD8+ T 细胞的命运和效应功能
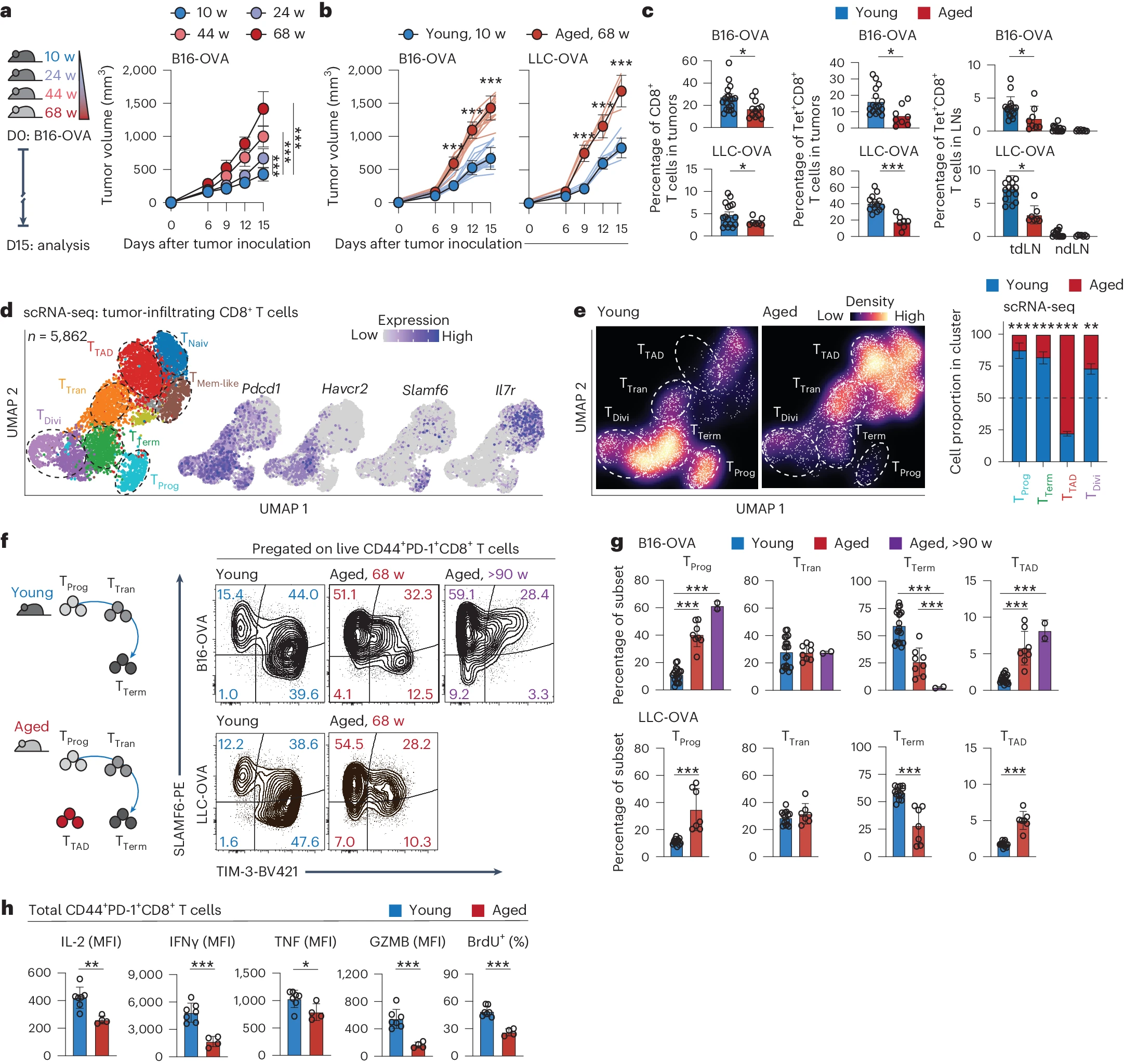
a. B16-OVA 黑色素瘤模型实验设计示意图,用于评估不同年龄小鼠中的肿瘤生长;D0,实验第 0 天;D15,实验第 15 天。
b. 年轻(10 周龄;蓝色;n=17 和 n=8)和老年(68 周龄;红色;n=12 和 n=4)小鼠中 B16-OVA 和 LLC-OVA 肿瘤的生长曲线。
c. 从年轻(10 周龄;蓝色;n=20)和老年(68 周龄;红色;n=12)小鼠的 B16-OVA 和 LLC-OVA 肿瘤、肿瘤引流淋巴结(tdLNs)和非引流淋巴结(ndLN)中分离的第 15 天总肿瘤浸润 CD8+ T 细胞以及四聚体特异性(Tet+)CD8+ T 细胞的百分比。
d. 统一流形近似与投影(UMAP)展示的单细胞 RNA 测序(scRNA-seq)图谱,来自携带 B16-OVA 肿瘤的年轻和老年小鼠第 15 天的 5,862 个活体肿瘤浸润 CD8+ T 细胞,按簇着色。右侧显示指示基因的表达图谱(灰色为低表达;紫色为高表达)。 e. UMAP 空间中的星系图,展示了年轻(左)和老年(右)肿瘤小鼠肿瘤浸润 CD8+ T 细胞的细胞密度。颜色越冷表示密度越低,颜色越暖表示密度越高。图中显示了年轻(蓝色,n=5)和老年(红色,n=5)肿瘤中 TProg、TTerm、分裂 T 细胞(TDivi)和 TTAD 细胞群的相对比例。
f. 分析了携带 B16-OVA 或 LLC-OVA 肿瘤 15 天的小鼠中耗竭亚群的代表性流式细胞图。小鼠分别为 10 周龄(年轻;蓝色;n=19),68 周龄(老年;红色;n=8)和超过 90 周龄(老年;紫色;n=2 组;每组包含 3 只小鼠)。
g. 基于 TIM-3 和 SLAMF6 表达的活体抗原经验(CD44+PD-1+)CD8+ T 细胞内 TProg、TTerm、TDivi 和 TTAD 细胞亚群的定量。
h. 从年轻(蓝色;n=16)和老年(红色;n=10)肿瘤小鼠的活体抗原经验(CD44+PD-1+)肿瘤浸润 CD8+ T 细胞中测量 IL-2、IFNγ、TNF、GZMB 和 BrdU 的几何平均荧光强度(MFI)。对于 b、c 和 f-h,数据代表了至少两次独立实验的总结,并以平均值±标准差(s.d.)的形式展示。
衰老是一个累积过程,对于年龄相关免疫功能障碍的确切开始时间没有共识。因此,我们首先在小鼠中描绘了 T 细胞衰老的已知特征,如初始 T 细胞相对减少和 PD-1+TIM-3+CD8+ T 细胞随时间增加。这些表型变化在小鼠中 65 至 75 周之间急剧增加,相当于 50 至 58 岁的人类。值得注意的是,这大约相当于人类癌症诊断的中位年龄。因此,我们在年龄在 10 至 68 周之间的 C57BL/6J 小鼠中植入 1×10^6 表达卵白蛋白(OVA)的 B16 黑色素瘤(B16-OVA)细胞。随着年龄的增加,肿瘤生长显著增加。接下来,我们将 B16-OVA 黑色素瘤细胞或表达 OVA 的 Lewis 肺癌(LLC-OVA)细胞植入年轻(10-12 周)和老年(68-70 周)小鼠。在接种后的 12-15 天内,老年组中的肿瘤生长更快,并且伴随着肿瘤浸润的 CD8+ T 细胞数量减少。我们还观察到老年小鼠中肿瘤和肿瘤引流淋巴结(tdLN)中的 OVA 特异性 CD8+ T 细胞数量减少。
为了定义肿瘤浸润的 CD8+ T 细胞内的异质性,我们接下来对来自年轻和老年肿瘤的 5000 多个 CD8+ T 细胞进行了单细胞 RNA 测序(scRNA-seq),并使用细胞哈希技术区分生物学重复样本。如先前所示,肿瘤内的耗竭 CD8+ T 细胞均匀地表达 Pdcd1(PD-1)和转录因子 Tox。在这一群体中,我们恢复了预期的亚群,包括由 Tcf7(Tcf1)/Slamf6 标记的前体样耗竭 CD8+ T 细胞(TProg),以及由 Havcr2(TIM-3)/Entpd1(CD39)标记的终末耗竭 T 细胞(TTerm)。然而,老年 TME 内的两种耗竭 T 细胞亚群在数量上显著减少,而未分化的 T 细胞状态(包括初始样(TNaiv)、记忆样(TMem-like)和过渡性(TTran)CD8+ T 细胞)增加。我们还在老年肿瘤中识别出一个独特的 PD-1+Tox+IL-7R+CD8+ T 细胞群,这些细胞不表达 Tcf7、Slamf6 或 Havcr2。据我们所知,这种细胞状态以前没有被描述过,我们假设这可能是一种特有的肿瘤浸润和年龄相关功能障碍(TTAD)的 CD8+ T 细胞亚群。
我们使用流式细胞术验证了我们的 scRNA-seq 发现,并能够轻松识别 TProg 细胞(SLAMF6+TIM-3–)、TTran 细胞(SLAMF6+TIM-3+)、TTerm 细胞(SLAMF6–TIM-3+)和新定义的 TTAD 细胞(SLAMF6–TIM-3–)。老年 TME 促进了 B16-OVA 黑色素瘤和 LLC-OVA 肺癌模型中的 TTAD 细胞形成,包括老年 TME 中的 OVA 特异性 CD8+ T 细胞。我们注意到 TTerm 细胞的频率下降,这在 90 周龄的小鼠群体中进一步加剧。
为了评估衰老是否也影响肿瘤浸润 CD8+ T 细胞反应的效应能力,我们使用体外再刺激实验来测量效应细胞因子的产生。我们的数据表明,老年肿瘤浸润 CD8+ T 细胞中干扰素 -γ(IFNγ)、肿瘤坏死因子(TNF)和白细胞介素 -2(IL-2)的产生显著减少。接下来,我们通过体外测量颗粒酶 B(GZMB)的表达来评估细胞毒性潜力,发现老年肿瘤中所有活化的 CD8+ T 细胞亚群中 GZMB 表达减少。最后,我们通过测量 BrdU 掺入来定义肿瘤浸润 T 细胞的体内增殖能力。老年肿瘤中 BrdU+ 分裂的 CD8+ T 细胞频率较低。值得注意的是,在多个 CD8+ T 细胞亚群中都可以观察到与年龄相关的功能缺陷。综合来看,这些数据表明,衰老会损害肿瘤控制,并广泛改变 CD8+ T 细胞的命运和功能。
衰老中的 T 细胞固有缺陷导致终末分化
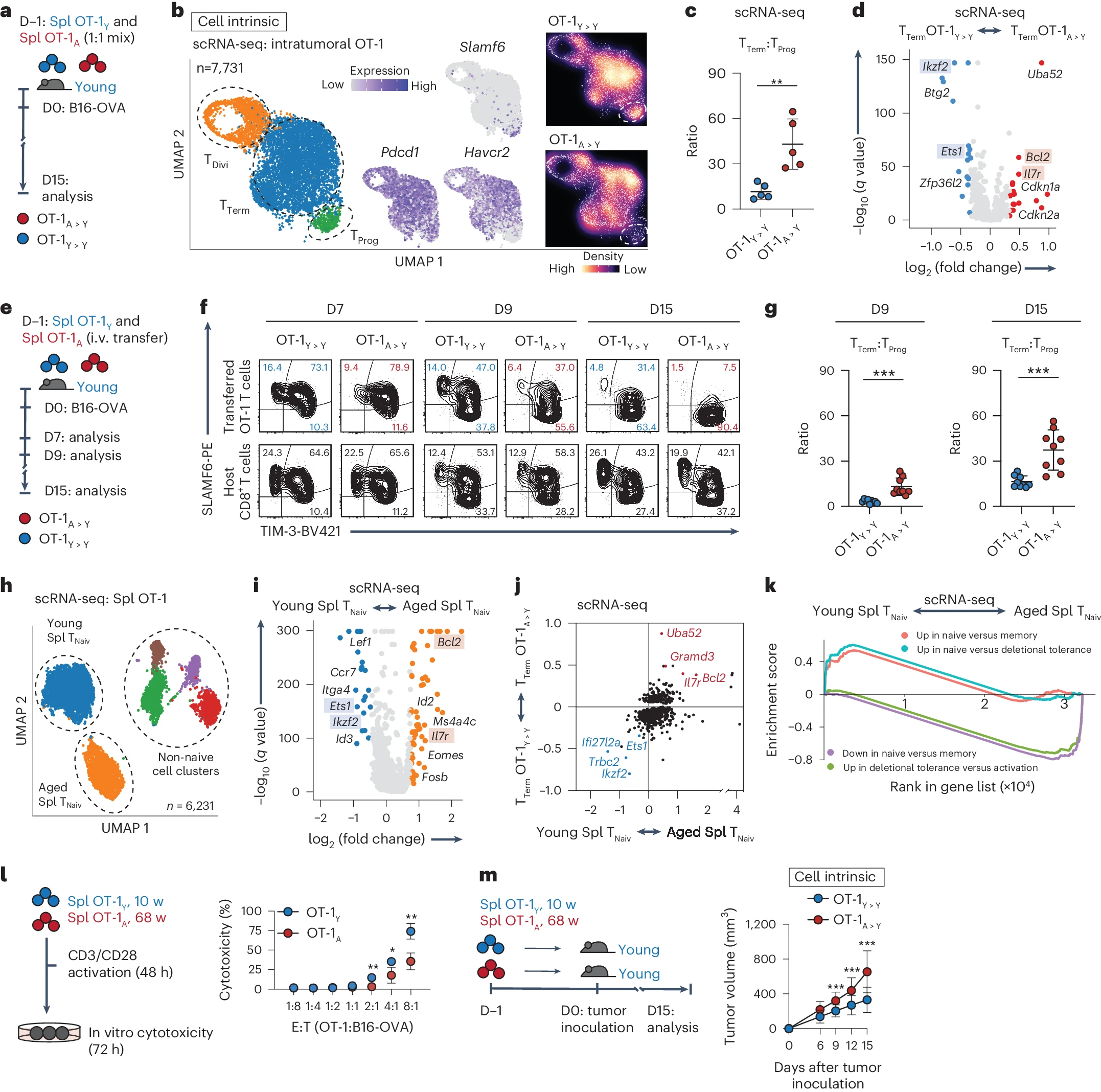
a, 体内共转移实验示意图(a)和 scRNA-seq UMAP(b,左),显示了来自第 15 天携带 B16-OVA 肿瘤的年轻小鼠的 7,731 个活体肿瘤浸润 OT-1 CD8+ T 细胞,按簇着色。指示基因的表达(灰色表示低表达;紫色表示高表达)。UMAP 空间中的密度图(b,右),显示了转移到年轻小鼠中的年轻 T 细胞(OT-1Y>Y,顶部)和转移到年轻小鼠中的老年 T 细胞(OT-1A>Y,底部)。颜色越冷表示密度越低,颜色越暖表示密度越高。
c, 在 scRNA-seq 数据中,OT-1Y>Y 和 OT-1A>Y T 细胞之间的 TTerm 细胞与 TProg 细胞的比例。
d, 在 TTerm OT-1Y>Y 和 OT-1A>Y 细胞之间差异表达基因的火山图。
e, 体内转移试验示意图,用于研究 TProg 的形成和维持,在指定的时间点进行;i.v.表示静脉注射。
f, 在指定日期内,OT-1Y>Y(蓝色)和 OT-1A>Y(红色)T 细胞亚群比例的代表性流式细胞图。
g, 在指定日期内,OT-1Y>Y 和 OT-1A>Y T 细胞之间 TTerm 细胞与 TProg 细胞的比例(n=9)。
h, scRNA-seq UMAP 投影,显示来自年轻(10 周龄;蓝色;n=5)和老年(68 周龄;红色;n=5)小鼠脾脏(Spl)的 6,231 个活体 OT-1 CD8+ TNaiv 细胞,按簇着色。
i, 在年轻和老年脾脏 OT-1 CD8+ TNaiv 细胞之间差异表达基因的火山图。
j, 在转移到年轻肿瘤小鼠之前,老年和年轻脾脏 OT-1 CD8+ TNaiv 细胞之间的基因相关性,以及在转移后,老年和年轻肿瘤浸润 TTerm OT-1 细胞之间的基因相关性。
k, 在老年和年轻脾脏 OT-1 TNaiv 细胞之间预先排序的基因集富集分析(GSEA)。
l, 体外杀伤实验示意图,显示在不同效应细胞与靶细胞(E:T)比例下,脾脏老年(n=4)和年轻(n=4)OT-1 CD8+ T 细胞的细胞毒性百分比。
m, 体内转移试验示意图,用于研究 CD8+ T 细胞的内在反应。年轻小鼠(n=32)接受年轻(n=63;蓝色)或老年(n=43;红色)OT-1 CD8+ T 细胞,然后进行 B16-OVA 肿瘤挑战。l 和 m 中的数据来自至少两次独立实验,并以平均值±标准差(s.d.)的形式展示。
我们想知道肿瘤浸润 CD8+ T 细胞中观察到的与年龄相关的变化是否可以完全用健康老年小鼠中的基线 T 细胞固有缺陷来解释。我们认为,将老年 CD8+ T 细胞转移到年轻的肿瘤小鼠中可以清楚地划分由老化 TME 中的附加信号驱动的细胞自主缺陷。我们将共转移标记的 CD45.1/CD45.2 年轻 OT-1(OT-1Y>Y)和 CD45.1 老年 OT-1(OT-1A>Y)CD8+ T 细胞转移到年轻野生型(CD45.2)肿瘤小鼠中,并通过 scRNA-seq 分析 15 天后的肿瘤浸润转移 T 细胞。我们的分析揭示了三个主要的亚群,包括根据其独特的基因签名定义的 TProg 和 TTerm 细胞亚群。我们发现老年 OT-1A>Y T 细胞的 TTerm 细胞与 TProg 细胞的比例远高于 OT-1Y>Y T 细胞。老年 OT-1A>Y TTerm 细胞也表达较少的 Ikzf2,与先前的报道一致,并且表达更高水平的细胞周期抑制因子,如 Cdkn1a 和 Cdkn2a。这表明,衰老中的 CD8+ T 细胞功能障碍至少部分是由 CD8+ T 细胞内在印记的。
为了确定在老年 OT-1A>Y 小鼠中 TTerm 细胞与 TProg 细胞的高比例是否是由于 TME 中 TProg 细胞形成或维持的固有缺陷,我们在肿瘤早期进展期间列举了亚群频率。我们发现,在肿瘤浸润的早期阶段,OT-1A>Y 小鼠中的 TProg 细胞比 OT-1Y>Y 小鼠更少。这表明老年 OT-1 细胞在 T 细胞浸润肿瘤的最早阶段形成 TProg 细胞的能力较弱。此外,从第 9 天到第 15 天,OT-1A>Y 组中 TTerm 细胞与 TProg 细胞的比例进一步偏斜。这表明,除了 TProg 细胞形成受损外,老年 OT-1 细胞内在的变化也导致 TProg 细胞的维持不良,最终在 TME 中促进了过早的终末分化。
我们接下来想知道,基线前转移时是否已经存在与年龄相关的细胞固有缺陷。在转移前比较年轻和老年脾脏 OT-1 CD8+ T 细胞,发现衰老扩大了抗原经验(CD44+PD-1+),但减少了初始(CD44–PD-1–)CD8+ T 细胞亚群,与先前观察到的一致。TNaiv 细胞在衰老中在转录水平上也发生了广泛变化。关键是,在 TME 中观察到的年轻 OT-1Y>Y 和老年 OT-1A>Y CD8+ T 细胞之间的许多转录变化在基线时的脾脏 CD8+ TNaiv 细胞中已经存在,如 Ets1、Ikzf2、Il7r 和 Bcl2。尽管缺乏抗原经验标志物(如 PD-1 或 CD44),老年和年轻小鼠中的 OT-1 CD8+ TNaiv 细胞表现出初始相关基因表达的全局丧失,并在转录程序中相对富集于删除性耐受或无能。
细胞内在衰老减少了增殖但不影响 TTAD 细胞状态
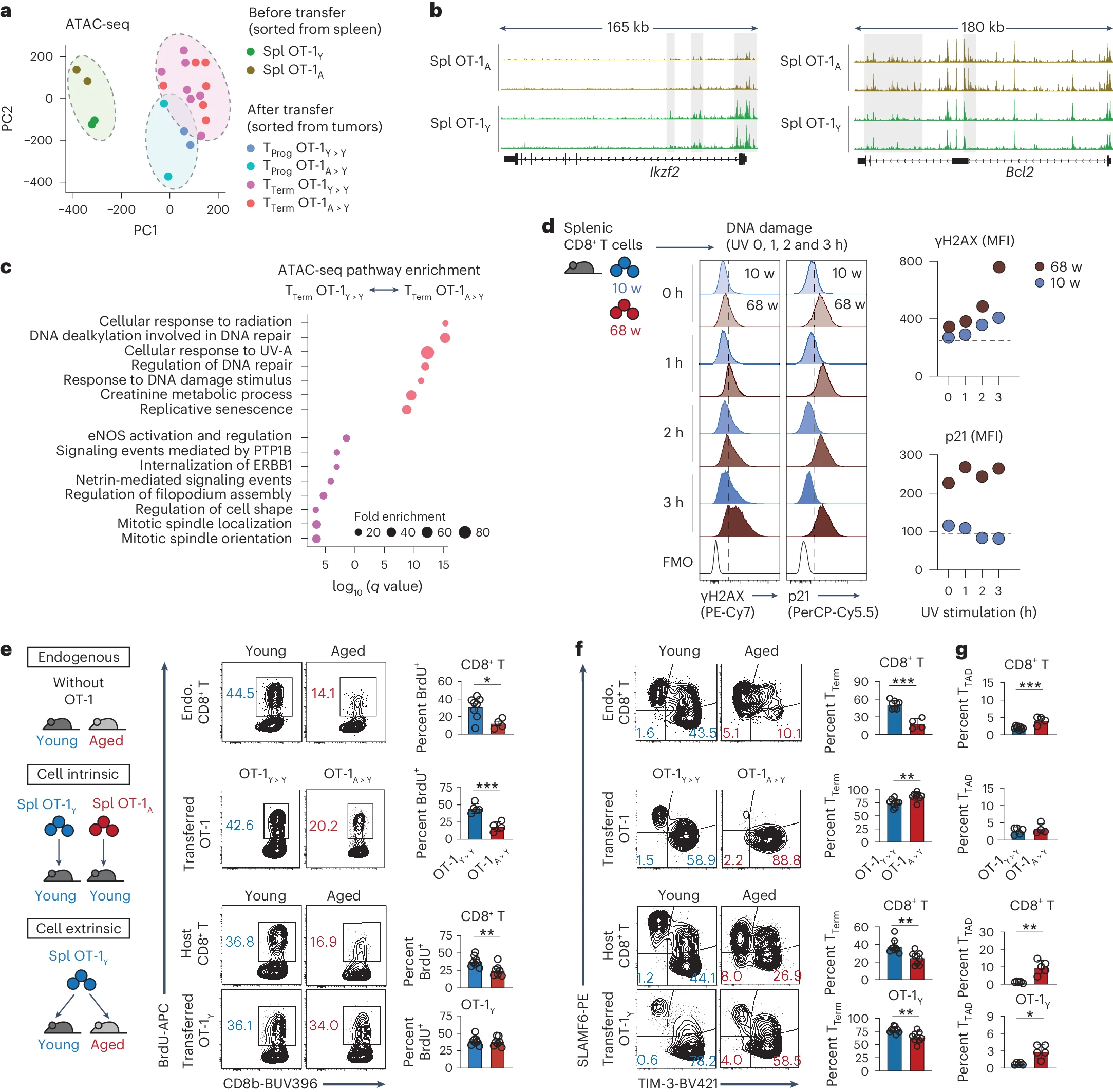
a. 来自老年和年轻、转移前脾脏和肿瘤浸润 OT-1 CD8+ T 细胞亚群的染色质可及性图谱的主成分分析(PCA)投影和转录起始位点富集。
b. 在指示基因位点处,老年(黄色)和年轻(绿色)脾脏 OT-1 CD8+ TNaiv 细胞(Spl TNaiv)染色质转座酶可及性测序(ATAC-seq)轨迹的代表性检测。
c. 在 TTerm OT-1Y>Y(紫色)和 TTerm OT-1A>Y(粉色)染色质可及区域(ChARs)中的通路富集。假发现率(FDR)值(超几何检验)以 -log10(q 值)表示;eNOS,内皮一氧化氮合酶。
d. 在紫外线(UV)暴露 1-3 小时后,年轻和老年脾脏 OT-1 CD8+ T 细胞中γH2AX(左)和 p21(中)的代表性流式细胞图和几何平均荧光强度(MFI);FMO,荧光减一。
e. 从内源模型(Endo.;顶部;未转移 OT-1 T 细胞的年轻(n=8)和老年(n=4)小鼠)、细胞内在模型(中部;接受年轻(n=5)或老年脾脏 OT-1 T 细胞(n=4)的年轻小鼠)和细胞外在模型(底部;接受年轻脾脏 OT-1 T 细胞的年轻(n=8)或老年(n=7)小鼠)中获得的 BrdU+CD8+ T 细胞的频率。
f. 在肿瘤接种后 15 天,年轻(10 周龄;蓝色;n=14)或老年(68 周龄;红色;n=14)受体小鼠中内源性或转移的 TTerm CD8+ T 细胞的 SLAMF6/TIM-3 门控和频率的代表性流式细胞图。
g. 在肿瘤接种后 15 天,年轻(10 周龄;蓝色;n=14)或老年(68 周龄;红色;n=14)受体小鼠中内源性或转移的与年龄相关的 TTAD 细胞的 SLAMF6/TIM-3 门控和频率的代表性流式细胞图。
对于 d-g,数据代表了至少两次独立实验的结果,并以平均值±标准差(s.d.)的形式展示。
我们的发现提出了一个问题:细胞内在缺陷是如何在老年 CD8+ TNaiv 细胞中编码的?已知衰老对表观基因组有深远的影响,因此我们在基线(转移前)和 TME(转移后)分别分析了年轻和老年 CD8+ T 细胞的染色质可及性变化。来自老年小鼠的 CD8+ TNaiv 细胞在与 T 细胞终末分化相关的转录因子(如 Id2)位点显示出增加的可及性,并且初始/记忆 T 细胞相关的转录因子(如 Myb)的相对减少。关键是,年轻和老年 OT-1A>Y TTerm 细胞在 TME 中的基因表达差异(如 Ikzf2 和 Bcl2)可以通过老年初始脾脏细胞在基线时的表观遗传调控改变来解释。
进一步的途径分析显示,DNA 损伤/修复和复制性衰老标志在老年 OT-1A>Y TTerm 细胞中有所不同。这些数据表明,除了过早获得终末分化特征外,老年 CD8+ T 细胞可能在内在上对基因毒性压力更为敏感。为了正式验证这一点,我们将年轻和老年 CD8+ T 细胞暴露于不同剂量的 DNA 损伤诱导的紫外线辐射中,并测量γH2AX(一种已知的 DNA 损伤标志)的相对上调。老年 CD8+ T 细胞的γH2AX 上调速度和绝对水平确实高于年轻的对照细胞。此外,我们注意到 p21(一种将 DNA 损伤与细胞周期停滞联系起来的蛋白质)在基线和辐射后均有较高的表达,这与我们的先前假设一致。
鉴于之前观察到的初始样特征丧失和 DNA 损伤途径富集,我们假设老年 CD8+ T 细胞在肿瘤中的增殖能力内在地下降。为了验证这一点,我们将年轻 OT-1Y 和老年 OT-1A CD8+ T 细胞转移到年轻的肿瘤小鼠中,并评估 BrdU 掺入。老年 OT-1A>Y CD8+ T 细胞即使在年轻肿瘤中也因细胞自主变化而表现出较低的增殖能力。为了进一步验证这是一个单纯的细胞内在缺陷,我们还建立了一个细胞外在范例,将年轻 OT-1Y> A CD8+ T 细胞转移到年轻和老年的肿瘤小鼠中。我们观察到在转移的年轻 T 细胞中 BrdU 掺入量相等,这与相同老年 TME 中的内源性 CD8+ T 细胞形成鲜明对比。
我们接下来想知道细胞内在的缺陷是否也解释了 TTAD 细胞在老年 TME 中的积累。我们重复了我们的细胞内在和细胞外在转移实验,特别评估了 TME 中 TTAD 细胞的频率。令人惊讶的是,当老年 OT-1A>Y 细胞转移到年轻肿瘤小鼠中时,我们没有发现 TTAD 细胞亚群的证据。这与年轻 OT-1Y> A T 细胞在老年小鼠中转移的内源性和转移 TTerm 细胞亚群的减少相一致。相反,我们在老年 TME 中轻松识别了内源性和转移的年轻 OT-1Y> A CD8+ T 细胞中的 TTAD 细胞形成。这些数据表明,尽管衰老中的细胞内在缺陷促进了 T 细胞的过早分化和基因毒性压力,但它们并不驱动老年 TME 中的 TTAD 细胞亚群的分化。
老年 TME 中的细胞外信号驱动 TTAD 细胞状态
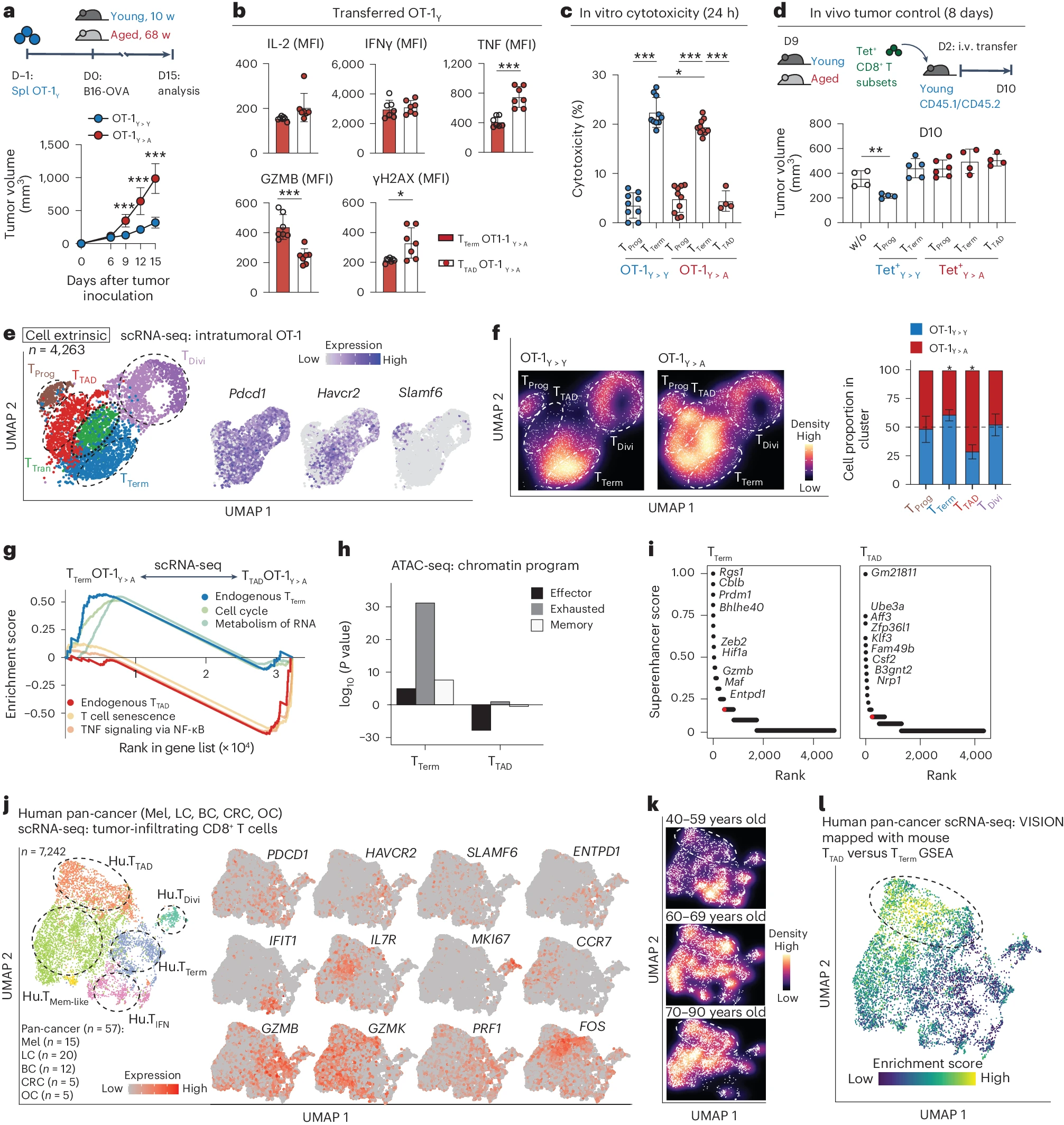
a, 接受年轻脾脏 OT-1 CD8+ T 细胞(Spl OT-1Y)转移的年轻(10 周龄;蓝色;n=17)和老年(68 周龄;红色;n=16)小鼠中 B16-OVA 肿瘤的示意图和生长曲线。
b, 在老年受体小鼠中转移的年轻 OT-1 TTerm(红色)和 TTAD(红色点)细胞亚群内 IL-2、IFNγ、TNF、GZMB 和γH2AX 的几何平均荧光强度(MFI)(n=7)。
c, 体外杀伤实验和在效应细胞与靶细胞比为 0.5:1 时分选出的年轻(蓝色)和老年(红色)OT-1 肿瘤内 CD8+ T 细胞亚群的细胞毒性百分比(n=5)。
d, 在携带 B16-OVA 肿瘤的年轻小鼠中,通过转移来自年轻(蓝色)和老年肿瘤(红色)的不同 OVA Tet+CD8+ T 细胞亚群进行体内肿瘤控制的示意图(n=4-6);w/o,无。
e, 来自转移到年轻和老年小鼠的 4,263 个年轻 OT-1 CD8+ T 细胞的 scRNA-seq 图谱的 UMAP 投影,按簇着色。右侧显示指示基因的表达(灰色表示低表达;紫色表示高表达)。
f, UMAP 空间中的密度图,显示年轻(左,OT-1Y>Y)和老年(右,OT-1Y>A)组。颜色越冷表示密度越低,颜色越暖表示密度越高。图中显示了年轻(OT-1Y>Y,n=5)和老年(OT-1Y>A,n=5)CD8+ T 细胞在 TProg、TTerm、TDivi 和 TTAD 细胞群中的相对比例。
g, 转移的 OT-1 CD8+ TTerm 和 TTAD 细胞内预先排序的基因集富集分析(GSEA)。 h, 在 CD8+ TTerm 和 TTAD 细胞中差异开放的染色质可及区域(ChARs)内效应、耗竭和记忆核心程序的超几何富集分析。
i, 基于 CD8+ TTerm 和 TTAD 细胞中差异开放的 ChARs 的超增强子图。红点表示超增强子的截止点。
j, 来自人类泛癌症汇总肿瘤活检(n=57)的 7,242 个肿瘤浸润 CD8+ T 细胞的 scRNA-seq UMAP 投影,按簇着色。右侧显示指示基因的表达(灰色表示低表达;红色表示高表达);Hu.,人类;Mel,黑色素瘤;LC,肺癌;BC,乳腺癌;CRC,结直肠癌;OC,卵巢癌。
k, UMAP 空间中来自不同年龄段癌症患者的 CD8+ T 细胞的密度图。颜色越冷表示密度越低,颜色越暖表示密度越高。
l, 在人类肿瘤内 CD8+ T 细胞的 UMAP 投影中,鼠 TTAD 和 TTerm 细胞特征的 GSEA 富集分析。深蓝色表示低富集,黄绿色表示高富集。
a-d 中的数据代表了至少两次独立实验的结果,并以平均值±标准差(s.d.)的形式展示。
尽管我们观察到 CD8+ T 细胞增殖的细胞自主变化,我们的数据还表明,老年 TME 中 TTAD 细胞的富集并非老年 CD8+ T 细胞内在的印记。这表明 TTAD 细胞的形成需要老年肿瘤环境中的其他信号。为了调查老年 TME 中细胞外信号的影响,我们将年轻 CD45.1+ 脾脏 OT-1Y CD8+ T 细胞转移到年轻(OT-1Y > Y)和老年(OT-1Y > A)CD45.2+ B16-OVA 肿瘤小鼠中。我们发现,年轻抗原特异性 OT-1 CD8+ T 细胞的转移不足以恢复老年小鼠中的肿瘤控制,这表明老年 TME 在限制 CD8+ T 细胞的肿瘤控制中起关键作用。与此一致的是,我们在老年小鼠中回收的转移肿瘤浸润 OT-1 CD8+ T 细胞较少。此外,我们的数据暗示,转移 OT-1 CD8+ T 细胞的肿瘤控制显著受细胞外信号的影响,而不是由衰老引起的细胞内在变化。因此,我们假设老年 TME 不仅驱动一种特有的 TTAD 细胞亚群的分化,这种亚群是由老年 TME 中的细胞外信号特异性诱导的,而且还限制 CD8+ T 细胞的激活和扩展,这与肿瘤控制不佳相关。
我们接下来想了解这种新 TTAD 细胞亚群在老年 TME 中的功能特性。与老年肿瘤中的 TTerm 细胞相比,TTAD 细胞表达相似量的 IFNγ和 IL-2,但 TNF 的产生增加。相反,细胞毒性分子 GZMB 在 TTAD 细胞中显著减少。我们还注意到,TTAD 细胞中的γH2AX 水平高于年轻和老年肿瘤中的 TTerm 细胞。
为了进一步评估 TTAD 细胞的直接细胞毒能力,我们从年轻和老年肿瘤中分离出体内卵白蛋白四聚体标记的 CD8+(Tet+CD8+)T 细胞亚群,包括内源性 TProg、TTerm 和 TTAD 细胞,并将它们与 B16-OVA 细胞共培养。正如预期的那样,年轻和老年 TProg 细胞表现出相似的低细胞毒性水平(约 5-10%)。年轻 TTerm 细胞在杀伤肿瘤细胞方面表现出稍高的细胞毒性(约 15-20%),而老年 TTerm 细胞的细胞毒性较低(约 5-15%)。值得注意的是,TTAD 细胞几乎没有细胞毒性(约 5%)。为了进一步验证细胞外信号在驱动 TTAD 细胞中低细胞毒性方面的作用,我们重复了相同的体外细胞毒性实验,使用从年轻和老年肿瘤中分离的转移年轻 OT-1 CD8+ T 细胞亚群,并观察到类似的结果。关键是,OT-1 TTAD 细胞也表现出较低的细胞毒性(约 5%),类似于 Tet+ TTAD 细胞。最后,我们评估了通过将不同分离的 Tet+CD45.2+CD8+ T 细胞亚群转移到年轻的 CD45.1+CD45.2+ 肿瘤小鼠中对体内肿瘤控制的影响。8 天后,只有接受年轻 TProg 细胞的小鼠表现出更好的肿瘤控制,而接受 TTAD 细胞的小鼠则未见任何益处。这些结果表明,老年小鼠肿瘤中较高比例的 TTAD 细胞由于其低细胞毒性而导致较差的肿瘤控制。这一功能特征显然不同于肿瘤中经典的 CD8+ T 细胞耗竭,后者通常与效应细胞因子产生的广泛减少以及细胞毒性的相对保留有关。
为了进一步验证这一点,我们定义了转移 TTAD 细胞相对于所有其他转移 OT-1 CD8+ T 细胞亚群在老年 TME 中的转录状态。首先,我们确认了转移 OT-1Y > Y 和 OT-1Y > A T 细胞的 scRNA-seq 分析也显示出在老年小鼠中 TTerm 细胞向 TTAD 细胞的转化倾向。比较 TTAD 细胞和 TTerm 细胞,发现 TTAD 细胞具有独特的基因表达模式,包括高表达 Il7r、Emb、Zfp36l2 和 Fos。基因集富集分析(GSEA)确认了转移 OT-1 CD8+ T 细胞(TTerm 和 TTAD 细胞)与相应内源性群体的转录相似性。GSEA 进一步强调了 TTAD 细胞中代谢/细胞周期相关基因的缺乏,而衰老和 TNF 信号途径相对于 TTerm 细胞富集。这些数据也与之前在 TTAD 细胞中观察到的γH2AX 和 TNF 水平增加一致。因此,TTAD 细胞是肿瘤浸润 CD8+ T 细胞的一个表型和转录上独特的亚群,特定于老年 TME 中的细胞外信号诱导。
我们接下来进行了体内命运映射转移实验,以了解 TTAD 细胞的分化潜力和 TTAD 细胞与其他耗竭 T 细胞亚群在肿瘤中的谱系关系。我们将来自年轻和老年肿瘤的体内卵白蛋白四聚体标记的 CD8+ T 细胞亚群,包括 TProg、TTerm 和 TTAD 细胞,转移到年轻的肿瘤小鼠中。在肿瘤中经历 8 天后,转移的年轻和老年 TProg 细胞都能够分化为 TTran 细胞,并最终达到 TTerm 细胞状态,如预期的那样。类似地,年轻和老年 TTerm 细胞都保持在 TTerm 细胞状态,表明终末分化/耗竭。值得注意的是,我们发现 TTAD 细胞在重新引入年轻宿主后能够部分分化为 TTerm 细胞,这表明细胞外环境因素可能对 TTAD 细胞的形成和维持至关重要。
先前的研究发现了衰老相关变化与 CD8+ T 细胞耗竭之间的不同程度的重叠。我们的研究小组先前定义了一个核心表观遗传标志,可以作为耗竭状态的精确生物标志。尽管这一核心程序与 TTerm 细胞的染色质可及性谱强烈重叠,TTAD 细胞未能富集这一标志。TTAD 细胞的表观遗传景观也未能富集记忆和效应 CD8+ T 细胞程序,这与该亚群中 GZMB 表达的减少一致。
我们接下来希望更好地理解 TTAD 细胞的调控。通过对超增强子和其相关基因的表征,已成为定义许多细胞类型中重要调控节点的主要策略。因此,我们利用我们之前开发的算法来推断 TTerm 和 TTAD 细胞中的超增强子相关基因。TTerm 细胞中的超增强子相关基因包括已知的 CD8+ T 细胞耗竭驱动因素,如 Prdm1、Bhlhle40 和 Maf。相反,TTAD 细胞中的主要超增强子相关基因并未明确映射到已知的 CD8+ T 细胞状态,如耗竭、记忆或效应。这些基因包括限制 CD8+ T 细胞扩展和效应功能的 Zfp36l1、Klf3 和 Fam49b,以及以前未表征的基因 Gm21811。此外,使用 scRNA-seq SCENIC 包,我们还确定了在 TTAD 细胞中相对于 TProg 和 TTerm 细胞活跃的不同关键转录因子(例如 Ets1、Junb 和 Maf)。这些数据表明,TTAD 细胞不仅仅是“超耗竭”,而是代表了一种在老年 TME 中特有的缺乏效应功能的 CD8+ T 细胞状态。
最后,我们想知道是否可以在人类癌症中识别出类似的 TTAD 细胞。通过重新分析已发表的人类肿瘤浸润 CD8+ T 细胞的泛癌症 scRNA-seq 数据集,我们识别出一个类似的 PD-1+IL-7R+CD8+ T 细胞群,不表达 SLAMF6 和 TIM-3。关键是,这一群体在年长(60-90 岁)而非年轻(40-59 岁)的个体的肿瘤活检中富集。支持我们的预期,落在该人类 TTAD 细胞群内的细胞显示出强烈的鼠 TTAD 细胞转录特征的富集。这包括特异性上调的人类 TTAD 细胞相关基因,如 FOS、FOSB、DUSP1 和 IL7R。综合来看,我们的数据表明,TTAD 细胞代表了一种效应功能减少的细胞谱系,与 T 细胞耗竭不同,并且在年长癌症患者的肿瘤中也有所扩展。此外,我们表明,CD8+ T 细胞分化的轨迹总体上,以及 TTAD 细胞的形成特别是几乎完全由老年 TME 中的细胞外信号驱动。
老年 TME 削弱免疫细胞之间的交叉通话,损害 T 细胞反应
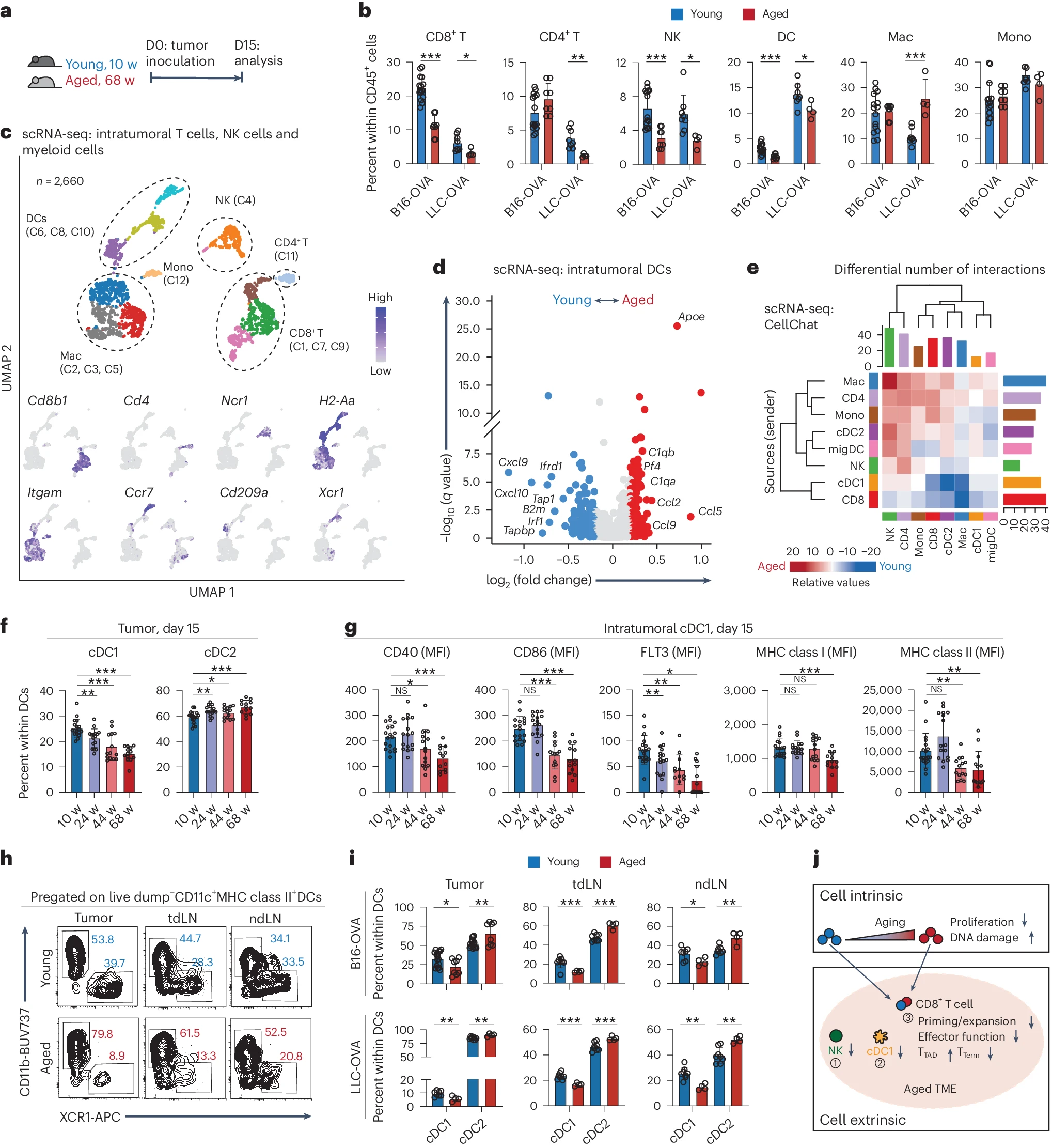
a, 评估来自年轻(蓝色)和老年(红色)肿瘤小鼠的肿瘤内 CD45+ 细胞的示意图。
b, 在挑战 B16-OVA(年轻(蓝色),n=15;老年(红色),n=8)和 LLC-OVA(年轻(蓝色),n=8;老年(红色),n=4)肿瘤后,年轻和老年小鼠中活体肿瘤内 CD45+ 细胞的频率。
c, 来自年轻和老年肿瘤小鼠的 2,660 个肿瘤内 T 细胞、NK 细胞和髓系细胞的 scRNA-seq UMAP 投影,按簇着色。底部显示指示基因的表达(灰色表示低表达;紫色表示高表达)。广泛细胞类型的指定如下:巨噬细胞(Mac;簇(C)2、3 和 5)、NK 细胞(簇 4)、CD8+ T 细胞(簇 1、7 和 9)、树突状细胞(DCs;簇 6、8 和 10)、CD4+ T 细胞(簇 11)和单核细胞(Mono;簇 12)。
d, 年轻(蓝色)和老年(红色)肿瘤内 DCs(簇 6、8 和 10)之间差异表达基因的火山图。
e, scRNA-seq CellChat 中年轻(蓝色)和老年(红色)细胞之间的巨噬细胞、CD4+ T 细胞(CD4)、单核细胞、2 型常规树突状细胞(cDC2)、迁移性树突状细胞(migDC)、NK 细胞、cDC1 和 CD8+ T 细胞(CD8)之间的相互作用差异数量和相对值。
f, 在不同年龄的 B16-OVA 肿瘤小鼠中 cDC 亚群的百分比(n=6-10)。
g, 在不同年龄的肿瘤小鼠第 15 天肿瘤内 cDC1 中 CD40、CD86、FLT3、MHC I 类和 MHC II 类的几何平均荧光强度(MFI)(n=6-10)。
h, 年轻(蓝色;顶部)和老年(红色;底部)小鼠中肿瘤(左)、肿瘤引流淋巴结(中心)和非引流淋巴结(右)中 cDC 亚群的代表性流式细胞图。
i, B16-OVA(顶部;n=14)和 LLC-OVA(底部;n=14)肿瘤小鼠中年轻(蓝色;n=10)和老年(红色;n=8)小鼠的 cDC 亚群的百分比。
j, 随着衰老或在老年肿瘤微环境(TME)中潜在的 CD8+ T 细胞内在和 CD8+ T 细胞外在机制的示意图。b 和 f-i 中的数据代表了至少两次独立实验的结果,并以平均值±标准差(s.d.)的形式展示。
到目前为止,我们的数据表明,老年 TME 中的细胞外信号超过了 CD8+ T 细胞固有的缺陷在肿瘤控制中的作用。这促使我们问:在老年 TME 中,哪些机制限制了 CD8+ T 细胞的抗肿瘤免疫?我们首先使用流式细胞术在 B16-OVA 黑色素瘤和 LLC-OVA 肺癌模型中枚举了年轻和老年肿瘤中的重要免疫细胞群体。只有 CD8+ T 细胞、NK 细胞和 DC 在老年肿瘤中的频率一致且显著降低。
基于这些数据,我们假设老年 TME 中的 NK 细胞 -DC-CD8+ T 细胞交叉通话受损可能是导致 CD8+ T 细胞激活和扩展不佳的原因。因此,我们通过 scRNA-seq 分析更广泛地研究了老年 TME 中肿瘤浸润免疫细胞状态和交叉通话。老年 TME 总体上表达较低水平的抗原呈递基因,如 Psme1、Psme2、Tap1 和 B2m,以及降低了关键趋化因子(如 Xcl1、Cxcl9 和 Cxcl10)的表达。我们发现,这些老年 DC 下调了抗原呈递相关分子(如 B2m 和 Tap1)的表达,并上调了 Apoe 的表达,这可能抑制抗原呈递。此外,我们的分析表明,老年小鼠肿瘤中 NK 细胞、cDC1 和 CD8+ T 细胞之间的相互作用显著减少。确实,我们注意到,在年轻肿瘤中,NK 细胞通过 Flt3l-Flt3 和 Xcl1-Xcr1 轴向 cDC1 提供了更强的支持信号,而在老年肿瘤中,cDC1 和 NK 细胞之间通过 Clec2d-Klrb1b 轴的相互作用更强,可能抑制 NK 细胞功能。这些数据有助于解释我们通过流式细胞术观察到的老年 TME 中 NK 细胞和 DC 频率的减少。我们接下来重点关注 CD8+ T 细胞和 cDC1 之间的相互作用,这对于 CD8+ T 细胞的最佳激活和再激活是必要的。年轻肿瘤不仅在 cDC1 和 CD8+ T 细胞之间具有更强的主要组织相容性复合体 I 类 - T 细胞抗原受体(MHC I 类 -TCR)相互作用,而且具有更高水平的 CD8+ 来源的 CXCL10 和 IFNγ,这促进了抗肿瘤免疫细胞的募集。
由于 NK 细胞分泌的 XCL1 对 cDC1 的募集和分化至关重要,我们想知道在老年小鼠的 TME 中是否发生了 cDC1 群体的变化。为此,我们在年龄不同(10-68 周)的小鼠中植入 B16-OVA 细胞。与我们的先前数据一致,我们的研究表明,随着年龄的逐渐增加,肿瘤生长逐渐增加,同时肿瘤内 CD8+ T 细胞、Tet+CD8+ T 细胞和 TTerm 细胞的比例减少,TTAD 细胞比例增加。同样,随着年龄的增加,cDC1 的频率下降,同时 CD40、CD86、MHC I 类/MHC II 类和 FLT3 水平也减少。这些结果表明,cDC1 的减少及其抗原呈递能力的降低可能限制了 TTerm 细胞的形成,并促进了 TTAD 细胞的形成。此外,cDC1 的减少不仅在肿瘤中发生,也在肿瘤引流淋巴结和非引流淋巴结中发生。这与我们先前的数据一致,显示老年肿瘤小鼠中 Tet+CD8+ T 细胞的激活减少。综合来看,这些数据表明,老年 TME 中缺乏年轻肿瘤中存在的一个关键的放大反馈环路,在这个反馈环路中,NK 细胞衍生的 XCL1 吸引 cDC1 以激活大量 CD8+ T 细胞,这些 CD8+ T 细胞释放炎症细胞因子以募集更多的免疫细胞。
靶向髓系细胞的治疗拯救了老年 cDC1 的 T 细胞激活能力
T 细胞 -cDC1 的相互作用也是免疫治疗效果的重要决定因素。因此,我们想知道老年肿瘤小鼠是否对 mRNA 新抗原疫苗反应不佳,这些疫苗目前正在多种癌症类型中进行研究。为了测试这一点,我们在老年小鼠中评估了对 mRNA 新抗原疫苗的反应。结果显示,老年肿瘤小鼠对疫苗反应确实较差,表现为 CD8+ T 细胞激活和肿瘤控制能力的减弱。然而,通过靶向髓系细胞的治疗,如使用 TLR 激动剂或其他免疫调节剂,可以显著改善老年肿瘤小鼠的免疫反应。这种治疗通过增强 cDC1 的抗原呈递能力和 T 细胞激活功能,有效地恢复了 CD8+ T 细胞在老年 TME 中的作用,从而提高了肿瘤控制能力。
T 细胞与 cDC1 的相互作用也是免疫治疗结果的重要决定因素。我们想知道老年肿瘤小鼠是否对目前正在多种癌症类型中研究的 mRNA 新抗原疫苗反应不佳。为了测试这一点,我们在年龄不同的小鼠中接种了 B16-OVA 肿瘤,并在其后进行 mRNA 新抗原疫苗接种。与年轻小鼠相比,老年小鼠的肿瘤控制能力显著减弱,表现为 CD8+ T 细胞激活不足和肿瘤生长加快。然而,通过联合使用 TLR 激动剂或其他免疫调节剂,靶向髓系细胞的治疗显著改善了老年肿瘤小鼠的免疫反应。联合治疗增强了 cDC1 的抗原呈递能力和 T 细胞激活功能,有效恢复了老年 TME 中 CD8+ T 细胞的功能,从而提高了肿瘤控制能力。