ZNF689 deficiency promotes intratumor heterogeneity and immunotherapy resistance in triple negative breast cancer
三阴性乳腺癌(TNBC)是一种侵袭性疾病,具有显著的肿瘤内异质性(ITH),这对治疗提出了挑战。然而,TNBC 中 ITH 的临床相关性和关键决定因素尚不清楚。在本研究中,我们利用多组学数据对我们中心的队列(n = 260)、癌症基因组图谱(TCGA)队列(n = 134)和四个接受免疫治疗的队列(n = 109)中的 ITH 水平进行了全面表征。我们的研究结果显示,高 ITH 与患者生存率差和免疫治疗耐药性有关。重要的是,我们发现锌指蛋白 689(ZNF689)的缺失是 ITH 形成的一个关键决定因素。在机制上,发现 ZNF689–TRIM28 复合物直接结合到长散在重复元件 -1(LINE-1)的启动子上,诱导 H3K9me3 介导的转录沉默。ZNF689 缺失重新激活了 LINE-1 逆转录转座,导致基因组不稳定性加剧,进而促进了 ITH。单细胞 RNA 测序、空间解析转录组学和流式细胞术分析证实,ZNF689 缺失诱导的 ITH 抑制了抗原呈递和 T 细胞激活,导致免疫治疗耐药性。在体内实验中,药理学抑制 LINE-1 显著降低了 ITH,增强了抗肿瘤免疫,最终使 ZNF689 缺失的肿瘤对免疫治疗敏感。与此一致的是,ZNF689 的表达在临床样本中与良好的预后和免疫治疗反应呈正相关。总之,我们的研究揭示了 ZNF689 缺失诱导 ITH 的一个未被认识的机制,并提出 LINE-1 抑制联合免疫治疗作为 TNBC 的一种新治疗策略。
引言¶
三阴性乳腺癌(TNBC)是一种高度异质性的疾病,由于其侵袭性行为和预后差,长期以来被认为是一个主要挑战。一个导致 TNBC 治疗失败的重要因素是肿瘤内异质性(ITH),即单个肿瘤由许多不同的细胞亚克隆组成。这些亚克隆表现出不同的基因型、表型、生物学和形态学特征,展现了一定程度的 ITH,使得肿瘤能够进展并对治疗产生耐药性。因此,直接阻断 ITH 可能改善 TNBC 患者的治疗效果。
免疫治疗已经在多种实体瘤类型(包括 TNBC)中显示出显著的临床益处。然而,这些益处并不持久,仅限于少部分 TNBC 患者。最近的临床试验报告指出,抗程序性细胞死亡(PD)-1 抗体帕博利珠单抗的客观反应率(ORR)为 21.4%,在二线或更晚的治疗中下降至 5.7%。研究表明,ITH 是免疫治疗成功的关键障碍。ITH 的增加可能导致免疫编辑和免疫逃逸,进而削弱免疫反应。因此,阻断 ITH 可能成为克服 TNBC 免疫治疗耐药性的一个有前景的治疗策略。
ITH 是一个高度复杂和多因素的现象。基因组不稳定性——一种允许癌细胞积累基因突变的异常状态——被认为是导致遗传 ITH 的主要原因。此外,表型和微环境异质性,以及表观遗传、转录、代谢和分泌异质性,也构成了更广泛的 ITH 概念。TNBC 通常被认为是一种具有高水平 ITH 的乳腺癌,包括显著的遗传 ITH。然而,TNBC 中遗传 ITH 及其他形式 ITH 的关键决定因素和潜在机制仍未得到充分阐明。
传统上,遗传 ITH 通过多区域取样或单细胞分析来评估,这对于研究数百个肿瘤来说是难以扩大规模的。即使是单个区域的下一代测序数据也可以分析以发现亚克隆群体。研究表明,这种方法为观察肿瘤整体遗传 ITH 水平提供了足够的分辨率,并使研究更大肿瘤样本集成为可能。最近,基于拷贝数变异和肿瘤特异性突变,生物信息学工具 PyClone 被证明是一种简单、定量和普遍适用的方法来评估遗传 ITH。此外,可以通过肿瘤克隆在苏木精和伊红(H&E)图像上的不同形态评估组织学 ITH。然而,由于 TNBC 中缺乏具有多组学数据的大规模队列,ITH 的全面图景尚未得到探索。
基于这种背景,我们的研究旨在广泛表征 TNBC 中遗传 ITH 和组织学 ITH 这两个关键组成部分的程度。为此,我们利用了来自复旦大学上海癌症中心(FUSCC)和癌症基因组图谱(TCGA)数据集的多组学数据。我们进行了探索性研究,识别了 TNBC 中 ITH 的重要决定因素和潜在机制,并提供了一种通过阻断 ITH 来抑制癌症进展和改善患者生存的潜在治疗策略。
结果¶
高 ITH 降低患者生存率并导致 TNBC 免疫治疗耐药性¶
我们利用我们中心的队列(FUSCC 队列,n = 260)和 TCGA 队列(n = 134)的多组学数据,全面表征了 TNBC 的 ITH,包括全外显子测序(WES)结果、体细胞拷贝数变异(SCNV)数据、转录组 RNA 测序(RNA-seq)数据、H&E 图像和临床数据(图 1a)。为推断遗传 ITH,我们使用 PyClone 估算每个肿瘤的亚克隆数量。为了量化组织学 ITH,我们使用已建立的图像分析软件 CellProfile 测量每个在 H&E 染色图像中检测到的细胞核的大小和染色强度。在 FUSCC 队列中,使用 3 个亚克隆作为切割水平(补充信息,图 S1a)将患者分为高和低遗传 ITH 组。患者也通过中位值 0.5 作为切割水平分类为高和低组织学 ITH 组。在 FUSCC 队列中观察到遗传 ITH 和组织学 ITH 之间的强相关性(补充信息,图 S1b, c),表明组织学 ITH 可用于区分遗传 ITH 水平。此外,我们还对 TCGA 队列中 TNBC 的遗传 ITH 和组织学 ITH 进行了表征,我们的发现与我们的队列结果一致(补充信息,图 S1d–f)。
为了研究 TNBC 中 ITH 的临床相关性,我们进行了 Kaplan-Meier 生存分析。我们的研究结果表明,增加的遗传或组织学 ITH 与 FUSCC 队列中的较低的总体生存期(OS)、无复发生存期(RFS)和无远处转移生存期(DMFS)相关(图 1b, c),并与 TCGA 队列中的较低 OS 和特异性疾病生存期相关(补充信息,图 S1g)。在多变量分析中,高遗传 ITH 和高组织学 ITH 均被发现是独立的不良预后因素(补充信息,图 S1h, i)。然而,在两个队列中未发现 ITH 水平与 TNBC 患者的临床病理特征之间的关联(补充信息,表 S1 和 S2)。
为了确定 TNBC 中 ITH 的下游通路,我们分析了 FUSCC 队列的转录组差异。基因集富集分析(GSEA)结果显示高遗传 ITH 与经典免疫特征(如 IFN 反应和 IL-6、JAK 和 STAT3 通路)呈负相关(图 1d)。此外,高 ITH 与 CD8 评分、肿瘤浸润淋巴细胞(TIL)评分和细胞毒性(CYT)评分呈负相关(图 1e),表明高 ITH 可能导致免疫排斥型肿瘤。先前的研究已经证明,ITH 对免疫治疗的疗效有重大影响。因此,我们探索了 ITH(通过 H&E 切片衍生的组织学 ITH 评估)对 TNBC 中抗肿瘤免疫反应的影响,涉及四项基于抗 PD-1 的临床试验(n = 109)(图 1f)。对包含 29 名和 16 名患者 H&E 图像的新辅助试验 NCT04613674 和 NCT04418154 的分析显示,高 ITH 肿瘤的病理完全反应(pCR)率显著降低(图 1g, h)。在第三个队列(NCT03805399)中,我们检查了 29 名患者的 H&E 图像,观察到高 ITH 肿瘤的 ORR 较低(图 1i)。在最后一个队列(NCT04129996)中,我们评估了 35 名患者的 H&E 图像,发现高 ITH 肿瘤患者的 ORR 较低、无进展生存期(PFS)和 OS 较短(图 1j)。总体而言,我们的研究结果表明,高 ITH 降低了患者的生存率,并导致 TNBC 的免疫治疗耐药性。
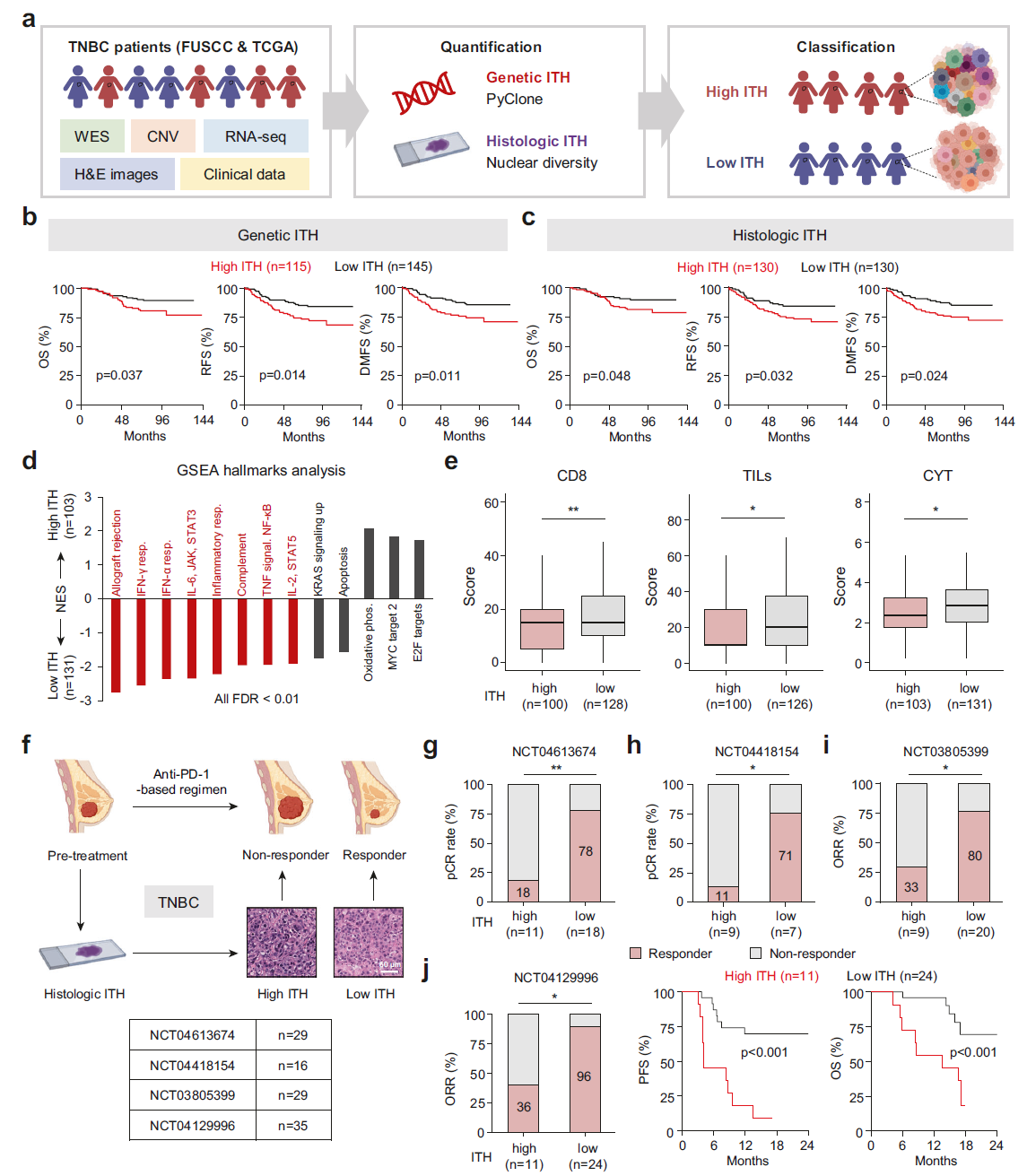
图 1 高 ITH 降低了患者生存率并导致 TNBC 的免疫治疗耐药性。 a TNBC 中 ITH 分析的流程图。 b, c 根据遗传 ITH(b)和组织学 ITH(c)分组的 FUSCC 患者的总体生存期(OS)、无复发生存期(RFS)和无远处转移生存期(DMFS)的 Kaplan-Meier 分析。 d FUSCC 队列中与遗传 ITH 水平相关的标志基因集的标准化富集分数(NES)。红色表示免疫基因集。FDR 表示假发现率,phos. 表示磷酸化,resp. 表示反应。 e FUSCC 队列中具有不同遗传 ITH 水平患者的 CD8、肿瘤浸润淋巴细胞(TILs)和细胞毒性(CYT)评分。 f 分析工作流程的示意图。使用四项临床试验记录了 TNBC 中治疗前 ITH 与抗 PD-1 反应之间的关系。比例尺,60 μm。 g–i 对不同组织学 ITH 水平的患者在 NCT04613674(g)、NCT04418154(h)和 NCT03805399(i)中的反应进行分析。 j 对不同组织学 ITH 水平的患者在 NCT04129996 中的反应、无进展生存期(PFS)和总体生存期(OS)的分析。P 值通过对数秩检验(b, c, j)、Wilcoxon 检验(e)和 Fisher 精确检验(g–j)确定。
ZNF689 缺失促进 TNBC 中的 ITH¶
为探讨 TNBC 中 ITH 的关键决定因素,我们利用我们队列的数据分析了拷贝数改变、体细胞突变和转录组。由于高遗传 ITH 或组织学 ITH 肿瘤表现出的 SCNV 和突变图谱与低 ITH 肿瘤相似(补充信息,图 S2a–d),我们将重点放在转录组分析上。在分别获取遗传和组织学水平上高 ITH 和低 ITH 组之间的差异表达基因后(补充信息,图 S2e, f),我们发现 6 个共同的差异表达基因(MUC19、PGC、DHRS2、ZNF689、TDRD12 和 C20orf114)(图 2a;补充信息,图 S2g, h)。
接下来,我们设计了一个三维肿瘤球体实验,以评估 9 种 TNBC 细胞系的组织学 ITH(补充信息,图 S3a, b)。我们选择了 LM2 细胞系,该细胞系具有低遗传和组织学 ITH(补充信息,图 S3c),以实验性地鉴定诱导 TNBC ITH 的最关键基因(图 2b)。对 LM2 球体的 H&E 染色图像的检查显示,使用短发夹 RNA(shRNA)敲低 ZNF689 显著增加了组织学 ITH(图 2c, d;补充信息,图 S3d)。具体而言,与低 ITH 组相比,高遗传和组织学 ITH 组的 ZNF689 表达平均减少了 3 倍和 2.6 倍。此外,我们观察到 ZNF689 蛋白表达与 TNBC 细胞系中 ITH 程度呈反比关系(补充信息,图 S3e, f)。与此一致的是,在我们的队列和 TCGA 队列中,肿瘤中低 ZNF689 表达与更高的遗传和组织学 ITH 水平相关(补充信息,图 S3g)。总体而言,这些结果表明 ZNF689 可能是调节 TNBC 中 ITH 的一个关键因素,需要进行更深入的实验探索。
为了研究 ZNF689 是否能够在体内影响 TNBC ITH,我们设计了一系列实验,使用了免疫缺陷和免疫健全的小鼠(图 2e)。(1) 我们选择了一个遗传 ITH 低(表现为两个亚克隆)和组织学 ITH 低的 TNBC 患者来源的异种移植(PDX)标本,并具有较高的 ZNF689 表达(补充信息,图 S4a, b)。在建立 PDX 模型后,我们进行了针对 ZNF689 的 siRNA 肿瘤内注射。值得注意的是,ZNF689 的缺失显著增加了遗传 ITH 和组织学 ITH 水平(图 2f)。用 siZNF689 处理的 PDX 肿瘤的生长速度也比对照组快(补充信息,图 S4c, d)。(2) 稳定表达 shNC 和 shZNF689 的 LM2 细胞被皮下注射到 NOD/SCID 小鼠的乳腺脂肪垫(MFPs)中。我们发现 ZNF689 敲低显著增加了免疫缺陷小鼠异种移植物中的遗传和组织学 ITH 水平(图 2g)。此外,表达 shZNF689 的异种移植物肿瘤生长速度比表达 shNC 的快(补充信息,图 S4e, f)。(3) 稳定表达载体和 ZNF689 的 LM2 细胞被皮下注射到 NOD/SCID 小鼠的 MFPs 中。我们观察到 ZNF689 过表达限制了 LM2 肿瘤异种移植物中的遗传 ITH 和组织学 ITH(图 2h)。此外,ZNF689 过表达的异种移植物肿瘤生长更慢(补充信息,图 S4g, h)。(4) shZnf689 或 Znf689 过表达的 4T1 细胞被皮下注射到 BALB/c 小鼠的 MFPs 中。我们发现,Znf689 缺失导致 4T1 同基因移植物中显著更高的组织学 ITH(图 2i)。相反,Znf689 过表达导致较低程度的组织学 ITH(图 2j)。此外,Znf689 敲低显著促进了肿瘤生长,而 Znf689 过表达则具有相反的效果(补充信息,图 S4i–l)。综上所述,这些结果表明 ZNF689 缺失在体外和体内均促进了 TNBC 中的 ITH。
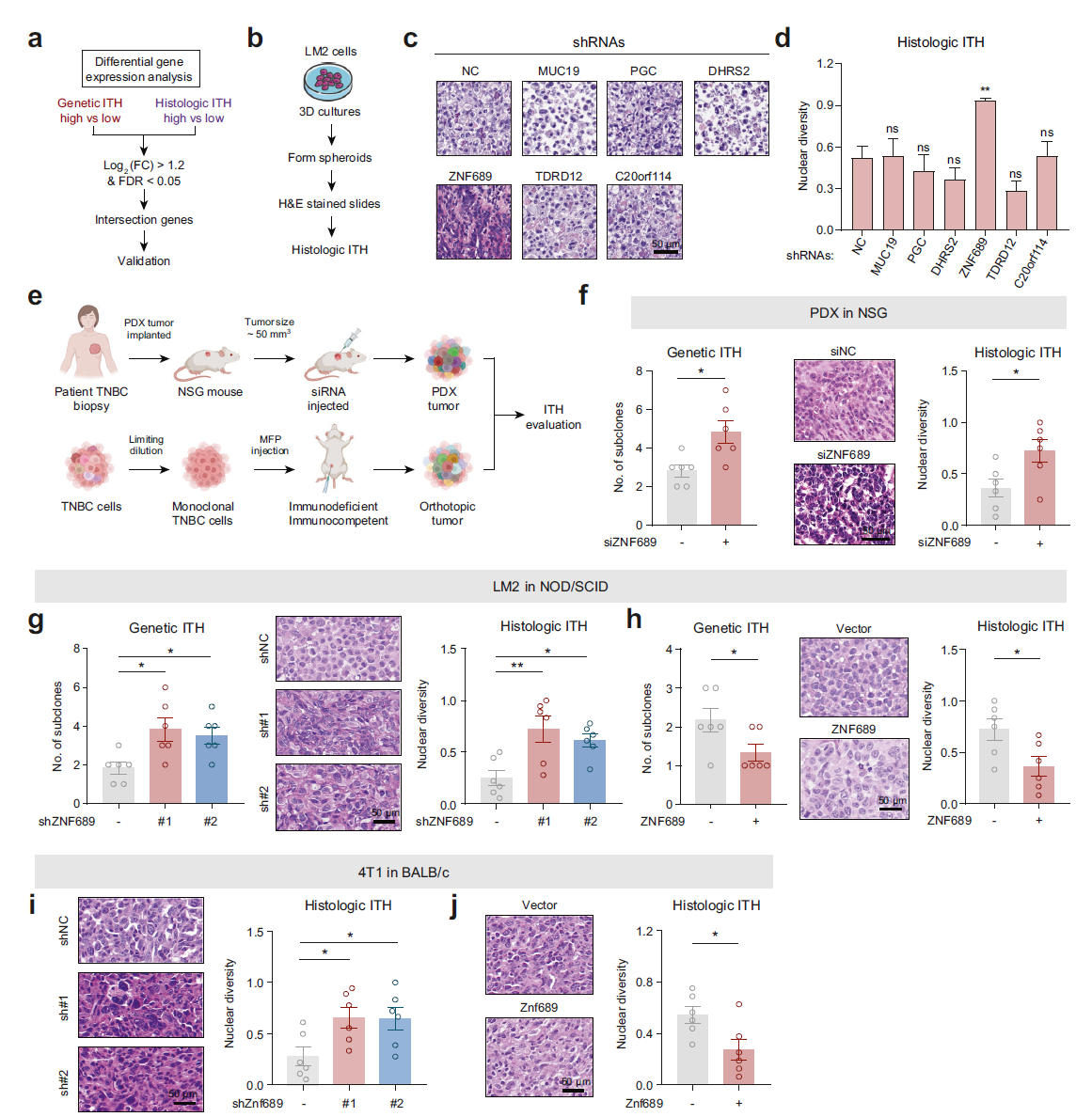
图 2 ZNF689 缺失促进 TNBC 中的 ITH。 a 筛选过程的流程图。FC 表示倍数变化;FDR 表示假发现率。 b 用于评估 LM2 细胞组织学 ITH 的三维肿瘤球体实验的实验方案。 c H&E 染色的 LM2 球体的代表性图像。 d LM2 球体的组织学 ITH 分析。 e 不同小鼠模型的图示,以研究 ZNF689 在 ITH 中的作用。 f 在 NSG 小鼠(n = 6)中,PDX 肿瘤在肿瘤内分别注射 siNC 或 siZNF689 后的遗传 ITH 和组织学 ITH。 g 在 NOD/SCID 小鼠(n = 6)的 MFPs 中接种 shNC 或 shZNF689 LM2 细胞生成的原位肿瘤的遗传 ITH 和组织学 ITH。 h 在 NOD/SCID 小鼠(n = 6)的 MFPs 中接种载体或 ZNF689 过表达的 LM2 细胞生成的原位肿瘤的遗传 ITH 和组织学 ITH。 i 在 BALB/c 小鼠(n = 6)的 MFPs 中注射 shNC 或 shZnf689 4T1 细胞生成的原位肿瘤的组织学 ITH。 j 在 BALB/c 小鼠(n = 6)的 MFPs 中注射载体或 Znf689 过表达的 4T1 细胞生成的原位肿瘤的组织学 ITH。比例尺,50 μm。P 值通过单向 ANOVA(d, g, i)和双尾非配对 Student’s t 检验(f, h, j)确定。ns 表示无显著性差异。
ZNF689 通过 TRIM28 复合物抑制 LINE-1 逆转录转座¶
为了解析 ZNF689 缺失如何促进 TNBC 中 ITH 的潜在机制,我们应用了基于稳定同位素标记氨基酸的细胞培养(SILAC)定量蛋白质组学来筛选 ZNF689 相互作用蛋白(补充信息,图 S5a)。在按 Log2(比率 H/L)排名的 ZNF689 前 7 个潜在互作蛋白中(补充信息,图 S5b),我们选择排名最高的蛋白 TRIM28 进行进一步的结合验证。TRIM28 是 Krüppel 关联盒结构域锌指蛋白(KRAB-ZFP)转录因子的一个通用共因子。内源性 ZNF689 和 TRIM28 的免疫共沉淀(co-IP)实验以及随后的蛋白质印迹(western blot)显示,这两种蛋白可以在 LM2、Hs578T 和 HEK293T 细胞中的内源性水平发生相互作用(图 3a;补充信息,图 S5c)。利用重组 ZNF689 和 TRIM28 蛋白的体外 pull-down 实验进一步表明,这种相互作用可能是直接的(图 3b)。免疫荧光(IF)显示 ZNF689 与 TRIM28 在细胞核内共定位(补充信息,图 S5d)。我们还映射了 ZNF689 的 KRAB 结构域的 N- 端与 TRIM28 的 RING 结构域、B 盒和螺旋 - 螺旋 - 卷曲结构域(RBCC)之间的相互作用(补充信息,图 S5e–g),这些是介导 KRAB-ZFPs 和 TRIM28 结合的关键区域。
KRAB-ZNF 的主要作用是通过招募转录调节因子 TRIM28 及其相关的依赖于组蛋白 H3 Lys9 三甲基化(H3K9me3)的异染色质形成和 DNA 甲基化的介质来沉默重复序列(REs)。由于 REs 是基因变异和基因组进化的主要参与者,我们推测 ZNF689 可能通过调控 REs 来抑制 TNBC ITH。为了研究 ZNF689 耗竭时是否有任何已知的 REs 受到调控,我们对 siNC 和 siZNF689 处理的 LM2 细胞进行了 RNA-seq。数据使用 RepEnrich 软件分析以量化 RE 表达。在 ZNF689 耗竭后表达发生变化的 REs 中,LINE 是人类基因组中最丰富的 RE 之一,其表达显著增加(补充信息,图 S6a)。GSEA 也显示,siZNF689 处理的细胞中人类 LINE-1 基因特征显著上调(图 3c)。为了验证转录组分析,我们进行了实时定量聚合酶链反应(RT-qPCR)和蛋白质印迹实验,以量化 LINE-1。我们观察到 ZNF689 缺失显著上调了 LINE-1 mRNA 及其编码蛋白 ORF1p 和 ORF2p 在人体(LM2 和 Hs578T)和小鼠(4T1 和 AT3)TNBC 细胞系中的表达(图 3d, e;补充信息,图 S6b, c)。
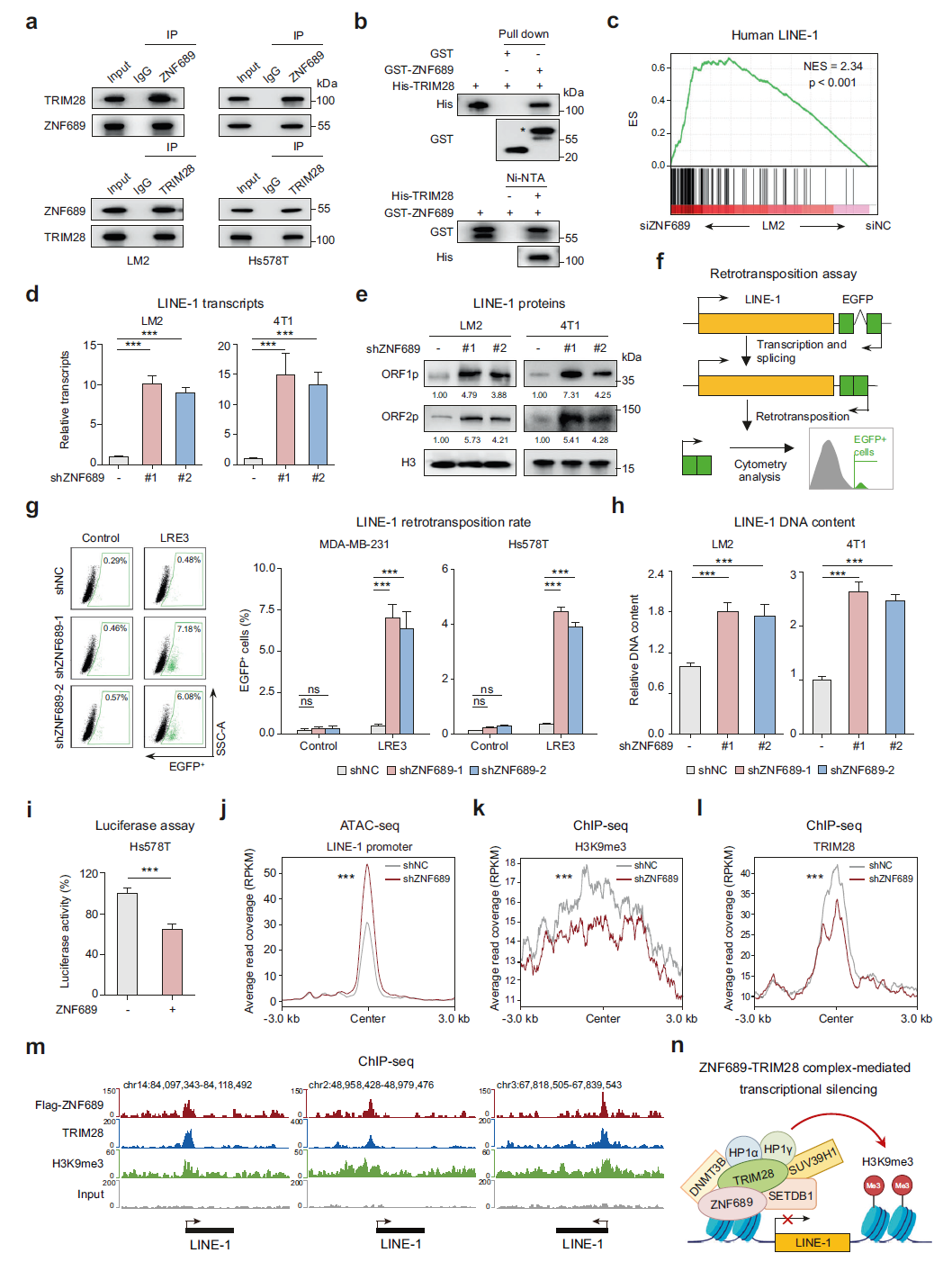
图 3 ZNF689 通过 TRIM28 复合物介导的转录沉默抑制 LINE-1 逆转录转座。 a 内源性 ZNF689 和 TRIM28 的免疫共沉淀(Co-IP)实验及后续的蛋白质印迹分析。 b GST 标签的 ZNF689 和 His 标签的 TRIM28 重组蛋白的体外 pull-down 实验及后续的蛋白质印迹分析。单星号代表特异性条带。 c 在 siZNF689 处理的 LM2 细胞中通过基因集富集分析(GSEA)显示人类 LINE-1 基因特征的上调。 d shNC 和 shZNF689 细胞中 LINE-1(ORF2)转录水平的 RT-qPCR 分析。 e shNC 和 shZNF689 细胞中 LINE-1 ORF1p 和 ORF2p 蛋白的蛋白质印迹分析。 f LINE-1 逆转录转座报告实验的示意图。 g 显示携带 LRE3-EGFP 逆转录转座报告基因或逆转录转座缺陷的 JM111 对照的细胞的代表性流式细胞术图(左)。shNC 和 shZNF689 细胞中新生逆转录转座事件(EGFP 阳性细胞)的量化(右)。 h shNC 和 shZNF689 细胞中 LINE-1(LM2 为 5′-UTR;4T1 为 ORF2)基因组 DNA 含量的相对 RT-qPCR 分析。 i 在 ZNF689 过表达细胞中检测 LINE-1 启动子活性的双荧光素酶报告实验。 j 在 LM2 细胞中 ZNF689 敲低影响 LINE-1 全长启动子的 ATAC-seq 峰信号。 k, l 显示 ZNF689 敲低时 LINE-1 全长启动子上 H3K9me3(k)和 TRIM28(l)ChIP-seq 信号变化的代谢图。 m ChIP-seq 轨迹显示 ZNF689、TRIM28、H3K9me3 和输入在 LINE-1 全长上的结合模式。 n 示意图显示 ZNF689 通过 TRIM28 复合物介导的转录沉默抑制 LINE-1 逆转录转座。P 值通过单向 ANOVA(d, g, h)、双尾非配对 Student’s t 检验(i)和 Wilcoxon 检验(j–l)确定。ns 表示无显著性差异。
为了检查 ZNF689 缺失时 LINE-1 的逆转录转座活性是否增加,我们在 ZNF689 敲低的细胞(MDA-MB-231 和 Hs578T)中使用一个工程化的 LINE-1 报告系统进行逆转录转座分析(图 3f)。值得注意的是,ZNF689 敲低的细胞中观察到比对照细胞更高的 LINE-1 逆转录转座频率(图 3g)。我们还使用 RT-qPCR 检测到 ZNF689 敲低的人类和小鼠 TNBC 细胞系中 LINE-1 的基因组 DNA 含量增加(图 3h;补充信息,图 S6d)。LINE-1 的转录由其 5′非翻译区(UTR)内的内部启动子驱动。为了测试 ZNF689 是否直接调控 LINE-1 转录,我们将人类 LINE-1 5′-UTR 克隆到一个荧光素酶报告质粒中。ZNF689 的过表达在 Hs578T 和 HEK293T 细胞中强烈抑制了荧光素酶活性(图 3i;补充信息,图 S6e)。转座酶可接入染色质的测序分析(ATAC-seq)支持 ZNF689 缺失导致 LINE-1 全长启动子的去抑制和染色质可接近性增加的观点(图 3j;补充信息,图 S6f)。使用染色质免疫沉淀 -qPCR(ChIP-qPCR)实验,我们发现 ZNF689 特异性富集于 LM2 细胞中的 LINE-1 位点的 5′-UTR(补充信息,图 S6g)。ChIP-seq 数据分析证实了 ZNF689 与 LINE-1 启动子的结合(补充信息,图 S6h, i)。因此,LINE-1 在高 ITH 的 TNBC 肿瘤中显著过表达(补充信息,图 S6j)。
TRIM28 作为一个沉默复合物的支架,包含组蛋白甲基转移酶 SETDB1、核小体重塑和去乙酰化(NuRD)复合物、异染色质蛋白 1(HP1)和 DNA 甲基转移酶。通过 co-IP 实验,我们识别了 SETDB1、DNMT3B、HP1α、HP1γ和 SUV39H1 作为其他 ZNF689 相互作用蛋白(补充信息,图 S6k)。LINE-1 的启动子选择性富集了组蛋白变体 H3.3 以及维持 LINE-1 抑制状态所必需的组蛋白标记 H3K9me3。因此,我们假设 ZNF689 可能招募这些酶到 LINE-1 启动子以增强 H3K9me3 介导的转录沉默。ChIP-seq 分析显示 ZNF689 敲低时 LINE-1 全长启动子上的 H3K9me3 修饰减少(图 3k)。随后实验显示,在缺乏 ZNF689 的情况下,TRIM28 在该位点的招募减弱(图 3l)。这些数据支持 ZNF689 和 TRIM28 协调结合以介导 LINE-1 启动子上的 H3K9me3 修饰的观点(图 3m)。此外,ZNF689 敲低并未显著改变 TRIM28 或 SETDB1 蛋白水平(补充信息,图 S6l)。综上所述,这些结果表明,ZNF689 通过 TRIM28 复合物介导的转录沉默抑制 LINE-1 逆转录转座(图 3n)。
ZNF689 缺失引发的 LINE-1 逆转录转座加剧基因组不稳定性并促进 ITH¶
LINE-1 逆转录转座是基因组不稳定性的主要来源,表现为双链 DNA 断裂和染色体不稳定性(CIN)增加。因此,我们假设 ZNF689 缺失可能通过解除对 LINE-1 逆转录转座的抑制,导致基因组不稳定性增加,从而促进 ITH。首先,我们检测了磷酸化组蛋白 H2AX(γH2AX),这是用于评估基因组不稳定性的 DNA 双链断裂标志物。IF 分析(图 4a)和蛋白质印迹(补充信息,图 S7a)显示,ZNF689 敲低增强了γH2AX 水平,这与 ZNF689 敲低的 LM2 原位肿瘤中的结果一致(图 4b)。接下来,我们探索了 ZNF689 缺失在 CIN 中的潜在作用。中期染色体扩展实验显示 ZNF689 敲低细胞中染色体畸变显著增加(图 4c)。此外,在我们的队列中,低 ZNF689 表达与 CIN 基因特征评分显著相关(补充信息,图 S7b)。ZNF689 表达降低的 TNBC 肿瘤还表现出更高的非整倍性评分(补充信息,图 S7c)。H&E 切片的组织学检查也证实了 ZNF689 缺失与中期染色体错误分离增加之间的显著相关性(图 4d)。这些结果表明,ZNF689 缺失导致了 TNBC 中的基因组不稳定性增加。
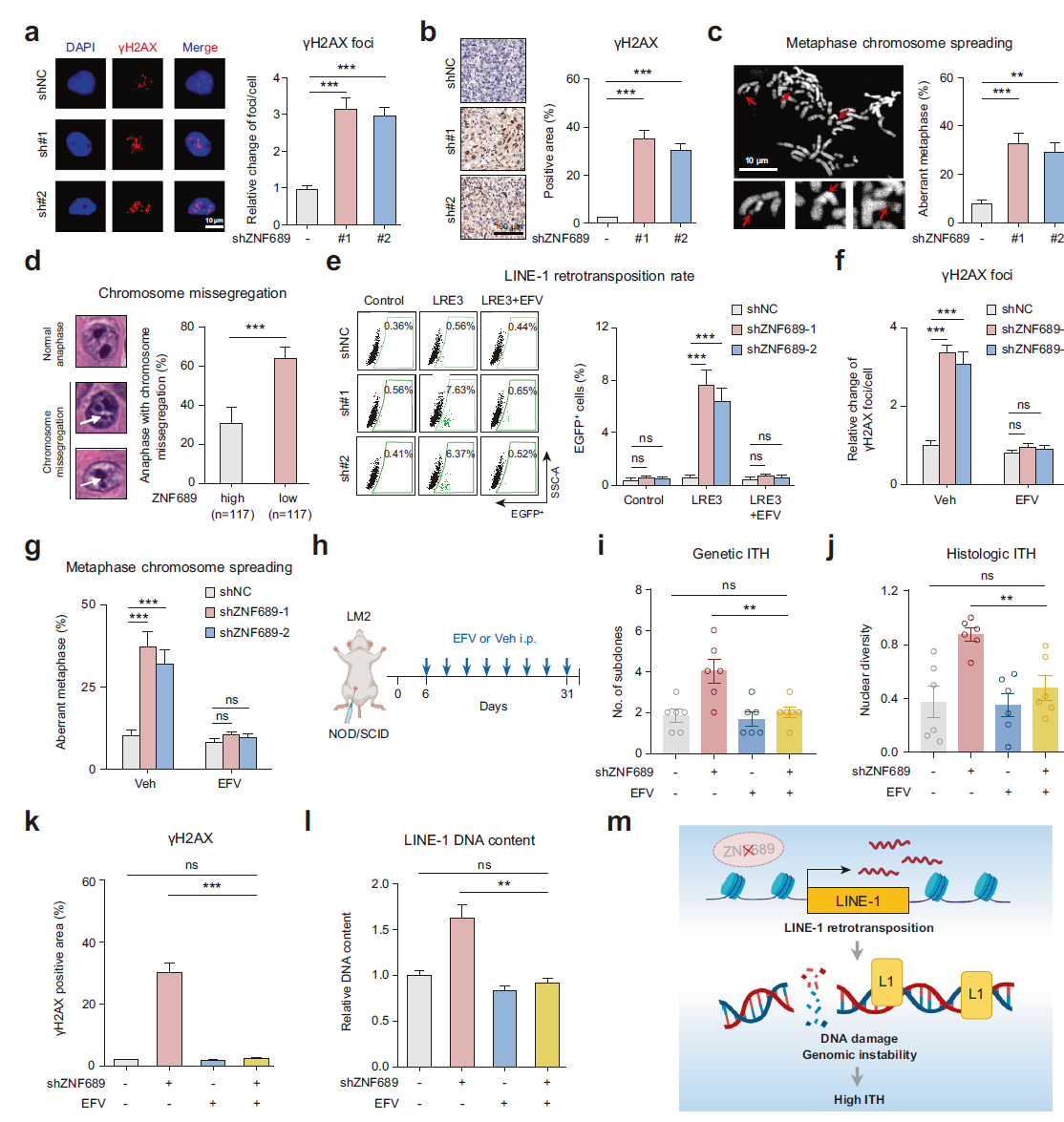
图 4 ZNF689 缺失诱导的 LINE-1 逆转录转座加剧基因组不稳定性并促进 ITH。 a shNC 和 shZNF689 LM2 细胞中γH2AX 焦点的代表性免疫荧光(IF)图像和定量分析(n = 30)。比例尺,10 μm。 b 原位 shNC 和 shZNF689 LM2 肿瘤中γH2AX 的代表性免疫组化(IHC)图像和定量分析(n = 6)。比例尺,100 μm。 c shNC 和 shZNF689 LM2 细胞在第 20 代时染色体畸变(红色箭头)的代表性图像和定量分析(n = 50)。比例尺,10 μm。 d FUSCC 队列诊断 H&E 样本中染色体错误分离(白色箭头)的代表性图像和定量分析。 e EFV(20 μM)处理的 shNC 和 shZNF689 MDA-MB-231 细胞中新生逆转录转座事件(EGFP 阳性细胞)的代表性流式细胞术图和定量分析。 f EFV(20 μM)处理的 shNC 和 shZNF689 LM2 细胞中γH2AX 焦点的定量分析(n = 30)。 g EFV(20 μM)处理的 shNC 和 shZNF689 LM2 细胞在第 20 代时的染色体畸变定量分析(n = 50)。 h EFV 处理方案的示意图。在将 shNC 或 shZNF689 LM2 细胞接种到 MFP 后,NOD/SCID 小鼠被随机分组,并每天通过腹腔注射(i.p.)给予 Veh 或 EFV 处理(n = 6 只小鼠/组)。 i, j h 中小鼠原位 LM2 肿瘤的遗传 ITH(i)和组织学 ITH(j)(n = 6)。 k h 中小鼠原位肿瘤中γH2AX 的定量分析(n = 6)。 l h 中解剖的小鼠肿瘤中 LINE-1(5′-UTR)DNA 含量的 RT-qPCR 分析(n = 6)。 m 示意图显示 ZNF689 缺失通过重新激活 LINE-1 逆转录转座加剧基因组不稳定性以促进 ITH。P 值通过单向 ANOVA(a–c, e–g, i–l)和双尾非配对 Student’s t 检验(d)确定。ns 表示无显著性差异。
逆转录酶抑制剂如依非韦伦(EFV)能够有效阻断内源性逆转录酶的酶活性,被认为是 LINE-1 逆转录转座的潜在特异性抑制剂。我们观察到,EFV 有效缓解了 ZNF689 敲低引起的 LINE-1 逆转录转座和基因组 DNA 含量的变化(图 4e;补充信息,图 S7d, e)。后续的 IF 分析(图 4f)和蛋白质印迹分析(补充信息,图 S7f)显示,EFV 处理减弱了 ZNF689 敲低诱导的γH2AX 上调。EFV 还减少了 ZNF689 耗竭细胞中的染色体畸变(图 4g)。重要的是,EFV 对 TNBC 细胞的 DNA 损伤、细胞凋亡或增殖没有显著影响(补充信息,图 S7g–i)。这些结果表明,ZNF689 缺失通过 LINE-1 逆转录转座加剧了基因组不稳定性。
接下来,我们研究了是否可以通过抑制体内 LINE-1 逆转录转座逆转 ZNF689 缺失诱导的 ITH。我们构建了使用 shNC 或 shZNF689 LM2 细胞的 MFP 异种移植模型。一周后,NOD/SCID 小鼠被随机分组,每天通过腹腔注射(i.p.)给予载体(Veh)对照或 EFV(图 4h)。结果显示,EFV 完全消除了 ZNF689 敲低诱导的肿瘤生长(补充信息,图 S7j)。值得注意的是,EFV 显著降低了 ZNF689 敲低肿瘤中的遗传 ITH(图 4i)和组织学 ITH(图 4j),表明 ZNF689 缺失促进 ITH 的效应依赖于 LINE-1 逆转录转座。原位肿瘤的免疫组织化学(IHC)分析显示,EFV 有效减少了 ZNF689 缺失肿瘤中γH2AX 阳性区域(图 4k)。此外,EFV 显著下调了 ZNF689 缺失肿瘤中 LINE-1 的 DNA 含量(图 4l)。总之,这些结果支持 ZNF689 缺失通过解除 LINE-1 逆转录转座抑制来加剧基因组不稳定性以促进 ITH(图 4m)。
ZNF689 缺失诱导的高 ITH 削弱抗原呈递和 T 细胞激活¶
我们发现高 ITH 导致了 TNBC 中的免疫治疗耐药性(图 1f–j)。为了直接评估 ITH 诱导下肿瘤微环境的重塑,我们进行了单细胞 RNA 测序(scRNA-seq)来表征从 shZnf689 或 shNC 4T1 同基因移植物中收集的细胞的转录组变化(图 5a)。最终,我们收集了 shZnf689 组的 10,913 个细胞和 shNC 组的 14,788 个细胞。在整合所有获取的细胞的转录组数据后,统一流形近似与投影(UMAP)可视化显示了六种细胞类型,包括癌细胞、髓系细胞、B 细胞、T 细胞、癌相关成纤维细胞(CAFs)和内皮细胞(补充信息,图 S8a, b)。我们确认癌细胞的拷贝数不稳定,而其他细胞群体的拷贝数稳定(补充信息,图 S8c)。值得注意的是,Znf689 缺失肿瘤细胞中的 T 细胞比例减少(补充信息,图 S8d)。为了准确定义 T 细胞,我们将 T 细胞进一步分为七个亚型:活化的 CD8+ T 细胞、调节性 T 细胞(Treg)、Tcf7+ T 细胞、效应 T 细胞(Teff)、增殖性 T 细胞(Tpro)、Isg+ T 细胞和 CD4+ 初始 T 细胞(图 5b;补充信息,图 S8e)。在 Znf689 缺失组中,活化的 CD8+ T 细胞、Teff、Tpro 和 Isg+ T 细胞减少,而 Tregs、Tcf7+ T 细胞和 CD4+ 初始 T 细胞增加(图 5c)。这一发现也通过 BALB/c 小鼠的 4T1 肿瘤的免疫细胞分析流式细胞术验证,ZNF689 敲低减少了肿瘤 CD4+ T 细胞浸润、CD8+ T 细胞浸润以及颗粒酶 B+(GZMB+)和 IFN-γ+ CD8+ T 细胞的百分比(图 5d;补充信息,图 S8f)。相反,在 Znf689 过表达的 4T1 肿瘤中,CD3+ T 细胞中 CD4+ T 细胞和 CD8+ T 细胞的百分比以及 CD8+ T 细胞中 GZMB+ 和 IFN-γ+ 细胞的百分比显著增加(补充信息,图 S8g)。同样,scRNA-seq 数据表明,Znf689 缺失肿瘤中的 T 细胞表达较低水平的细胞毒性 T 细胞标志物(Ifng, Nkg7, Prf1 和 Gzmb),但表达较高水平的抑制性 T 细胞(Ctla4 和 Btla)和 Treg(Foxp3, II2ra 和 Ikzf3)标志物(图 5e)。
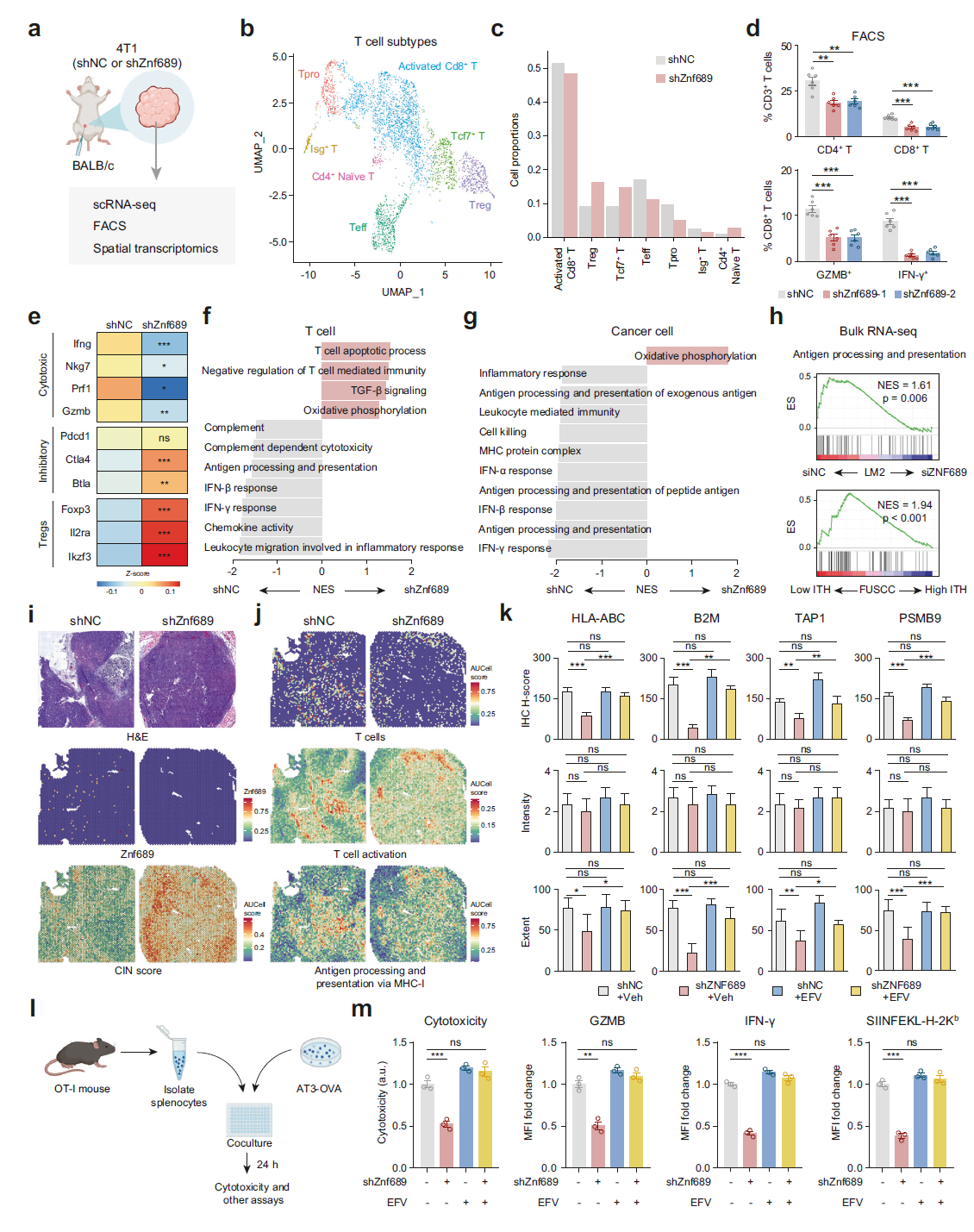
图 5 ZNF689 缺失诱导的 ITH 削弱抗原呈递和 T 细胞激活。 a 将 shNC 和 shZnf689 4T1 细胞皮下注射到 BALB/c 小鼠的乳腺脂肪垫(MFPs)中,然后对肿瘤进行单细胞 RNA 测序(scRNA-seq)、荧光激活细胞分选(FACS)和空间转录组学分析。 b 肿瘤内 T 细胞的 UMAP 分类图。 c shNC 和 shZnf689 肿瘤中 T 细胞亚型的分布。 d 流式细胞术分析肿瘤中 CD4+ T 细胞、CD8+ T 细胞、GZMB+ CD8+ T 细胞和 IFN-γ+ CD8+ T 细胞的百分比(n = 6)。 e 热图显示 shNC 和 shZnf689 肿瘤 T 细胞中细胞毒性 T 细胞、抑制性 T 细胞和 Tregs 的标志基因表达。 f, g shZnf689 肿瘤中 T 细胞(f)和癌细胞(g)下调的通路。 h GSEA 分析显示在 siZNF689 处理的 LM2 细胞和 FUSCC 队列中高遗传 ITH 肿瘤中抗原加工和呈递的下调。 i H&E 染色组织图像、shNC 和 shZnf689 肿瘤中 CIN 特征评分的 Znf689 表达和热点。 j shNC 和 shZnf689 肿瘤中的 T 细胞、T 细胞激活及通过 MHC-I 的抗原加工和呈递的特征评分。 k 图 4h 中小鼠肿瘤中 HLA-ABC、B2M、TAP1 和 PSMB9 蛋白表达的 IHC H 评分、强度和范围。 l 体外肿瘤 - 免疫细胞共培养实验的示意图。 m 肿瘤细胞和 OT-I CD8+ T 细胞共培养 24 小时后培养基的细胞毒性分析。流式细胞术用于确定共培养 24 小时后肿瘤细胞和 OT-I 脾细胞中 CD8+ T 细胞的 GZMB 和 IFN-γ表达,以及 AT3-OVA 肿瘤细胞中的 OVA(SIINFEKL–H-2Kb)呈递。P 值通过单向 ANOVA(d, k, m)和双尾非配对 Student’s t 检验(e)确定。ns 表示无显著性差异。
接下来,我们研究了 ZNF689 缺失诱导的 ITH 如何调控 T 细胞介导的抗肿瘤免疫的详细机制。scRNA-seq 对 T 细胞和癌细胞的通路分析显示,ZNF689 缺失组中 IFN 反应和抗原加工和呈递(APP)下调(图 5f, g)。整体 RNA-seq 确认 APP 通路在 siZNF689 处理的 LM2 细胞和高 ITH 肿瘤中显著丧失(图 5h)。RT-qPCR 分析验证了 ZNF689 敲低导致 LM2 和 4T1 细胞中主要组织相容性复合体 I 类(MHC-I)APP 相关基因的 mRNA 水平降低(补充信息,图 S9a, b),表明 ZNF689 参与了抗原呈递的调控。为了揭示 ZNF689 缺失是否影响单细胞的空间分布和基因表达,我们对来自 BALB/c 小鼠的 4T1 肿瘤进行了空间转录组学分析。与之前的发现一致,Znf689 缺失的肿瘤通过 CIN 评分显示出明显且强烈的活动(图 5i)。如图 5j 和补充信息图 S9c, d 所示,T 细胞(包括 CD4+ 和 CD8+ T 细胞)、T 细胞激活和通过 MHC-I 的 APP 的特征评分在 ZNF689 缺失的肿瘤的不同区域中较低且异质。这些特征主要在 ZNF689 缺失肿瘤的肿瘤周围区域观察到,表明其具有更免疫排斥的微环境。此外,原位 LM2 肿瘤中 HLA-ABC、B2M、TAP1 和 PSMB9 的免疫组化(IHC)分析表明,ZNF689 敲低导致这些 MHC-I APP 相关标志物下调主要是由于染色细胞的百分比减少,而不是染色强度(图 5k;补充信息,图 S9e),表明 ITH 还引起了 MHC-I APP 相关蛋白表达的空间异质性。然而,LINE-1 抑制剂 EFV 的治疗显著消除了 ZNF689 敲低在原位 LM2 肿瘤中引起的 MHC-I APP 相关蛋白表达空间异质性的增加(图 5k;补充信息,图 S9e)。
为了进一步阐明 ZNF689 调控 MHC-I APP 相关基因的具体机制,对我们的 Flag-ZNF689 ChIP-seq 数据的分析表明,ZNF689 并未直接结合这些关键基因的启动子(补充信息,图 S10a)。相反,ATAC-seq 显示 ZNF689 敲低时这些基因的染色质可接近性降低(补充信息,图 S10b),表明 ZNF689 在观察到的基因表达下降中发挥作用。RT-qPCR 结果进一步表明,EFV 抵消了 ZNF689 耗竭引起的 APP 相关基因下调(补充信息,图 S10c),与这一抑制与 ZNF689 缺失时 LINE-1 逆转录转座增加相关的假设一致。
为了评估 ZNF689 缺失是否由于 MHC-I 表达受损而限制 CD8+ T 细胞的细胞毒活性,我们将小鼠卵白蛋白(OVA)特异性 CD8+ T 细胞(OT-I)与表达 OVA 的 shNC 和 shZnf689 AT3 肿瘤细胞共同培养(图 5l)。结果表明,肿瘤细胞中的 Znf689 缺失导致 CD8+ T 细胞的细胞毒活性和 CD8+ T 细胞激活降低,表现为 GZMB、IFN-γ和 CD137 表达减少(图 5m;补充信息,图 S10d, e)。这些数据与 shZnf689 AT3 肿瘤细胞相比 shNC 细胞中 SIINFEKL(OVA 肽)–H-2Kb 复合物的呈递减少一致(图 5m)。然而,当肿瘤 - 免疫细胞共培养系统用 LINE-1 抑制剂 EFV 处理时,我们发现肿瘤细胞的抗原呈递和 T 细胞激活得到了恢复(图 5m;补充信息,图 S10d, e)。此外,我们排除了 EFV 对 CD8+ T 细胞的直接影响(补充信息,图 S11a–f)。综上所述,这些数据表明,ZNF689 缺失诱导的 ITH 减少了抗原呈递并抑制了 T 细胞浸润和激活,从而导致 TNBC 中的免疫逃逸和免疫治疗耐药性。
LINE-1 抑制使 ZNF689 缺失诱导的高 ITH 肿瘤对免疫治疗敏感¶
鉴于 LINE-1 抑制在调节 ITH 和抗原呈递中的重要性,我们进一步探讨了 LINE-1 抑制剂 EFV 能否逆转免疫抑制性肿瘤微环境。我们将 4T1 细胞植入 BALB/c 小鼠的乳腺脂肪垫(MFPs)中。EFV 显著抑制了肿瘤生长(图 6a)并延长了 Znf689 缺失组的生存时间(图 6b),而不影响小鼠体重或食物摄入量(补充信息,图 S12a, b)。EFV 有效降低了 Znf689 缺失肿瘤的组织学 ITH(图 6c)。通过流式细胞术,我们发现 EFV 处理的 Znf689 缺失肿瘤中 CD4+ T 细胞、CD8+ T 细胞、GZMB+ 和 IFN-γ+ CD8+ T 细胞的数量比 Veh 对照组多(图 6d)。这些观察结果表明,LINE-1 抑制与免疫治疗联合具有潜在的协同抗肿瘤效应。因此,我们在 BALB/c 小鼠中进行了 Znf689 敲低的 4T1 细胞原位 MFP 移植,以研究靶向 LINE-1 能否使高 ITH 肿瘤对抗 PD-1 治疗敏感。尽管 shNC 和 shZnf689 组之间的抗 PD-1 反应变化很小(补充信息,图 S12c),联合治疗在 shZnf689 组中显示出协同的抗肿瘤效应,与对照组相比肿瘤体积更小(图 6e)。此外,EFV 与抗 PD-1 治疗显著延长了小鼠的生存期(图 6f)。原位 4T1 肿瘤显示,联合治疗显著降低了 ZNF689 缺失肿瘤的组织学 ITH(图 6g)。此外,我们在接受联合治疗的小鼠中检测到微环境重塑;相关变化包括 H2d MHC-I 异体抗原水平显著增加(图 6h)、CD4+ T 细胞(补充信息,图 S12d)和 CD8+ T 细胞的浸润增加,以及 GZMB+ 和 IFN-γ+ CD8+ T 细胞的百分比增加(图 6i)。
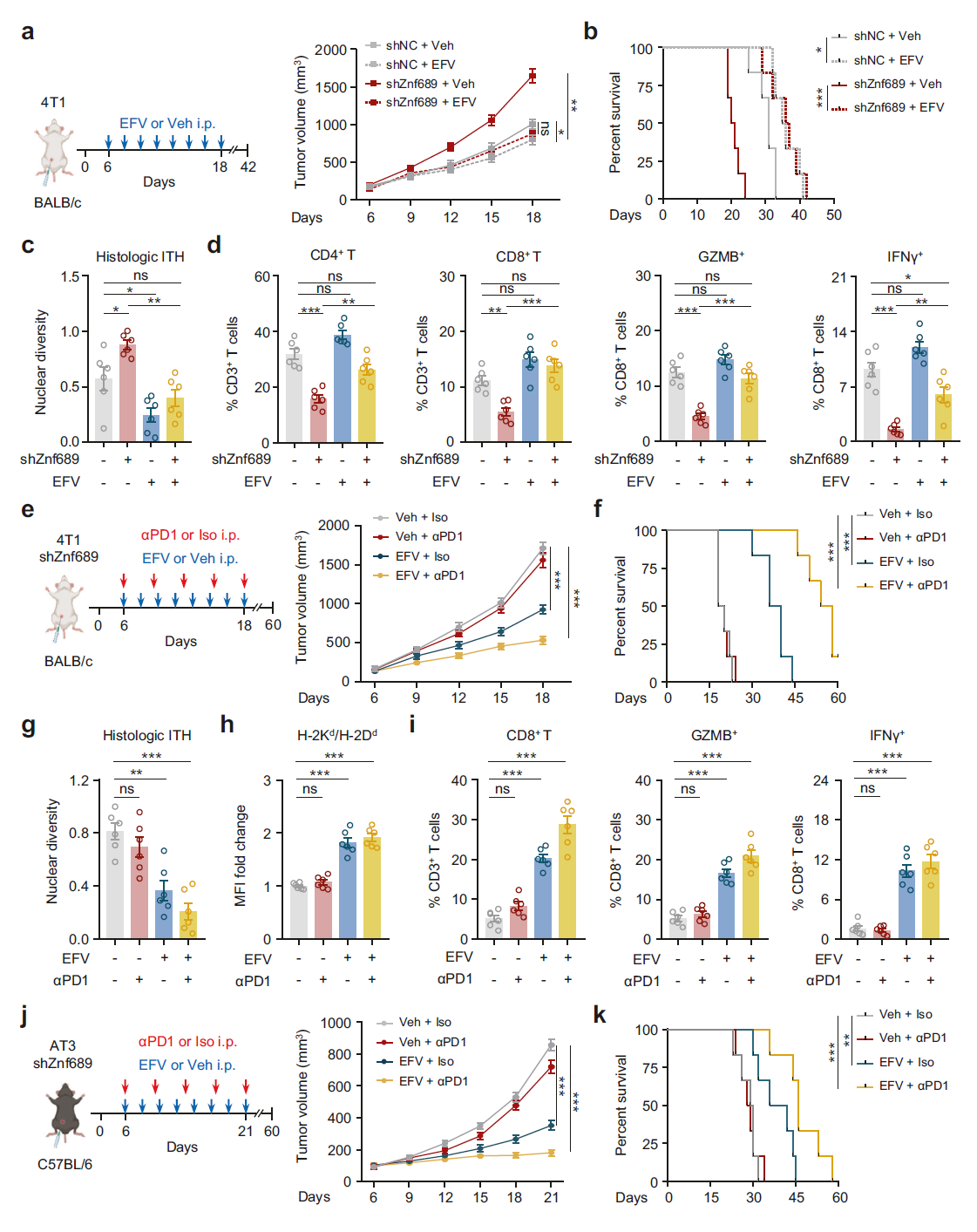
图 6 LINE-1 抑制使 ZNF689 缺失诱导的高 ITH 肿瘤对 TNBC 免疫治疗敏感。 a 在 BALB/c 小鼠中建立原位 4T1 同基因肿瘤模型和 LINE-1 抑制剂 EFV 的治疗方案的示意图。显示肿瘤生长曲线(n = 6 只小鼠/组)。 b a 中小鼠的 Kaplan-Meier 生存曲线。生存数据来自另一个独立实验。 c a 中小鼠原位肿瘤的组织学 ITH(n = 6)。 d 收获 a 中小鼠的原发性肿瘤,通过流式细胞术确定 CD3+ T 细胞中 CD4+ 和 CD8+ T 细胞的百分比以及 CD8+ T 细胞中 GZMB+ 和 IFN-γ+ 细胞的百分比(n = 6)。 e 在 BALB/c 小鼠中建立原位 shZnf689 4T1 同基因肿瘤模型和 PD-1 抗体及 LINE-1 抑制剂 EFV 的治疗方案的示意图。显示肿瘤生长曲线(n = 6 只小鼠/组)。 f e 中小鼠的 Kaplan-Meier 生存曲线。生存数据来自另一个独立实验。 g e 中小鼠原位肿瘤的组织学 ITH(n = 6)。 h e 中小鼠 4T1 肿瘤表面 MHC-I 水平的定量估计(n = 6)。MFI 表示平均荧光强度。 i 收获 e 中小鼠的原发性肿瘤,通过流式细胞术确定 CD3+ T 细胞中 CD8+ T 细胞的百分比以及 CD8+ T 细胞中 GZMB+ 和 IFN-γ+ 细胞的百分比(n = 6)。 j 在 C57BL/6 小鼠中建立原位 shZnf689 AT3 同基因肿瘤模型和 PD-1 抗体及 LINE-1 抑制剂 EFV 的治疗方案的示意图。显示肿瘤生长曲线(n = 6 只小鼠/组)。 k j 中小鼠的 Kaplan-Meier 生存曲线。生存数据来自另一个独立实验。 P 值通过双向 ANOVA(a, e, j)、对数秩检验(b, f, k)和单向 ANOVA(c, d, g–i)确定。ns 表示无显著性差异。
为了排除细胞系或小鼠品系特异性效应,我们通过将 AT3 细胞原位注射到 C57BL/6 小鼠的 MFPs 中建立了 AT3 乳腺癌模型。同样,我们观察到 LINE-1 抑制剂 EFV 与抗 PD-1 联合治疗在 Znf689 缺失组中延迟了肿瘤生长(图 6j)并延长了生存期(图 6k)。此外,联合治疗显著降低了组织学 ITH,增强了抗原呈递,并在 ZNF689 缺失肿瘤中协调了 CD8+ T 细胞的浸润和激活(补充信息,图 S12e, f)。总体而言,这些数据表明,LINE-1 的药理学抑制与免疫治疗联合通过阻断 ITH 和增强抗原呈递,在肿瘤微环境中促进了 CD8+ T 细胞的募集和激活,从而诱导了强效的抗肿瘤免疫。
ZNF689 表达与 TNBC 的良好预后和免疫治疗反应正相关¶
为了进一步验证我们在人 TNBC 样本中的临床前发现,我们通过对组织芯片(n = 283)进行免疫组化(IHC)分析研究了 ZNF689、LINE-1 和 CD8 在 TNBC 患者队列中的表达水平。与我们的发现一致,IHC 结果显示,ZNF689 表达与 LINE-1 ORF1p 水平呈负相关,而与 TNBC 组织中 CD8+ T 细胞浸润呈正相关(图 7a;补充信息,图 S13a)。此外,我们的分析显示,根据 H&E 染色,ZNF689 表达与组织学 ITH 水平呈负相关(图 7a),表明 ZNF689 是 TNBC 中与 ITH 相关的负因子。在生存分析中,我们观察到,与 ZNF689 高表达对应的情况相比,ZNF689 低水平提示 TNBC 患者预后显著更差,表现为更短的 OS、RFS 和 DMFS(图 7b)。来自公共数据库(Kaplan-Meier Plotter)的结果也显示,低 ZNF689 表达与基底样乳腺癌患者的较差预后相关(补充信息,图 S13b)。
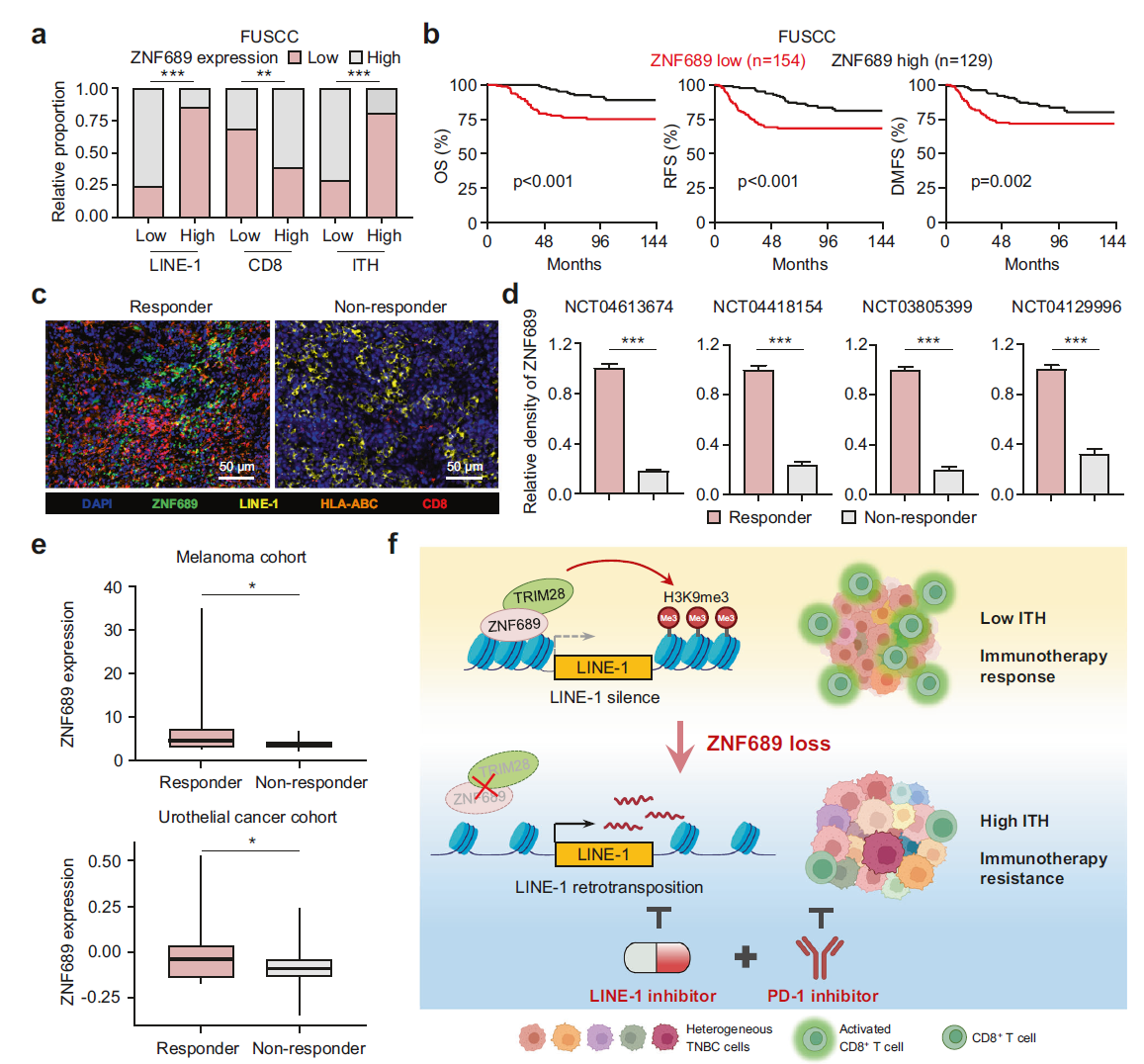
图 7 ZNF689 表达与 TNBC 中的良好预后和免疫治疗反应呈正相关。 a 分析 ZNF689 表达与 TNBC 组织中 LINE-1 ORF1p、CD8 和组织学 ITH 的相关性(n = 283)。 b 根据 ZNF689 表达对 FUSCC TNBC 患者的 OS、RFS 和 DMFS 进行 Kaplan-Meier 分析。 c 使用多重免疫荧光(IF)染色分析一名抗 PD-1 免疫治疗响应者和一名非响应者的代表性样本。比例尺,50 μm。 d 对四项试验中响应者和非响应者中 ZNF689 表达的定量分析。 e 分析黑色素瘤队列(GSE91061)和尿路上皮癌队列(GSE176307)中所有响应者与非响应者患者的 ZNF689 mRNA 水平。 f 提出的工作模型示意图。P 值通过 Pearson χ2 检验(a)、对数秩检验(b)、双尾非配对 Student’s t 检验(d)和单尾 Student’s t 检验(e)确定。
此外,我们通过对接受抗 PD-1 治疗的四项 TNBC 试验(n = 100)中肿瘤的多色 IF 分析,进一步评估了 ZNF689、LINE-1、HLA-ABC 和 CD8 的蛋白表达水平。IF 染色结果显示,抗 PD-1 治疗响应者中,ZNF689、HLA-ABC 和 CD8 表达呈正相关,ZNF689 与 LINE-1 ORF1p 表达呈负相关(图 7c;补充信息,图 S13c)。重要的是,我们发现肿瘤中高 ZNF689 表达与免疫治疗的正反应相关(图 7d)。这些结果与我们的体外和体内研究一致。为了评估这些观察结果是否也适用于其他癌症类型,我们检查了接受抗 PD-1 治疗的黑色素瘤队列(GSE91061)和尿路上皮癌队列(GSE176307),并观察到响应者中 ZNF689 水平较高(图 7e)。与 ZNF689 缺失的效应相似,我们确认多亚克隆 PDX 模型比单亚克隆 PDX 模型对 EFV 表现出更高的敏感性(补充信息,图 S14a–c)。支持我们的发现,患者来源的肿瘤碎片(PDTF)模型表明,针对多亚克隆的高 ITH PDTF,EFV 与抗 PD-1 治疗的联合可以迅速重编程肿瘤微环境,以促进 T 细胞的积累和效应活性(补充信息,图 S14d–f),这对高 ITH 患者的精准治疗可能具有前景。总体而言,这些发现表明,ZNF689 表达与 TNBC 患者的预后和免疫治疗反应呈正相关。
讨论¶
在本研究中,我们揭示了 TNBC 中 ITH 的潜在机制。我们的数据表明,ITH 是 TNBC 患者生存和免疫治疗反应的重要决定因素。值得注意的是,我们发现 ZNF689 缺失通过 TRIM28 复合物介导的 LINE-1 逆转录转座的转录去抑制来促进 ITH。ZNF689 缺失诱导的 ITH 削弱了抗原呈递和 CD8+ T 细胞浸润。使用逆转录酶抑制剂进行的 LINE-1 抑制减少了 ITH,从而增强了 T 细胞活化并促进了抗肿瘤免疫反应。因此,我们建议通过 LINE-1 抑制剂阻断 ITH 可以使高度异质的肿瘤对免疫治疗敏感(图 7f)。
尽管 ITH 在许多肿瘤类型中具有重要的临床相关性,但在大规模队列中评估人类组织样本中的异质性仍然是一个重大挑战。在本研究中,我们全面表征了 FUSCC 和 TCGA 队列中的 TNBC 肿瘤在遗传和组织学水平上的 ITH。使用生物信息学工具 PyClone 检测亚克隆,推断遗传 ITH;使用 H&E 图像检测核多样性,定义组织学 ITH。我们确认 TNBC 中的 ITH 程度变化很大。此外,我们的研究发现组织学 ITH 与遗传 ITH 相关,表明 H&E 染色的肿瘤切片在临床上可用于估计 TNBC 中的 ITH 程度。因此,我们结合患者生存和免疫治疗反应的数据,记录了 ITH 与 TNBC 临床价值之间的关系。与其他癌症类型的观察结果一致,ITH 高的 TNBC 患者的生存率显著低于 ITH 低的患者。来自四项抗 PD-1 临床试验的结果显示,高 ITH 使 TNBC 患者对免疫治疗产生耐药性。这些观察结果强调了使用 ITH 作为评估免疫治疗成功的生物标志物的重要性。
关于 ITH 的确切主导因素和潜在机制的研究仍处于初级阶段。我们的研究确定了 ZNF689 是控制 TNBC 中 ITH 水平的核心蛋白。ZNF689 是一种 C2H2 型锌指转录因子,但其在乳腺癌中的表达、调控和功能尚未明确。我们证明了 ZNF689 缺失在体外和体内有助于 ITH。机制上,我们首次提供了证据表明 ZNF689 通过 TRIM28 复合物介导的转录沉默抑制 LINE-1 逆转录转座。具体而言,ZNF689 直接结合 LINE-1 的启动子,并招募 TRIM28 复合物以促进 H3K9me3 介导的表观遗传沉默。LINE-1 逆转录转座子是人类中唯一能够自主移动的转座子,占人类基因组的 17%。LINE-1 的活动在体细胞组织中大多被抑制,但在许多癌症中被去抑制。因此,LINE-1 被认为是有害的,因为其活动会导致插入突变、染色体重排和基因组不稳定性,这些都会促进癌症发展。新兴证据表明,基因组不稳定性是癌症中遗传异质性的主要原因。我们提供了详细证据表明 LINE-1 逆转录转座子是 ITH 的重要来源,其通过加剧基因组不稳定性发挥作用,这表明阻断 LINE-1 活性来限制肿瘤异质性的潜力。LINE-1 逆转录转座可以通过逆转录酶抑制剂有效控制,这些药物通常用于治疗病毒性疾病。这些药物,包括 EFV,通过抑制几种恶性癌症的增殖、侵袭和转移,显示出抗癌作用。
我们的研究验证了逆转录酶抑制剂 EFV 在 ZNF689 缺失肿瘤中显著限制了遗传和组织学 ITH,并减少了肿瘤生长。因此,这些发现为 ZNF689 如何功能性地调节 LINE-1 逆转录转座以抑制 TNBC 中的 ITH 提供了新的见解。
我们研究的一个重要发现是,高 ITH 不仅加速了肿瘤增殖,还同时削弱了 TNBC 中的免疫反应。高 ITH 肿瘤的生长促进效应主要归因于进化肿瘤的塑性效应和削弱的免疫反应。先前的研究表明,高 ITH 肿瘤通过复杂的机制有效逃避免疫攻击,例如新抗原沉默、抗原呈递受损和 IFN-γ感应通路受损。此外,具有亚克隆抗原的克隆可能在高度异质的肿瘤中经历“稀释”。我们证明了 ZNF689 缺失通过 LINE-1 逆转录转座下调关键的 MHC-I 基因,可能导致这些基因的染色质可接近性降低,从而削弱抗原呈递。先前的研究表明,LINE-1 激活可破坏启动子功能并在插入时降低染色质可接近性,同时也可作为绝缘体影响启动子 - 增强子相互作用。此外,LINE-1 逆转录转座可以引起染色体改变和结构变异,进而重塑染色质的三维结构,影响其可接近性。考虑到 ZNF689 不直接结合抗原呈递相关基因,而 LINE-1 显著影响基因组结构、表观基因组和转录,因此 ZNF689 缺失引起的抗原呈递相关基因下调可能是 LINE-1 逆转录转座的结果。这可能导致免疫浸润减少和 CD8+ T 细胞的细胞毒性活性减弱。然而,ITH 和抗肿瘤免疫之间的相互影响是复杂的;尽管免疫压力可能有利于低 ITH 肿瘤,免疫治疗可能会减少肿瘤多样性。因此,完全理解 ITH 和免疫反应的关系仍然是一个挑战。
大多数 TNBC 患者没有从免疫治疗中获得长期益处。如上所述,ITH 作为一种机制,使肿瘤能够逃避免疫监视并赋予肿瘤对免疫治疗的耐药性,因此构成了一个有前景的治疗靶点。我们证明,靶向 LINE-1 抑制 ITH 可以将 TNBC 的肿瘤微环境转变为有利的状态,表现为增强的抗原呈递和 CD8+ T 细胞浸润。类似的结果报告显示,LINE-1 逆转录转座与免疫激活(尤其是 CD8+ 细胞毒性 T 细胞的浸润)呈负相关。尽管现有研究表明,LINE-1 重新激活可以增强肿瘤免疫原性,我们在 TNBC 中的研究揭示了 LINE-1 逆转录转座与免疫原性之间更复杂的关系。我们提出,ZNF689 丧失后免疫原性的下降以及随后 LINE-1 的激活是 TNBC 的特定属性与 ZNF689 对 LINE-1 的选择性影响之间相互作用的结果。进一步的研究表明,LINE-1 抑制可以改善肺癌模型中的抗肿瘤免疫环境。与此一致,我们的研究证实,通过 LINE-1 抑制靶向 ITH 源头可以使 ZNF689 缺失肿瘤对抗 PD-1 治疗敏感,并与这种治疗结合有效限制 ITH 和肿瘤生长。因此,我们的研究主张探索 LINE-1 抑制剂作为潜在的免疫增敏剂来增强 TNBC 中的免疫治疗。这种方法目前正在对免疫治疗耐药的转移性 TNBC 患者进行概念验证临床试验(NCT05076682),这突显了这一新型治疗策略的前景。
我们承认本研究中存在两个局限性。首先,由于动物福利的考虑,我们的模型可能无法完全复制人类肿瘤的 ITH,因为研究时间较短。其次,ZNF689 缺失诱导的 LINE-1 逆转录转座对抗原呈递相关基因的染色质可接近性影响的复杂效应仍有待阐明。
总之,我们的研究阐明了潜在机制,并揭示了一种通过靶向 LINE-1 与免疫治疗协同作用来使高 ITH 肿瘤可根除的治疗策略,为 TNBC 精准治疗中 LINE-1 抑制剂与免疫治疗的联合使用提供了基础。